Микроциркуляция ( микрогемодинамика ). Проницаемость капилляров. Стенки капилляров. Типы капиляров.
Обновлено: 22.09.2024
Ангиопротекторы — группа фармацевтических средств, предназначенная для лечения заболеваний сердечно-сосудистой системы. Их применяют для улучшения функционирования сосудов, коррекции микроциркуляции, нормализации реологических свойств крови и тканевого обмена. Ангиопротекторы используют для лечения следующих заболеваний: диабетической ретинопатии, нефропатии, ревматического поражения сосудов, атеросклероза, варикоза, трофических язв и прочих ангиопатий.
Препараты данной группы оказывают спазмолитическое действие, расширяют сосуды, уменьшают отеки тканей, стимулируют метаболизм в клетках, восстанавливают состав крови.
Ангиопротекторы оказывают положительное влияние на функциональное состояние сосудистой стенки, нормализуют системный кровоток, повышают сосудистый тонус. Их фармакологическое действие проявляется после взаимодействия с клетками-мишенями: эндотелиоцитами, лейкоцитами, миоцитами.
Препараты из группы ангиопротекторов по происхождению классифицируются на две основные группы: растительного и синтетического происхождения. К растительным относятся «Кумарин», «Диосмин», «Эскузан», к синтетическим - «Добезилат кальция», «Бензарон», «Нафтазон». Препараты растительного происхождения являются более безопасными и имеют меньше побочных эффектов, чем их синтетические аналоги.
По составу антиопротекторные средства подразделяются на:
- Монопрепараты, содержащие одно активное вещество, например «Троксерутин»,
- Комбинированные лекарства, имеющие несколько ингредиентов - «Детралекс», «Венодиол», «Антистакс», «Индовазин».
Механизм действия
Фармакологическое действие препаратов-ангиопротекторов до конца не изучено. Благодаря нормализации микроциркуляции расширяются сосуды и восстанавливается кровяной состав. Это способствует устранению отечности, улучшению обмена веществ и повышению тонуса сосудов.
К группе ангиопротекторов относится много препаратов, которые по-разному оказывают свое терапевтическое воздействие:

- Тормозят биосинтез фермента гиалуронидазы или подавляют активность ее производных,
- Являются антагонистами биологически активных веществ — простагландинов,
- Оказывают антибрадикининовое действие,
- Угнетают агрегацию тромбоцитов,
- Стимулируют образование в стенке капилляров мукополисахаридов,
- Нормализуют проницаемость сосудистых стенок,
- Уменьшают налипание кровяных телец к стенкам сосудов.
Ангиопротекторы угнетают основные звенья патогенеза сосудистых заболеваний: дисрегуляцию сосудистого тонуса, дисфункцию эндотелия, оксидативный стресс, воспалительные реакции.
Показания к применению
Ангиопротекторы назначают больным для лечения следующих патологий:
- Сосудистые заболевания диабетического, ревматологического или атеросклеротического происхождения. Лечебное действие осуществляется путем подавления синтеза гиалуронидазы и уменьшения отека.
- Тромбоз и атеросклероз. Больным назначают ангиопротекторы совместно с гипохолестеринемическими и антитромбоцитарными средствами, а также препаратами, изменяющими способность клеток к адгезии и агрегации.
- Нарушение мозгового и коронарного кровообращения. Благодаря терапевтическому действию препаратов уменьшается зона поражения и повышается резистентность клеток к кислородному голоданию.
- Варикоз и венозная недостаточность. Ангиопротекторы оказывают венотонизирующее, антитромботическое и сосудорасширяющее действие.
Ангиопротекторы применяют также с профилактической целью для предупреждения поражения вен, артерий и капилляров.
Противопоказания
Антиопротекторы имеют целый ряд противопоказаний и состояний, при которых применять препараты следует с осторожностью:
- Беременность,
- Лактационный период,
- Повышенная чувствительность к компонентам препарата,
- Аллергические реакции на препарат,
- Заболевания пищеварительной системы,
- Лица, не достигшие 16-18 лет.
Кремы, мази и гели запрещены лицам, имеющим инфекционные поражения мягких тканей, аллергические реакции на компоненты препарата, поражения кожи с нарушением ее целостности, длительно незаживающие трофические язвы.
Ангиопротекторы для приема внутрь
Большое количество ангиопротекторных средств выпускается фармацевтической промышленностью в виде таблеток и капсул для приема внутрь. Наиболее распространенными и эффективными среди них являются:
«Детралекс»

Флеботропное и ангиопротекторное средство, защищающее кровеносные сосуды и повышающее тонус сосудистой стенки. Он стимулирует лимфодренаж, улучшает микроциркуляцию, устраняет признаки воспаления. «Детралекс» подавляет активацию, миграцию и адгезию лейкоцитов на капиллярном уровне. После непродолжительного приема данного лекарства большинство больных отмечают уменьшение выраженности симптомов патологии: боли, отека, тяжести в ногах. Благодаря этому уровень эмоционального и физического комфорта у пациентов повышается. Препарат используют как с лечебной, так и с профилактической целью. «Детралекс» при необходимости назначают даже беременным женщинами.
«Флебодиа»
Медикаментозное средство, относящееся к группе ангиопротекторов. Оно укрепляет и защищает сосуды, повышает прочность и общую сопротивляемость капилляров, обладает противовоспалительным эффектом и улучшает кровоснабжение кожи. Назначают лекарство пациентам с различными формами венозной недостаточности, чаще всего с геморроем. «Флебодиа» отлично помогает при обострении заболевания и дает хороший результат: исчезают основные симптомы, уменьшаются шишки, пропадает зуд, жжение, боль и прочие неприятные проявления.
«Эскузан»
Ангиопротектор, обладающий антиоксидантными свойствами, уменьшающий отеки и тормозящий процессы экссудации, оказывающий венотонизирующее действие. Экстракт конского каштана, входящий в состав препарата, стимулирует выработку гормонов корой надпочечников и биосинтез простагландинов. «Эскузан» нормализует сократительную активность гладкомышечных волокон, уменьшает ломкость сосудов, улучшает метаболизм в тканях.
«Аскорутин»
Витаминный препарат, участвующий в окислительно-восстановительных реакциях и восполняющий дефицит витаминов С и Р в организме. «Аскорутин» укрепляет сосудистую стенку, понижает ее проницаемость и ломкость. Лекарство укрепляет не только капилляры, но и иммунную систему человека.
«Венорутон»
Обладает ангиопротекторным и флеботонизирующим свойствами. Он предназначен для коррекции нарушения микроциркуляции и восстановления функций эндотелия сосудов. Препарат обладает незначительным противовоспалительным и антиоксидантным действием, угнетает активность медиаторов воспаления. Под воздействием «Венорутона» улучшаются реологические свойства крови, снижается агрегация эритроцитов и нормализуется их структура. Медикамент показан больным с трофическими язвами конечностей, тромбофлебитом, варикозом, геморроем.
«Троксевазин»

Растительное лекарственное средство, нормализующее проницаемость капилляров и уменьшает признаки воспаления. Он устраняет болезненные ощущения, отеки и тяжесть в ногах. Благодаря основному действующего веществу троксерутину он оказывает свое мощное антиоксидантное действие, тонизирует и укрепляет стенки сосудов, избавляет от трофических нарушений.
«Пентоксифиллин»
Ангиопротектор, восстанавливающий микроциркуляцию, оказывающий антиагрегационное действие и снижающий концентрацию внутриклеточного кальция. Кроме таблетированной, существует и инъекционная форма препарата. Его назначают при нарушении периферического и мозгового кровообращения, дистрофии тканей, гипоксии сетчатки. Лекарство противопоказано беременным и кормящим женщинам, лицам с экстрасистолией, кровотечениями и острым инфарктом миокарда.«Венарус»
Венотоник и ангиопротектор, уменьшающий венозный застой и снижающий проницаемость и ломкость капилляров. Благодаря его лечебному воздействию улучшается микроциркуляция и лимфоотток. Систематическое применение лекарства позволяет уменьшить выраженность симптоматики сосудистых заболеваний.
Ангиопротекторы для наружного применения
Местное лечение сосудистых заболеваний заключается в применении лекарств, выпускаемых в форме мазей, гелей и кремов. Список наиболее популярных препаратов:
«Гепатромбин»
Комбинированный препарат для наружного применения с выраженным ангиопротекторным, антитромботическим, регенерирующим, антикоагулянтным и противоотечным действием. Препарат ингибирует коагуляцию крови и тормозит процесс тромбообразования. «Гепатромбин» - противогеморроидальное средство, улучшающее кровоснабжение в зоне воспаления и участвующее в регенерации соединительной ткани. В результате лечения данным препаратом исчезают признаки воспаления: боль, жжение, зуд.
«Лиотон»
Высокоэффективный препарат, созданный для борьбы с отеками и тяжестью в ногах при венозной недостаточности. Выпускают лекарство в виде геля, который быстро и легко проникает к источнику дискомфорта и оказывает свое терапевтическое действие. Он снимает усталость, устраняет болезненные ощущения и возвращает легкость ногам. В основе фармакологического действия данного средства лежит антитромботический и противоэкссудативный эффект. Противовоспалительное действие препарата обусловлено угнетением активности гиалуронидазы непосредственно в очаге воспаления. Благодаря стимуляции фибринолитических свойств крови ускоряются процессы рассасывания гематом и тромбов, уменьшается отечность тканей. Средство имеет приятный лавандовый запах и легкую текстуру, позволяющую быстро впитываться в кожу и не оставлять следов на одежде.

«Индовазин»
Комбинированный ангиопротектор, выпускаемый в форме геля. Он содержит в своем составе два действующих вещества: троксерутин и индометацин, благодаря которым и оказывает одновременно противовоспалительное и ангиопротекторное действие. Он быстро снимает отечность, уменьшает боль и прочие признаки воспаления, улучшает циркуляцию крови и является крайне необходимым в различных жизненных ситуациях. Он эффективно снижает ломкость и уменьшает проницаемость капилляров, тонизирует вены, помогает избавиться в короткие сроки от синяков, уменьшает местную гипертермию и боль в очаге воспаления. Подходит для лечения мелких бытовых травм: ссадин, ушибов.
«Эссаван-гель»
Ангиопротекторный препарат, применяемый при воспалении и расширении вен, отеках конечностей, ушибах и растяжении сухожилий. Он замедляет дальнейшее прогрессирование венозной недостаточности, ускоряет рассасывание синяков, уменьшает отечность тканей.
Самостоятельное лечение сосудистых заболеваний категорически запрещено, а самоназначение большинства ангиопротекторов нежелательно. Лица, имеющие сосудистую дисфункцию, должны периодически посещать специалистов и проходить комплексное лечение. Флебологи, ангиохирурги и кардиологи в индивидуальном порядке подберут тот или иной препарат. Дозировку и длительность терапии выбирают с учетом общего состояния больного и фармакологического действия лекарственного средства.
Микроциркуляция ( микрогемодинамика ). Проницаемость капилляров. Стенки капилляров. Типы капиляров.

Кровеносные и лимфатические капилляры вместе с интерстицием образуют систему микроциркуляции кожи. Нарушения микроциркуляции наблюдаются при изменении проницаемости капиллярной стенки, тонуса стенки прекапиллярных артериол, кровяного давления, а также при истончении коллагеновых волокон ретикулярной дермы (интерстиция). Повреждающее воздействие на микроциркуляцию могут оказывать внешние и внутренние и факторы, такие как гормональные и нейрогенные изменения, резкие колебания высоких и низких температур, механические повреждения кожи, болезни органов пищеварения, высокая доза ультрафиолета. И, конечно, инволютивные изменения — старение. Ниже приводим отрывок из статьи Александра Дубовика, опубликованной в журнале «Косметические средства» и касающейся изменения микроциркуляции кожи при старении.
Изменение кровотока
Старение снижает кровоток в коже, и отчасти это связано с повреждением клеток, выстилающих просвет сосудов (эндотелиальных клеток). Это уменьшает высвобождение веществ, отвечающих за расслабление сосудистой стенки (вазодилататоров), и оксида азота (NO). В некоторых исследованиях продемонстрировано снижение продукции NO в связи с дефектом его фермента — синтазы оксида азота (eNOS). В других исследованиях отмечено снижение доступности аминокислоты L-аргинина, которая является предшественником NO.
Многие работы указывают на снижение биодоступности оксида азота в связи с его окислением свободными радикалами. При этом равновесие смещается в сторону сужения сосудов (вазоконстрикции), а кровоток как в покое, так и в ответе на стресс падает.
Чем старше становится человек, тем менее выраженно усиливается кровоток после передавливания сосудов. Примечательно, что сахарный диабет действует аналогичным образом в любом возрасте, хотя в старости он является усугубляющим фактором. То же самое касается и реакции кожи на температуру — с возрастом она угнетается, а при наличии сахарного диабета слабый ответ отмечается и у молодых людей.
Сегодня нарушение микроциркуляции считается важным фактором развития большинства воспалительных, дистрофических и инволютивных процессов в организме. Так, в исследование Имаевой и соавт. приняли участие 135 женщин от 35 до 60 лет с возрастными изменениями кожи. Для измерения микроциркуляции использовали аппарат лазерной доплеровской флоуметрии и визуальное наблюдение.
Обнаружено, что для пациентов с мелкоморщинистым типом старения характерен спастический тип микроциркуляции — повышение тонуса артериол и застой крови в венулах. Среди пациентов с деформационным типом старения преобладал атонический тип микроциркуляции — повышение объема циркулирующей крови в артериолах и развитие застойных явлений в резистивных и нутритивных сосудах микроциркуляторного русла.
Наконец, для людей с поздним типом старения характерен спастически-застойный тип микроциркуляции — усиление тонуса артериол, застой в капиллярах и венулах.
Изменение проникновения веществ
С возрастом меняются градиенты концентрации, необходимые для проникновения веществ в кожу.
Roskos и соавт. провели измерение чрескожной абсорбции различных веществ у молодых (18-40 лет) и пожилых (старше 65 лет) людей. Гидрокортизон, кофеин, бензойная и ацетилсалициловая кислоты у пожилых людей проникали в кожу значительно хуже, чем у молодых, а всасывание тестостерона и эстрадиола было идентичным в обеих группах. Таким образом, старение негативно влияет на чрескожную абсорбцию, при этом у растворимых в воде веществ (гидрофильных) процесс выражен более значительно.
С возрастом снижается число капиллярных петель, отходящих от субпапиллярного сплетения. Само сплетение становится более извилистым, вытянутым, деформированным и расслабленным. Число перицитов — сократительных клеток капилляров, которые поддерживают, стабилизируют и обеспечивают регуляцию капиллярного кровотока, — с возрастом неуклонно падает. Эти изменения приводят к уменьшению контакта эпидермиса с дермой и ухудшению и питания эпидермиса.
Регенерация дермы нарушается в связи с изменениями в клетках, межклеточном матриксе и сосудах кожи. Дерма более не может полноценно выполнять свою роль по отношению к эпидермису — питать, оказывать структурную поддержку и восстанавливать при ранах.
Почему так происходит
Дело в том, что истончаются и меняют свои характеристики коллагеновые волокна — в глубоких слоях дермы они становятся более волокнистыми. Микрососуды уплотняются, наблюдается тенденция к фрагментации эластиновых волокон со склонностью к патологическому склеиванию.
При старении идет прогрессирующее уменьшение сосудистой сети в связи со снижением числа и размера кровеносных сосудов. Падает активность эндотелиальной синтазы на фоне изменений азотистого сигналинга, усиления оксидативного стресса и нарушения регуляции аргиназы.
Впрочем, несмотря на значительный прогресс в изучении старения микроциркуляторного русла, нам еще предстоит узнать очень и очень много. Новые знания могут привести к созданию препаратов, направленных на устранение микрососудистой дисфункции.
Подробнее о возрастных изменения микроциркуляции и способах их коррекции вы можете прочитать в книге «НОВАЯ КОСМЕТОЛОГИЯ: Возрастная и гендерная косметология», а также в ближайших журналах «ANTI-AGE косметология и медицина» — готовим для вас материалы на эту тему.
Источники:
Дубовик А. Кровоснабжение кожи пожилых людей. Косметические средства 2016; 4: 4-9.
Petrofsky J.S. The effect of type-2-diabetes-related vascular endothelial dysfunction on skin physiology and activities of daily living. J Diabetes Sci Technol 2011; 5(3): 657-667.
Petrofsky J.S. Restingblood flow in the skin: does it exist and what is the influence of temperature, aging and diabetes? J Diabetes Sci Technol 2012; 6(3): 674-685.
Potekaev N., Tkachenko S., Shuginina E., Imaeva N. The microcirculation’s disturbances depending on the ageing type. Cardiovasc Therapy Prevent 2008; 3: 107-110.
Roskos K.V., Maibach H.I, Guy R.H. The effect of aging on percutaneous absorbtion in man. J Pharmacokinet Biopharm 1989; 17(6): 617-630.
Li L., Mac-Mary S., Marsaut D. Age-related changes in skin topography and microcirculation. Arch Dermatol Res 2006; 297: 412-416.
Millis A.J., Hoymle M., McCue H.M., Martini H. Differential expression of metalloproteinase and tissue inhibitor of metalloproteinases genes in aged human fibroblasts. Exp Cell Res 1992; 201: 373-379.
Ogrin R., Darzins P., Khalel Z. Age-related changes in microvascular blood flow and transcutaneous oxygen tension under basal and stimulated conditions. J Gerontol 2005; 60(A): 200-206.
Bolognia J.L. Dermatologic and cosmetic concerns of the older woman. Clin Geriatr Med 1993; 9: 209-229.
Fore J. A review of skin and the effects of ageing on skin structure and functions. Ostomy Wound Manage 2006; 52(9): 24-35.
Braverman I.M., Fonferko E. Studies in cutaneous aging: II. The microvasculature. J Invest Dermatol 1982; 78: 444-448.
Gunin A.G., Petrov V.V., Golubtzova N.N., Vasilieva O.V., Kornilova N.K. Age-related changes in angiogenesis in human dermis. Exp Gerontol 2014; 55: 143-151.
Kenney W.L., Morgan A.L., Farquhar W.B., Brooks E.M., Pierzga J.M., Derr J.A. Decreased active vasodilator sensitivity in aged skin. Am J Physiol 1997; 272: 1609-1614.
Stanhewicz A.E., Bruning R.S., Smith C.J., Kenney W.L., Holowatz L.A. Local tetrahydrobiopterin administration augments reflex cutaneous vasodilation through nitric oxide-dependent mechanisms in aged human skin. J Appl Physiol 2012; 112: 791-797.
КАПИЛЛЯРЫ
Капилляры (лат. capillaris волосной) — самые тонкостенные сосуды микроциркуляторного русла, по к-рым движется кровь и лимфа. Различают кровеносные и лимфатические капилляры (рис. 1).

Рис. 1. Микроциркуляторное русло фиброзной капсулы почки: кровеносные (1) и лимфатические (2) капилляры. Микроскопический препарат, импрегнированный азотистокислым серебром; X 120.
Содержание
Онтогенез
Клеточные элементы стенки капилляров и клетки крови имеют единый источник развития и возникают в эмбриогенезе из мезенхимы. Однако общие закономерности развития кровеносных и лимфатических Капилляров в эмбриогенезе изучены еще недостаточно. На протяжении онтогенеза кровеносные Капилляры постоянно меняются, что выражается в запустевании и облитерации одних Капилляров и новообразовании других. Возникновение новых кровеносных К. происходит путем выпячивания («почкования») стенки ранее образовавшихся К. Этот процесс происходит при усилении функции того или иного органа, а также при реваскуляризации органов. Процесс выпячивания сопровождается делением эндотелиальных клеток и увеличением размеров «почки роста». При слиянии растущего К. со стенкой предсуществующего сосуда происходит перфорация эндотелиальной клетки, расположенной на верхушке «почки роста», и соединение просветов обоих сосудов. Эндотелий капилляров, образующихся путем почкования, не имеет межэндотелиальных контактов и называется «бесшовным». К старости строение кровеносных К. существенно меняется, что проявляется уменьшением числа и размеров капиллярных петель, увеличением расстояния между ними, появлением резко извитых К., в которых сужения просвета чередуются с выраженными расширениями (Старческий варикоз, по Д. А. Жданову), а также значительным утолщением базальных мембран, дистрофией эндотелиальных клеток и уплотнением соединительной ткани, окружающей К. Эта перестройка вызывает снижение функций газообмена и питания тканей.
Кровеносные капилляры имеются во всех органах и тканях, они являются продолжением артериол, прекапиллярных артериол (прекапилляров) или, чаще, боковыми ветвями последних. Отдельные К., объединяясь между собой, переходят в посткапиллярные венулы (посткапилляры). Последние, сливаясь друг с другом, дают начало собирательным венулам, выносящим кровь в более крупные венулы. Исключением из этого правила у человека и млекопитающих являются синусоидные (с широким просветом) К. печени, расположенные между приносящими и выносящими венозными микрососудами, и клубочковые К. почечных телец, расположенные по ходу приносящих и выносящих артериол.
Кровеносные К. впервые обнаружил в легких лягушки М. Мальпиги в 1661 г.; спустя 100 лет Спалланцани (L. Spallanzani) нашел К. и у теплокровных животных. Открытие капиллярных путей транспорта крови завершило создание научно обоснованных представлений о замкнутой системе кровообращения, заложенных У. Гарвеем. В России начало систематическому изучению К. положили исследования Н. А. Хржонщевского (1866), А. Е. Голубева (1868), А. И. Иванова (1868), М. Д. Лавдовспого (1870). Существенный вклад в изучение анатомии и физиологии К. внес дат. физиолог А. Крог (1927). Однако наибольшие успехи в изучении структурно-функциональной организации К. были достигнуты во второй половине 20 в., чему способствовали многочисленные исследования, выполненные в СССР Д. А. Ждановым с сотр. в 1940—1970 гг., В. В. Куприяновым с сотр. в 1958—1977 гг., А. М. Чернухом с сотр. в 1966—1977 гг., Г. И. Мчедлишвили с сотр. в 1958— 1977 гг. и др., а за рубежом — Лендисом (E. М. Landis) в 1926—1977 гг., Цвейфахом (В. Zweifach) в 1936—1977 гг., Ренкином (E. М. Renkin) в 1952— 1977 гг., Паладе (G.E. Palade) в 1953— 1977 гг., Касли-Смитом (Т. R. Casley-Smith) в 1961—1977 гг., Видерхильмом (С. A. Wiederhielm) в 1966—1977 гг. и др.
Кровеносным К. принадлежит существенная роль в системе кровообращения; они обеспечивают транскапиллярный обмен — проникновение растворенных в крови веществ из сосудов в ткани и обратно. Неразрывная связь гемодинамической и обменной (метаболической) функций кровеносных К. находит выражение в их строении. По данным микроскопической анатомии, К. имеют вид узких трубок, стенки которых пронизаны субмикроскопическими «порами». Капиллярные трубки бывают относительно прямыми, изогнутыми или закрученными в клубочек. Средняя длина капиллярной трубки от прекапиллярной артериолы до посткапиллярной венулы достигает 750 мкм, а площадь поперечного сечения— 30 мкм 2 . Калибр К. в среднем соответствует диаметру эритроцита, однако в разных органах внутренний диаметр К. колеблется от 3—5 до 30—40 мкм.

Рис. 2. Схематическое изображение строения стенки кровеносного капилляра: 1 — эндотелиальная оболочка; 2 — базальная оболочка, состоящая из базальной мембраны (3) и перицитов (4), в просвете капилляра видны эритроциты (5).
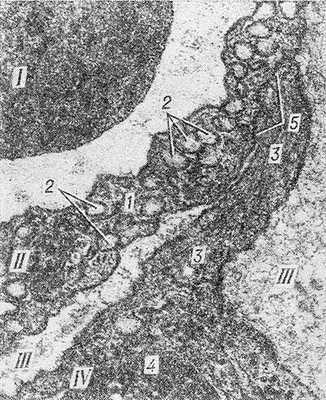
Рис. 3. Электронограмма фрагмента стенки кровеносного капилляра из околоушной слюнной железы: I — часть эритроцита в просвете капилляра; II — эндотелиоцит (1 — цитоплазма, 2 — микропиноцитозные везикулы); III — базальная мембрана; IV — перицит, расположенный в толще базальной мембраны (3 — цитоплазма, 4 — ядро, 5 — контакт отростка перицита с эндотелиоцитом).

Рис. 4. Электронограмма элементов стенки кровеносных капилляров: а — внутримозговой капилляр (1 — гликопротеидовое покрытие, 2 — эндотелиоцит); х 60 000; б — межклеточный контакт в эндотелиальной оболочке гломерулярного капилляра почки (1 — цитоплазма соседних эндотелиоцитов, 2 — контактирующие цитолеммы, 3 - межмембранный промежуток); х 90 000; в и г — гломерулярные капилляры почки (1 - открытые фенестры; 2 — диафрагмальные фенестры в цитоплазме эндотелиоцитов); X 70 000; д — стенка синусоидного капилляра печени (1 — прерывистый контакт между смежными эндотелиоцитами 2); х 35 000.
Как показали электронно-микроскопические наблюдения, стенка кровеносного К., часто называемая капиллярной мембраной, состоит из двух оболочек: внутренней — эндотелиальной и наружной — базальной. Схематическое изображение строения стенки кровеносного К. представлено на рисунке 2, более детальное — на рисунках 3 и 4.
Эндотелиальная оболочка образована уплощенными клетками — эндотелиоцитами (см. Эндотелий). Число эндотелиоцитов, ограничивающих просвет К., обычно не превышает 2—4. Ширина эндотелиоцита колеблется от 8 до 19 мкм и длина — от 10 до 22 мкм. В каждом эндотелиоците выделяют три зоны: периферическую, зону органелл, ядросодержащую зону. Толщина этих зон и их роль в обменных процессах различны. Половину объема эндотелиоцита занимают ядро и органеллы — пластинчатый комплекс (комплекс Гольджи), митохондрии, зернистая и незернистая сеть, свободные рибосомы и полисомы. Органеллы сконцентрированы вокруг ядра, вместе с к-рым составляют трофический центр клетки. Периферическая зона эндотелиоцитов выполняет в основном обменные функции. В цитоплазме этой зоны располагаются многочисленные микропиноцитозные везикулы и фенестры (рис. 3 и 4). Последние представляют собой субмикроскопические (50—65 нм) отверстия, которые пронизывают цитоплазму эндотелиоцитов и бывают перекрыты истонченной диафрагмой (рис. 4, в, г), являющейся дериватом клеточной мембраны. Микропиноцитозные везикулы и фенестры, участвующие в трансэндотелиальном переносе макромолекул из крови в ткани и обратно, в физиологии называют крупными «норами». Каждый эндотелиоцит покрыт снаружи тончайшим слоем продуцируемых им гликопротеидов (рис. 4, а), последние играют немаловажную роль в поддержании постоянства микросреды, окружающей клетки эндотелия, и в адсорбции веществ, транспортируемых через них. В эндотелиальной оболочке соседние клетки объединяются с помощью межклеточных контактов (рис. 4, б), состоящих из цитолемм смежных эндотелиоцитов и межмембранных промежутков, заполненных гликопротеидами. Эти промежутки в физиологии чаще всего отождествляют с мелкими «порами», через которые проникают вода, ионы и белки с низким молекулярным весом. Пропускная способность межэндотелиальных промежутков различна, что объясняется особенностями их строения. Так, в зависимости от толщины интерцеллюлярной щели различают межэндотелиальные контакты плотного, щелевого и прерывистого типов. В плотных контактах интерцеллюлярная щель на значительном протяжении полностью облитерирована благодаря слиянию цитолемм смежных эндотелиоцитов. В щелевых контактах величина наименьшего расстояния между мембранами соседних клеток колеблется между 4 и 6 нм. В прерывистых контактах толщина межмембранных промежутков достигает 200 нм и более. Межклеточные контакты последнего типа в физиологической литературе также отождествляют с крупными «порами».
Базальная оболочка стенки кровеносного К. состоит из клеточных и неклеточных элементов. Неклеточный элемент представлен базальной мембраной (см.), окружающей эндотелиальную оболочку. Большинство исследователей рассматривает базальную мембрану как своеобразный фильтр толщиной 30—50 нм с размерами пор, равными — 5 нм, в к-ром сопротивление проникновению частиц возрастает с увеличением диаметра последних. В толще базальной мембраны расположены клетки — перициты; их называют адвентициальными клетками, клетками Руже, или интрамуральными перицитами. Перициты имеют вытянутую форму и изогнуты в соответствии с внешним контуром эндотелиальной оболочки; они состоят из тела и многочисленных отростков, которые оплетают эндотелиальную оболочку К. и, проникая через базальную мембрану, вступают в контакты с эндотелиоцитами. Роль этих контактов, так же как и функции перицитов, достоверно не выяснена. Высказано предположение об участии перицитов в регуляции роста эндотелиальных клеток К.
Морфологические и функциональные особенности кровеносных капилляров
Кровеносные Капилляры разных органов и тканей обладают типовыми особенностями строения, что связано со спецификой функции органов и тканей. Принято различать три типа К.: соматический, висцеральный и синусоидный. Стенка кровеносных капилляров соматического типа характеризуется непрерывностью эндотелиальном и базальной оболочек. Как правило, она малопроницаема для крупных молекул белка, но легко пропускает воду с растворенными в ней кристаллоидами. К. такой структуры обнаружены в коже, скелетной и гладкой мускулатуре, в сердце и коре полушарий большого мозга, что соответствует характеру обменных процессов в этих органах и тканях. В стенке К. висцерального типа имеются окошки — фенестры. К. висцерального типа характерны для тех органов, которые секретируют и всасывают большие количества воды и растворенных в ней веществ (пищеварительные железы, кишечник, почки) или же участвуют в быстром транспорте макромолекул (эндокринные железы). К. синусоидного типа обладают большим просветом (до 40 мкм), что сочетается с прерывистостью их эндотелиальной оболочки (рис. 4, д) и частичным отсутствием базальной мембраны. К. этого типа обнаружены в костном мозге, печени и селезенке. Показано, что через их стенки легко проникают не только макромолекулы (напр., в печени, к-рая продуцирует основную массу белков плазмы крови), но и клетки крови. Последнее характерно для органов, участвующих в процессе кроветворения.
Стенка К. имеет не только общую природу и тесную морфол, связь с окружающей соединительной тканью, но связана с ней и функционально. Поступающая из кровеносного русла через стенку К. в окружающую ткань жидкость с растворенными в ней веществами и кислород переносятся рыхлой соединительной тканью ко всем остальным тканевым структурам. Следовательно, перикапиллярная соединительная ткань как бы дополняет собой микроциркуляторное русло. Состав и физ.-хим. свойства этой ткани в значительной мере определяют условия транспорта жидкости в тканях.
Сеть К. является значительной рефлексогенной зоной, посылающей к нервным центрам различные импульсы. По ходу К. и окружающей их соединительной ткани находятся чувствительные нервные окончания. По-видимому, среди последних значительное место занимают хеморецепторы, сигнализирующие о состоянии обменных процессов. Эффекторные нервные окончания у К. в большинстве органов не обнаружены.
Сеть Капилляров, образованная трубками малого калибра, где суммарные показатели поперечного сечения и площади поверхности значительно превалируют над длиной и объемом, создает наиболее благоприятные возможности для адекватного сочетания функций гемодинамики и транскапиллярного обмена. Характер транскапиллярного обмена (см. Капиллярное кровообращение) зависит не только от типовых особенностей строения стенок К.; не меньшее значение в этом процессе принадлежит связям между отдельными К. Наличие связей свидетельствует об интеграции К., а следовательно, и о возможности различного сочетания их функц, активности. Основной принцип интеграции К.— объединение их в определенные совокупности, составляющие единую функциональную сеть. Внутри сети положение отдельных К. неодинаково по отношению к источникам доставки крови и ее оттока (т. е. к прекапиллярным артериолам и посткапиллярным венулам). Эта неоднозначность выражается в том, что в одной совокупности К. связаны между собой последовательно, благодаря чему устанавливаются прямые коммуникации между приносящими и выносящими микро-сосудами, а в другой совокупности К. располагаются параллельно по отношению к К. указанной выше сети. Такие топографические различия К. обусловливают неоднородность распределения потоков крови в сети.

Рис. 5. Схематическое изображение строения стенки лимфатического капилляра с элементами окружающей соединительной ткани; 1 — эндотелиоцит; 2 — просвет лимфатического капилляра; 3 — коллагеновые протофибриллы соединительной ткани; 4—«якорные» филаменты; 5 — соединительная ткань.

Рис. 6. Электронограмма элементов стенки лимфатических капилляров и окружающей их соединительной ткани: а — эндотелиоцит (стрелками указаны микропиноцитозные везикулы); х 20 000; б — «якорные» филаменты (1), фиксирующие эндотелиоцит (2) к окружающим его коллагеновым протофибриллам (3); х 50 000; в и г — цитоплазма эндотелиоцитов (1 — лизосома, 2 — остаточное тельце); X 60 000.
Лимфатические капилляры
Лимфатические капилляры (рис. 5 и 6) представляют собой систему замкнутых с одного конца эндотелиальных трубок, которые выполняют дренажную функцию — участвуют во всасывании из тканей фильтрата плазмы и крови (жидкости с растворенными в ней коллоидами и кристаллоидами), некоторых форменных элементов крови (лимфоцитов, эритроцитов), участвуют также в фагоцитозе (захват инородных частиц, бактерий). Лимф. К. отводят лимфу через систему интра- и экстраорганных лимф, сосудов в главные лимфатические коллекторы — грудной проток и правый лимфатический проток (см. Лимфатическая система). Лимф. К. пронизывают ткани всех органов, за исключением головного и спинного мозга, селезенки, хрящей, плаценты, а также хрусталика и склеры глазного яблока. Диаметр их просвета достигает 20—26 мкм, а стенка, в отличие от кровеносных К., представлена лишь резко уплощенными эндотелиоцитами (рис. 5). Последние примерно в 4 раза крупнее, чем эндотелиоциты кровеносных К. В клетках эндотелия, кроме обычных органелл и микропиноцитозных везикул, встречаются лизосомы и остаточные тельца — внутриклеточные структуры, возникающие в процессе фагоцитоза, что объясняется участием лимф. К. в фагоцитозе. Другая особенность лимф. К. заключается в наличии «якорных», или «стройных», филаментов (рис. 5 и 6), осуществляющих фиксацию их эндотелия к окружающим К. коллагеновым протофибриллам. В связи с участием в процессах всасывания межэндотелиальные контакты в их стенке имеют различное строение. В период интенсивной резорбции ширина межэндотелиальных щелей увеличивается до 1 мкм.
Методы исследования капилляров
При изучении состояния стенок Капилляров, формы капиллярных трубок и пространственных связей между ними широко используют инъекционные и безынъекционные методики, различные способы реконструкции К., трансмиссионную и растровую электронную микроскопию (см.) в сочетании с методами морфометрического анализа (см. Морфометрия медицинская) и математического моделирования; для прижизненного исследования К. в клинике применяют микроскопию (см. Капилляроскопия).
Библиография: Алексеев П. П. Болезни мелких артерий, капилляров и артериовенозных анастомозов, Л., 1975, библиогр.; Казначеев В. П. и Дзизинский А. А. Клиническая патология транскапиллярного обмена, М., 1975, библиогр.; Куприянов В. В., Караганов Я. Л. и Козлов В. И. Микроциркуляторное русло, М., 1975, библиогр.; Фолков Б. и Нил Э. Кровообращение, пер. с англ., М., 1976; Чернух А. М., Александров П. Н. иАлексеев О. В. Микроциркуляции, М., 1975, библиогр.; Шахламов В. А. Капилляры, М., 1971, библиогр.; Шошенко К. А. Кровеносные капилляры, Новосибирск, 1975, библиогр.; Hammersen F. Anatomie der terminalen Strombahn, Miinchen, 1971; Krоgh A. Anatomie und Physiologie der Capillaren, B. u. a., 1970, Bibliogr.; Microcirculation, ed. by G. Kaley a. B. M. Altura, Baltimore a. o., 1977; Simionescu N., Simionescu M. a. Palade G. E. Permeability of muscle capillaries to small heme peptides, J. cell. Biol., v. 64, p. 586, 1975; Zweifach B. W. Microcirculation, Ann. Rev. Physiol., v. 35, p. 117, 1973, bibliogr.
КАПИЛЛЯРНОЕ КРОВООБРАЩЕНИЕ
Капиллярное кровообращение — движение крови в системе микроциркуляции, центральной частью к-рой являются капилляры. Капиллярное кровообращение осуществляет основную функцию микроциркуляторной системы — транскапиллярный обмен, т. е. обмен веществ между кровью и тканями. Общее число капилляров (см.) в большом круге кровообращения составляет несколько миллиардов. По данным А. Крога (1927), в 1 мм 3 скелетной мышцы человека находится ок. 2000 капилляров, собаки — 2630, лошади — 1350. По расчетам 1 мл крови, находящейся в капиллярах скелетных мышц, имеет поверхность соприкосновения с эндотелием капилляров, достигающую 0,5 м 2 . Такая большая поверхность соприкосновения крови со стенками капилляров благоприятствует происходящему в них обмену веществ, в частности газообмену между кровью и тканями.
Хотя плотность капиллярной сети необыкновенно велика, число перфузируемых капилляров широка варьирует в зависимости от функционального состояния ткани или органа. Морфологический анализ капиллярного русла у различных животных показал, что структура капилляра является устойчивой и малоизменяющейся. Стенка капилляра не содержит гладкомышечных клеток, что указывает на невозможность активного сокращения. Прижизненные исследования и результаты электронно-микроскопического анализа позволяют прийти к выводу, что эндотелиальные клетки капилляров, не обладая специфической сократительной функцией, в определенных условиях способны сокращаться. Весьма вероятен также пассивный механизм изменения просвета капилляра, обусловленный разностью гидростатического давления внутри капилляра и окружающей ткани.
Наряду с капиллярами, выполняющими обменную функцию (их иногда называют нутритивными капиллярами), Г. И. Мчедлишвили (1958), Цвейфах (В. Zweifach, 1961), В. В. Куприянов с соавт. (1975) описывают еще и так наз. магистральные капилляры. Морфологически магистральные капилляры идентичны обычным, однако имеют большой диаметр. Скорость кровотока в таких капиллярах в 2—3 раза выше скорости кровотока в обычных капиллярах. Функционально, по мнению В. В. Куприянова с соавт. (1975), магистральные капилляры выполняют роль полушунтов, обеспечивая переход артериальной крови в венозные сосуды.
Функция капилляров заключается в обеспечении транскапиллярного обмена, т. е. в снабжении клеток органов и тканей питательными и пластическими веществами и удалении продуктов метаболизма. Для реализации этой функции необходимо соблюдение ряда условий, важнейшим из которых являются определенные величины гидростатического и онкотического давления в капилляре (см. Капиллярное давление), скорости кровотока в капилляре, проницаемости стенки капилляра, определенное число перфузируемых капилляров на единицу объема ткани.
Общее число капилляров в различных тканях неодинаково. В тканях с высоким уровнем обмена число капилляров на 1 мм 2 поперечного сечения больше, чем в тканях с менее интенсивным обменом. Напр., в сердечной мышце число капилляров на 1 мм 2 сечения в 2 раза больше, чем в скелетной мышце; в сером веществе головного мозга капиллярная сеть значительно гуще, чем в белом веществе.
Обмен веществ через капиллярную стенку осуществляется путем фильтрации, диффузии, а также микровезикулярного транспорта. Фильтрация происходит за счет гидростатического капиллярного давления. Этот процесс обеспечивает водно-солевой гомеостаз тканей и специализированные формы транспорта при образовании лимфы, экссудата и др. Коэффициент капиллярной фильтрации выражают количеством жидкости (в мкл), к-рая фильтруется через определенную площадь стенки сосуда (в мкм 2 ) в единицу времени (сек.) при определенном давлении крови (в см вод. ст.). Диффузия (см.) обеспечивает перенос пластических и питательных веществ, а также устранение продуктов метаболизма. При этом капиллярную проницаемость можно определить по первому закону Фика:
где —dn/dt — скорость диффузии, pS — произведение капиллярной проницаемости р-ра (p) на эффективную поверхность (S) эндотелия капилляра, Δc — разность концентраций по обе стороны капиллярной стенки.
Помимо пассивной диффузии в капиллярах наблюдается продвижение веществ против градиента концентрации — путем так наз. активного переноса молекул (см. Транспорт ионов). Полагают, что в мембранах клеток имеются особые вещества — пермеазы, или ионофоры (см.), которые путем образования комплекса с тем или иным веществом обеспечивают его поступление в клетку.
Электронно-микроскопические исследования показали, что в трансэндотелиальном переносе веществ принимают участие микровезикулы (так наз. микровезикулярный транспорт). Микровезикулы, образующиеся на одной поверхности, перемещаются к противоположной, где соединяются с клеточной оболочкой и освобождаются от содержимого в субэндотелиальное пространство. При электронно-микроскопическом изучении путей выхода макромолекул и микрочастиц из кровотока был прослежен процесс «загрузки» микровезикул при их формировании на одной клеточной поверхности, перемещение везикул к противоположной поверхности и освобождение содержимого в подэндотелиальное пространство. Объемная скорость везикулярного транспорта достигает 6—10 везикул/мкм 2 эндотелия в секунду.
Важнейшим показателем функционирования микроциркуляторного русла является скорость кровотока в капиллярах. Прижизненные исследования показали, что у животных средняя скорость движения эритроцитов в капиллярах составляет 0,5—1 мм/сек, а в капиллярах кожи человека — 0,74 мм/сек. В эксперименте показано, что в легочных капиллярах кошки скорость может достигать 2 мм/сек. Через альвеолярный капилляр длиной 248 мкм эритроцит проходит за 0,12 сек.; этот промежуток и определяет продолжительность контакта эритроцита с альвеолярным воздухом. Скорость кровотока в капиллярах определяется градиентом давления в прекапиллярах и посткапиллярах. Градиент в свою очередь зависит от величины общего артериального и венозного давления и периферического сопротивления.
Поток эритроцитов, проходящих через капилляр, широко варьирует и в зависимости от функционального состояния органа может колебаться от 300 до 1500 эритроцитов в минуту.
Величина транскапиллярного обмена зависит, в частности, от числа перфузируемых капилляров, т. е. таких, в которых движутся эритроциты. Капилляры, не содержащие в данный момент эритроцитов и заполненные плазмой, получили название плазматических. В условиях функционального покоя органа число перфузируемых капилляров составляет 30— 50% от общего числа капилляров. При усиленной работе органа плазматические капилляры заполняются эритроцитами. Термины «перфузируемые» и «закрытые» капилляры весьма условны, так же как и термины «неперфузируемые» и «открытые» капилляры. Так, напр., капилляр, по к-рому не движутся эритроциты, не является неперфузируемым в строгом смысле, ибо по нему может перемещаться плазма. Закрытые капилляры, т. е. сосуды, просвет которых почти полностью перекрыт спавшимися стенками, встречаются только в паренхиматозных органах (легкие, селезенка, печень) в связи с эластичностью их стромы. В тканях с более жесткой стромой, как показали прижизненные наблюдения, закрытых капилляров нет.
В условиях патологии при появлении агрегатов из склеившихся эритроцитов, закупоривающих отдельные капилляры, возрастает число плазматических капилляров и микрососудов. Процесс агрегации эритроцитов (см.) обратим, и при восстановлении гемодинамических параметров агрегаты «разбиваются» (дезагрегация) до отдельных эритроцитов.
Существует мнение, что число перфузируемых капилляров определяется работой прекапиллярного сфинктера. Однако эта точка зрения не разделяется многими исследователями. Прекапиллярный сфинктер образован двумя гладкомышечными клетками в месте отхождения прекапилляра от метартериолы (прекапиллярной артериолы). Основные сведения о прекапиллярном сфинктере были получены при изучении микрососудов ретролингвальной мембраны лягушки. Была показана моторная иннервация прекапиллярного сфинктера, независимость его функции от сокращения метартериолы и высокая чувствительность к вазоактивным веществам, механическим воздействиям и продуктам тканевого метаболизма. Предполагают, что гладкомышечные клетки прекапиллярного сфинктера имеют определенный тонус, обусловливающий состояние относительной констрикции. При усиленной работе органа накапливающиеся продукты метаболизма снижают тонус гладкомышечных клеток, вызывают дилатации). Возникающее при этом усиление капиллярного кровотока (увеличение числа активных капилляров) обеспечивает удаление избытка метаболитов, что приводит к восстановлению тонуса мышечных клеток и уменьшению кровотока. При длительной констрикции прекапиллярного сфинктера в эксперименте отмечали усиление адсорбции (поступление жидкости из ткани в капилляры), тогда как преобладание длительной дилатации усиливало фильтрацию (выход жидкости из капилляров). Вопрос о функции прекапиллярного сфинктера у млекопитающих остается открытым, однако некоторые авторы в работе прекапиллярного сфинктера видят единственный механизм регуляции К. к. Число перфузируемых капилляров определяется соотношением артериального и венозного давления на уровне прекапиллярного сфинктера. Апериодическая прерывистость кровотока в капиллярах может быть обусловлена закупориванием устья прекапилляра лейкоцитом, который с трудом преодолевает узкое устье прекапилляра. После прохождения лейкоцита кровоток в капиллярах восстанавливается.
Т. о., регуляция К. к. осуществляется в основном с помощью гуморальных механизмов. Одновременно следует учитывать, что микроциркуляторное русло органов и тканей вовлечено в общую систему гемоциркуляции. Следовательно, при наличии выраженной автономности капиллярного кровотока последний в значительной степени обусловлен центральной гемодинамикой, что особенно четко проявляется при резком снижении АД. Нервная регуляция функции капилляров (в частности, их проницаемости) осуществляется опосредованно — с помощью вазоактивных веществ, выделяемых, напр., тучными клетками, под действием нейромедиаторов (см. Нейрогуморальная регуляция).
Согласно представлениям А. Л. Чижевского (1959), эритроцит в капилляре занимает такое положение, при к-ром его боковые поверхности расположены вдоль оси сосуда. При этом вращение эритроцита прекращается, но происходит его деформация. Прижизненная микроскопия позволила наблюдать деформацию эритроцита, движущегося в капилляре и принимающего форму капли, груши, колокольчика, подковы, цилиндра и т. п. Такие формы эритроцит принимает в посткапиллярах, диаметр которых значительно превышает его диаметр. В капиллярах, диаметр которых близок к диаметру эритроцитов, последние своей широкой поверхностью расположены поперек потока и движутся почти вплотную один за другим, выполняя тем самым функцию своеобразных поршней (поршневой механизм прохождения эритроцитов). Скорость движения таких эритроцитов по прекапиллярам значительно выше, чем у деформирующихся. Движение эритроцитов в капилляре вплотную друг за другом обеспечивает гидродинамическую стабилизацию положения эритроцита, а также исключает возможность его вращения. Такое положение эритроцита наиболее выгодно для процесса диффузии кислорода.
Реологические свойства крови также влияют на Капиллярное кровообращение. Текучесть крови зависит от степени ее вязкости. Выявлена прямая зависимость между величиной гематокрита (т. е. объема эритроцитов в процентах) и вязкостью крови, однако даже при гематокрите 98% кровь сохраняет текучесть. При величине гематокрита 20% вязкость крови в 10 раз ниже, чем при гематокрите 90%. В капиллярах величина гематокрита (Нс) может быть рассчитана по формуле:

где N — число эритроцитов в капилляре, VR — средний объем эритроцита, D — средний диаметр капилляра, a L — его длина. Поскольку в капиллярах гематокрит сравнительно постоянен, то в капиллярах с внутренним диам. 5 мкм и меньше вязкость крови уже практически не зависит от гематокрита.
Одной из наиболее частых форм патологии в системе микроциркуляции является внутрисосудистая агрегация эритроцитов и других форменных элементов крови. Появление в крови большого количества агрегатов различной формы и величины уменьшает суммарную поверхность эритроцитов, создает условия для механической закупорки микро-сосудов и капилляров, в которых прекращается кровоток. Развивающаяся гипоксия тканей, в т. ч. сосудистой стенки, вызывает увеличение ее адгезивных свойств, что приводит к прилипанию лейкоцитов, уменьшающих просвет микрососуда и затрудняющих кровоток. Чем сильнее выражена агрегация эритроцитов, тем резче снижена суспензионная стабильность крови, что приводит к отделению плазмы от эритроцитов и возникновению плазматических капилляров, не содержащих эритроцитов. Существенным фактором в механизме агрегации эритроцитов является первичное снижение скорости кровотока.
Вторичное уменьшение кровотока при ожогах, жировой эмболии, токсическом гемотрансфузионном и кардиогенном шоке, тромбозах, олигурии, операциях на сердце и сосудах, острой артериальной недостаточности, гипотермии, экстракорпоральном кровообращении, при инфекциях и травмах обусловливается самой агрегацией эритроцитов. Агрегация эритроцитов зависит также от соотношения концентраций высоко- и низкомолекулярных белков плазмы крови. При увеличении концентрации высокомолекулярных белков (фибриноген) создаются реальные предпосылки для агрегации эритроцитов. Агрегация эритроцитов является вторичным процессом, отражающим реакцию системы крови на повреждение.
При многих патологических процессах (травма, воспаление, отек) главным звеном патогенеза является повышение проницаемости стенки капилляра (см. Проницаемость).
Прохождение лейкоцитов и эритроцитов (диапедез) через капиллярную стенку является основным компонентом патогенеза воспаления (см.). Методом электронной микроскопии была детально изучена динамика диапедеза (см.). Лейкоциты проникают в основном через межэндотелиальные соединения. Нейтрофил пропускает тонкий псевдоподий в место соединения эндотелиальных клеток, а затем, как бы переливаясь в проникшую часть псевдоподия, проходит через стенку капилляра без разрушения последней. Диапедез лимфоцитов следует после прохода лейкоцитов, которые, по-видимому, каким-то образом воздействуют на эндотелиальную клетку и облегчают переход лимфоцитов. Лимфоциты проходят через эндотелиальную клетку путем образования большой вакуоли, постепенно продвигающейся от просвета сосуда к периваскулярному пространству. Диапедез эритроцитов, вероятно, осуществляется пассивно, за счет давления крови на фоне возрастающей проницаемости стенок капилляров, которые становятся проходимыми и для фибриногена, превращающегося во внесосудистом пространстве в фибрин.
Изменение проницаемости капилляров может быть обусловлено не только внутрисосудистым фактором (замедление кровотока, тромбоцитопения, гипопротеинемия, плазменные кинины, действие токсинов и др.), но и внесосудистыми факторами, среди которых существенную роль играет система тучных клеток (см.). Тучные клетки, являясь обязательным компонентом соединительной ткани, содержат высокоактивные вещества (гистамин, серотонин, гепарин, норадреналин, гиалуронидазу, протеолитические ферменты, мукополисахариды и др.). Разнообразные физ., хим., флотогенные и антигенные раздражители, гипоксия и многие другие факторы вызывают дегрануляцию тучных клеток, т. е. их разрушение. При дегрануляции клеток гранулы попадают в окружающее пространство, где их содержимое может воздействовать на стенку капилляра, изменяя ее проницаемость, а также адгезивные свойства эндотелия.
Библиография: Куприянов В. В., Караганов Я. И. и Козлов В. И. Микроциркуляторное русло, М., 1975; Мчедлишвили Г. И. Капиллярное кровообращение, Тбилиси, 1958, библиогр.; Нестеров А. И. К учению о кровеносных капиллярах и капилляроскопии как методе их изучения в нормальных и патологических условиях, Томск, 1929, библиогр.; Чернух А. М., Александров П. Н. и Алексеев О. В. Микроциркуляция, М., 1975, библиогр.; Чижевский А. Л. Структурный анализ движущейся крови, М., 1959, библиогр.; Шошенко К. А. Кровеносные капилляры, Новосибирск, 1975, библиогр.; Krоgh A. Anatomie und Physiologie der Capillaren, B. u. a., 1970, Bibliogr.
Читайте также:
- Случай перфорации роговицы у онкологического пациента после химиотерапии
- Причины ухудшения действия диуретиков. Диагностика резистентности к диуретикам
- Лучевая анатомия суставов, связок, мышц
- Лечим волосы репейным маслом и масками на ее основе
- МРТ латеральных поддерживающих структур коленного сустава в норме
