Советы по трансплантации печени
Обновлено: 27.04.2024
Трансплантация печени лицам старше пятидесяти лет. Особенности
Показания к трансплантации печени общепризнанны во всем мире и могут быть разделены на 4 больших группы:
- терминальная стадия хронических диффузных заболеваний печени (ХДЗП);
- нарушения метаболизма на фоне врожденных дефектов развития гепа-тоцита, сопровождающиеся поражением различных органов и систем, без нарушения функции печени;
- фульминантная печеночная недостаточность (ФПН);
- нерезектабельные очаговые поражения печени (билобарное поражение или наличие резектабельной опухоли на фоне цирроза печени).
Первая группа заболеваний наиболее многочисленная и представлена в большинстве случаев пациентами, страдающими циррозом печени (ЦП) различной этиологии, в том числе вирусной. Количество больных, оперируемых по поводу цирроза печени вирусной этиологии, постоянно растет, в связи с общим ростом инфицированности населения вирусами парентеральных гепатитов. При этом увеличивается количество пациентов старшей возрастной группы, которым показана трансплантация печени.
Опыт НИИ СП им. Н.В.Склифосовского по трансплантации печени у пациентов старше 50 лет позволяет уточнить некоторые закономерности хирургических вмешательств подобного типа у пожилых.
С начала 2000 по май 2008 гг. в НИИ СП им. Н.В. Склифосовского выполнено 87 ортотопических трупных трансплантаций печени (из них 2 ретрансплантации печени, а также 2 симультантных пересадки печени и почки).
22 (25%) пациента из общего числа оперированных были старше 50 лет (от 51 до 68).
Из них 13 пациентов (45,5%) оперированы по поводу цирроза печени (ЦП) вирусной этиологии, в том числе 7 человек (31,8%) по поводу ЦП HCV-этиологии. Из них 3 человека (13,6%) были с очагами гепатоцеллюлярного рака (ГЦР), 3 (13,6%) оперированы по поводу ЦП HBV-этиологии (из них 2 (9%) были и с очагами ГЦР), 3 (13,6%) — по поводу ЦП HBV + HDV-этиологии (из них 4,5% — с очагом ГЦР).
У 4 (18%) пациентов показанием для операции служил первичный билиарный цирроз, у 3 (13,6%) — криптогенный цирроз, у 1 (4,5%) — фульминантная печеночная недостаточность после расширенной резекции печени, у 1 (4,5%) — алкогольный ЦП.
Как правило, операции выполнялись в условиях общей анестезии (изофлюран/севофлюран-фентанил в режиме low-flow, релаксация осуществлялась цисатракуриумом/атракуриумом бесил атом).

Кровопотеря в интраоперационном периоде составила 2566 + 1900 мл. У 3 (13,6%) пациентов в интраоперационном периоде на этапе гепатэктомии с целью инотропной поддержки потребовалось назначение допмина (4—10 мкг/кг/мин) в сочетании с мезатоном (1—3 мкг/кг/мин). После операции больные были экстубированы в течение 4—6 часов.
У 3 (13,6%) пациентов в послеоперационном периоде на фоне гепаторенального синдрома развилась острая почечная недостаточность (ОПН). В результате заместительной почечной терапии (вено-венозная гемодиафильтрация или гемодиализ) у двух пациентов функция почек восстановилась, и они были успешно выписаны из клиники.
Пять пациентов (22%) погибли после трансплантации печени в различные сроки, из них 4 умерли в ближайшем послеоперационном периоде. Причиной смерти у 2 из них был первично нефункционирующий печеночный трансплантат, у 1 — тромбоз воротной вены, 1 пациент погиб от полиорганной недостаточности на фоне острой почечной недостаточности вследствие гепаторенального синдрома. У всех умерших исходно было крайне тяжелое состояние.
В настоящее время 17 пациентов старше 50 лет выписаны из клиники и наблюдаются амбулаторно.
Из них 9 пациентов находятся на монотерапии препаратом Сандиммун-неорал, 2 получают двухкомпонентную терапию препаратами сандиммун-неорал и селлсепт (MMF), 1 пациент — сандиммун-неорал и преднизолон. В ближайшее время после операции четверо больных получали трехкомпонентную терапию (програф, преднизолон, майфортик), один — монотерапию прографом. Вопрос о модификации терапии у этих пациентов будет решаться в более отдаленные послеоперационные сроки.
Особая роль у рассматриваемой категории пациентов принадлежит противовирусному лечению. 5 (22%) пациентов из общего числа оперированных старше 50 лет по поводу ЦП HCV-этиологии получали в дооперационном периоде противовирусную терапию (ПВТ) препаратами интерферонового ряда. Ни у одного из них добиться прекращения репликации HCV-инфекции не удалось. На момент ОТП уровень репликации HCVy всех пациентов был от 104 до 106 копий/мл.
После трансплантации печени двое из них с генотипом вируса 1 b получили курс ПВТ препаратами пегасис в дозе от 90 до 135 мкг/нед и рибавирин от 600 до 1000 мг/сут. Одна пациентка получила 20-недельный курс ПВТ. Ей пришлось прервать ПВТ в связи с развитием реакции отторжения печеночного трансплантата (пациентка погибла через 6 лет после ОТП от печеночной недостаточности на фоне сформированного цирроза печеночного трансплантата). У второго пациента был отмечен ранний вирусологический ответ на лечение, но он был неустойчив (не наблюдалось устойчивого вирусологического ответа).
Из 6 пациентов, оперированных по поводу заболевания печения HBV (или HBV+HDV-этиологии) 4 человека (1 группа) получили иммунопрофилактику инфицирования трансплантата иммуноглобулином (НВ Ig) в сочетании с аналогами нуклеозидов (ламивудин или энтекавир). У двух из 11 пациентов использовали отечественный НВ Ig (Антигеп), у 2-х больных — немецкий (Неогепатект). Трое пациентов с очагами ГЦР на фоне ЦП НВ Ig не получали. Им проводилась монотерапия препаратом Зеффикс.
У 4 больных (которые получали иммуноглобулин) отмечено быстрое исчезновение HBs-Ag, отсутствие репликации HBV и HDV в крови (наибольший срок наблюдения — 52 месяца после ОТП). У всех троих больных второй группы HBs-Ag не элиминировался после операции, у первой группы продолжалась репликация ДНК вируса гепатита В в крови.
После трансплантации печени по поводу ПБЦ ни в одном случае нами не отмечено рецидива заболевания. Все пациенты чувствуют себя хорошо. Пациенты, перенесшие трансплантацию печени по поводу алкогольного ЦП, продолжают воздерживаться от приема алкоголя, вернулись к прежней работе. У всех пациентов отмечена полная социальная и медицинская реабилитация.
В то же время следует отметить, что результаты трансплантации печени у пациентов старше 50 лет несколько хуже, чем у более молодых пациентов. Несомненно, на результаты влияет тот факт, что в 45,5% трансплантация печени выполнялась по поводу ЦП вирусной этиологии. Связано это с наличием внепеченочных резервуаров инфекции в организме реципиентов и, как следствие, инфицированием печеночного трансплантата в послеоперационном периоде с быстрым прогрессированием морфологических изменений трансплантата на фоне медикаментозной иммуносупрессии, печеночной недостаточности. Это может привести к потере печеночного трансплантата и гибели пациента.
Несмотря на это, трансплантация печени — единственный радикальный метод лечения подобных пациентов. Ежегодно среди всех трансплантаций печени в мире примерно 25% составляют больные с ЦП HCV-этиологии и около 6% — больные с ЦП HBV-этиологии.
Вирус гепатита С менее агрессивен по отношению к печеночному трансплантату, чем вирус гепатита В. В случае успеха трансплантации печени позволяет добиться полной медицинской и социальной реабилитации даже у пациентов старше 50 лет. Улучшения результатов трансплантации печени можно добиться более ранней постановкой пациентов с циррозами печени в Лист ожидания, а также активизации путем работы по органному донорству и своевременному выполнению трансплантации печени и ретрансплантации печени.
Видео техники комбинированной пересадки печени с шунтом верхней брыжеечной вены
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трансплантация печени при злокачественных опухолях: от Старзла до наших дней
Текст, сбор материала – Тамара Амелина,
Концепция и редактирование текста – заведующий хирургическим отделением №2 (Трансплантация печени) ФГБУ «НМИЦ ТИО им. В.И. Шумакова», трансплантолог Артем Монахов
Материал создан на средства гранта имени Андрея Павленко
Трансплантация печени изначально была разработана американским хирургом, ученым Томасом Старзлом (Thomas Earl Starzl). Он занимался лечением первичных и вторичных опухолей̆ гепатобилиарной системы. Томас Старзл – автор популярной книги «Puzzle people: memoirs of a transplant surgeon» (прим. перевод с англ. «Люди-паззлы, воспоминания хирурга-трансплантолога»). The Wall Street Journal признала ее одной из лучших книг, описывающих жизнь врача.
Старзла по праву называют «отцом трансплантологии»: в 1967 году он впервые в истории медицины успешно выполнил пересадку печени человеку – трансплантация была сделана полуторагодовалой девочке с неоперабельной формой гепатоцеллюлярного рака.
Этому несомненному успеху предшествовало множество неудач: так было и 1 марта 1963 года, когда Старзл сделал первую попытку пересадки печени человеку. Реципиентом был трехлетний Бенни Солис, родившийся со смертельным для того времени диагнозом – атрезией желчевыводящих путей.
На тот момент Старзл провел 200 пересадок печени собакам, ему удалось добиться нормальных показателей краткосрочной выживаемости. Он также провел четыре пересадки почек между разнояйцевыми близнецами, и все реципиенты к 1963 году прожили минимум четыре месяца.
Старзл писал: «Главная сложность заключалась в самой операции, которая была значительно труднее трансплантации почки. Никакая подготовка не могла помочь в выполнении этой тяжелейшей задачи. Нам потребовалось несколько часов, только чтобы сделать надрез и войти в брюшную полость. Каждый участок ткани содержал маленькие вены под большим давлением, что было связано со сдавлением воротной вены большой печенью. Печень Бенни была покрыта рубцовой тканью, образовавшейся после операций, проведенных ребенку вскоре после его рождения. Кишечник и желудок спаялись с печенью, образуя массивный кровянистый конгломерат. Хуже всего было то, что кровь Бенни не сворачивалась. Факторы, необходимые для этого процесса, практически не определялись. Он истекал кровью, пока мы отчаянно пытались остановить кровотечение. Мы не смогли завершить операцию. Бенни было всего три года, но в его жизни не случилось ни одного счастливого дня. Его зашили и завернули в белую простыню, после того как рыдающая медсестра омыла тело. Из места, наполненного стерильной надеждой, его унесли в холодный и негигиеничный морг. Вскрытие не помогло нам понять, что мы сделали не так. Хирурги долгое время оставались в операционной: все сидели на низких стульях вдоль стен и молчали. Пришли санитарки и стали мыть пол. Нам нужно было готовиться к следующей операции».
Рак печени (гепатоцеллюлярная карцинома, гепатоцеллюлярный рак, печеночно-клеточный рак) – это злокачественная опухоль, развивающаяся из клеток печени (гепатоцитов) в результате их трансформации.
Рак печени занимает шестое место по распространенности среди всех злокачественных заболеваний, третье место по причине смерти от рака и первое место по причине смерти пациентов с циррозом печени.
Данная опухоль протекает агрессивно, без лечения прогноз заболевания крайне неблагоприятен, медиана выживаемости составляет порядка 9 месяцев. Наиболее часто гепатоцеллюлярный рак развивается в уже пораженной хроническим заболеванием печени и составляет более 90% злокачественных опухолей при циррозе.
3 июля 1967 года Старзл пересадил печень Джулии Родригез. Этой девятнадцатимесячной пациентке трансплантацию сделали в связи с гепатоцеллюлярным раком, резвившимся на фоне той же билиарной атрезии. Операция прошла успешно, и Старзл думал, что излечил девочку, но три месяца спустя рентген грудной клетки показал метастазы. Через 3,5 и 7 месяцев после трансплантации Старзл удалял Джулии опухоли, но они продолжали появляться. Девочка прожила 400 дней после пересадки печени. И хотя ожидался более долгий срок жизни пациентки, это все равно был успех, и постепенно трансплантация заняла свое место в лечении многих доброкачественных и злокачественных заболеваний печени.
Старзл написал: «Смерть пациентов в результате ранних и более поздних трансплантаций не означает, что пересадка печени убивает. Этим пациентам и так был подписан смертный приговор из-за заболеваний, которые привели их к нам. Даже сегодня я продолжаю получать письма от родителей и других членов семьи. Они всегда начинаются со слов, что я, конечно, не вспомню Джимми или кого-то другого. Они выражают благодарность за предпринятую попытку спасти их ребенка, вместо того чтобы просто позволить ему умереть без какой-либо надежды. Мои оппоненты всегда утверждали, что мы лишаем малышей возможности умереть с достоинством. Родители же этих детей считают, что им подарили шанс на борьбу. Ошибались они только в одном: в том, что я не помню своих пациентов».
Иммуносупрессия
Следующей важной вехой в трансплантологии была публикация в 1981 году в «New England Journal of Medicine» (прим. перевод с англ. «Медицинский журнал Новой Англии») статьи Старзла с результатами годичного использования иммунодепрессанта циклоспорин при трансплантации печени. Далее в 1983 году циклоспорин был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, и пересадка печени перестала считаться экспериментальной терапией, страховые компании начали покрывать затраты на эту операцию.
Позднее Старзл также стал применять новый иммунодепрессант такролимус, который стал применяться чаще, чем циклоспорин, и который до сих пор используется при трансплантации органов.
В конце 80-х в Питтсбурге под руководством Старзла разрабатывались и применялись мультивисцеральные или “кластерные” трансплантации для лечения злокачественных новообразований брюшной полости. Он предлагал пересаживать совместно печень, желудок, поджелудочную железу при тяжелых распространенных раках. Но результаты были неутешительные, потому что когда опухоль прорастает в несколько органов и имеет большой размер, иммуносупрессия, необходимая после любой пересадки, создает благодатную почву для немедленного рецидива опухоли. К тому же, в то время еще не была развита химиотерапия и отсутствовало глубокое понимания механизмов генерализации онкологического прогресса.
 |
В мире тогда было очень мало трансплантационных центров, нагрузка в больнице Старзла была огромной – за год он сделал до 500 пересадок печени. Хирурги со всего мира приезжали в Питтсбург, чтобы иметь возможность обучаться у ведущего трансплантолога мира.
Критерии отбора пациентов на трансплантацию
Дальнейшее развитие трансплантации печени в связи с опухолями было неровным. Изначальная концепция Томаса Старзла столкнулась с серьезной проблемой – неприемлемо высокой частотой рецидивов опухоли и, соответственно, неудовлетворительной выживаемостью больных. Объяснить эти неудачи можно слишком запущенными стадиями опухоли, отсутствием критериев отбора пациентов на трансплантацию, несовершенством диагностики и иммуносупрессивной терапии.
Вследствие этого на протяжении трех десятилетий трансплантация печени развивалась как стандартное лечение таких тяжелых заболеваний как цирроз, острая печеночная недостаточность и др.
Тем не менее, цирроз нередко сопровождается развитием в печени гепатоцеллюлярного рака, поэтому в середине 1990-х среди трансплантологов вновь возник интерес к ее применению в качестве возможного метода лечения ГЦР (гепатоцеллюлярный рак) с внедрением критериев отбора пациентов.
Первыми и наиболее востребованными стали Миланские критерии, разработанные Винченцо Маззаферро (V. Mazzaferro и соавт.) – их суть в том, что хороших результатов, вплоть до излечения, можно достичь, если оперировать только тех больных, у которых не более трех опухолей диаметром не более 3 см или одна опухоль диаметром не более 5 см. В таких случаях пятилетняя выживаемость достигает 70-85% с частотой рецидива менее 15%.
В 1996 г. Mazzaferro и соавт. опубликовали в New England Journal of Medicine ретроспективное исследование 48 больных, которым была трансплантирована печень по поводу ГЦР. При соблюдении Миланских критериев удавалось достичь четырехлетней безрецидивной выживаемости 92%. Эти результаты сравнимы с трансплантацией печени пациентам без онкологических заболеваний.
Конечно, Миланские критерии сильно ограничивали число кандидатов на трансплантацию печени, так как по статистике гепатоцеллюлярный рак диагностируется обычно на более поздних стадиях.
В широкую клиническую практику также вошла Барселонская классификация, BCLC (Barcelona Clinic Liver Cancer), алгоритмы на основе которой были приняты как стандарт в большинстве западных гепатологических центров. Классификация ориентирована на Миланские критерии, но кроме объема опухолевого поражения данная учитывает физиологический статус и тяжесть цирроза.
Однако и эта классификация подвергается определенной критике, поскольку критерии для трансплантации также достаточно строгие.
Балльные критерии отбора пациентов на трансплантацию печени
Многие трансплантологи работали в направлении осторожного расширения этих строгих критериев отбора, но некоторые трансплантологи, особенно в странах Азии, где рак печени встречается достаточно часто, придерживалась более либерального подхода в отношении отбора пациентов. Гонконгская группа предложила новую схему лечения, в которой оперативное вмешательство проводится почти на всех стадиях заболевания.
Началось стремительное развитие различных подходов к критериям отбора пациентов на трансплантацию печени, и к настоящему времени в литературе их описано не менее 40.
В 2001 г. группа ученых Калифорнийского университета в Сан-Франциско (UCSF) первой расширила строгие Миланские критерии, увеличив допустимый размер опухоли на 1,5 см (один узел не более 6,5 см или 2-3 узла не более 4,5 см и суммарный диаметр узлов не более 8 см). Применение критериев UCSF значительно увеличило число кандидатов для трансплантации печени среди пациентов с ГЦР при сопоставимой с Миланскими критериями ранней и отдаленной выживаемостью. Но дальнейшее расширение показаний к трансплантации печени при ГЦР не приводило к улучшению показателей выживаемости.
Выбор оптимальных критериев отбора пациентов на трансплантацию оказался чрезвычайно сложным. С одной стороны, показатели пятилетней выживаемости являются наиболее убедительным аргументом в пользу выбора Миланской или Барселонской модели в условиях постоянного дефицита донорских органов. С другой – использование расширенных критериев оценки опухолевого поражения представляет реальный шанс если не на выздоровление, то на существенное увеличение продолжительности и улучшение качества жизни пациентов.
Междисциплинарный подход
Врачи ФГБУ “Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского” в статье « Современные принципы лечения гепатоцеллюлярного рака» подчеркнули: «Успешное лечение ГЦР требует междисциплинарного подхода, включающего участие гастроэнтерологов-гепатологов, онкологов, хирургов, специалистов по рентгенэндоваскулярным технологиям и трансплантологов. […]
В большинстве наблюдений ГЦР (гепатоцеллюлярный рак) развивается на фоне ЦП (цирроз печени), и такие пациенты часто нуждаются в ТП (трансплантация печени). Ее проведение не всегда возможно и зависит от баланса между предполагаемой пользой (продолжительностью жизни) и риском хирургических осложнений, связанных с операцией, увеличением сердечно-сосудистого и общего онкологического риска на фоне проводимой иммуносупрессивной терапии. […]
Мир активно ищет новые параметры для оценки рисков ТП при ГЦР. Ученые из Университета Торонто (Канада) в 2016 г. опубликовали исследование, в котором к критериям отбора пациентов для ТП в том числе были отнесены расположение опухолевых узлов, отсутствие признаков истощения на фоне онкологического процесса и высокая или умеренная степень дифференцировки опухоли».
Хотя согласно Европейским рекомендациям (2018 г) трансплантация печени подходит лишь для пациентов с ранней стадией заболевания.
На основании комплексного анализа авторами Миланской группы в 2009 г. предложена так называемая концепция Metro-ticket, включающая семь критериев. Новая концепция зарекомендовала себя с положительной стороны, обеспечивая пятилетнюю выживаемость 71%. Дальнейшие исследования в этом направлении привели к появлению критериев Metro-ticket 2.0, позволяющих определять пятилетнюю выживаемость после трансплантации печени более точно.
 |
Опыт ФГБУ «НМИЦ ТИО им. В.И. Шумакова» обнадеживает: с января 2010 по февраль 2020 трансплантация печени с ГЦР выполнена 63 пациентам, из них по Миланским критериям 33 пациентам, по UCSF – 5 пациентам, вне UCSF – 25 пациентам. Пятилетняя выживаемость составила 93,2% (по Миланским критериям), 66,7% (по UCSF) и 54,7% (вне UCSF).
 |
| A - общая выживаемость Б - безрецидивная выживаемость |
В статье «Результаты трансплантации печени при гепатоцеллюлярном раке: опыт одного центра», опубликованной в журнале «АННАЛЫ ХИРУРГИЧЕСКОЙ ГЕПАТОЛОГИИ» (2020, том 25, No2), авторы, врачи ФГБУ «НМИЦ ТИО им. В.И. Шумакова», сделали вывод: «Трансплантация печени при печеночно-клеточном раке пациентам, соответствующим МК (Миланские критерии), а также критериям UCSF (Калифорнийские критерии), является эффективным методом с низким уровнем рецидива опухоли. Ряду пациентов может быть выполнена трансплантация печени за пределами Миланских и Калифорнийских критериев. Важную роль в успехе лечения играют морфологические и биологические характеристики опухоли и дифференцированный мультидисциплинарный подход».
Академик РАН, профессор С.В. Готье «Роль трансплантации в лечении злокачественных новообразований печени». Доклад на XI съезде онкологов и радиологов стран СНГ и Евразии, Казань 2020.
Пересадка печени ребенку: о листе ожидания, донорах и операции

Какая из стран лидирует по количеству трансплантаций, при каких заболеваниях детям показана пересадка печени, долго ли ждать донорский орган, как ребенок переносит наркоз и от чего вынужден отказаться после операции – на эти и другие вопросы читайте ответы в данной статье.
О трансплантологии в России и других странах
– Какая из стран лидирует по количеству трансплантаций печени, в том числе и детям?
– Лидеры среди трансплантационных стран – США, Испания, Япония, Индия и Корея.
– Почему именно эти страны?
– Потому что у них очень сильно развита программа органного донорства, в том числе и детского. В этих странах меньше дефицита органов от посмертных доноров.
К сожалению, в нашей стране много органов от посмертных доноров просто не используется ввиду ментальных и религиозных причин
Также в некоторых из этих стран прижизненную донацию может осуществлять любой человек в альтруистических целях, а не только кровный родственник. Кроме того, в этих странах существует большое количество медицинских центров, которые могут оказывать такой вид помощи. В России все эти программы активно развиваются, но еще требуется время, пока мы сможем выйти на уровень, который показывают США и Корея.
– В Интернете есть информация, во сколько обойдется трансплантация печени в разных странах. Цены указаны в долларах: в Америке – примерно 500 тыс., в Германии – 200-400 тыс., в Израиле – 250–270 тыс., в Южной Корее – 200–250 тыс., в Индии – от 36 тыс. долларов. В России для своих граждан – это платная операция?
– Любая трансплантация печени для граждан Российской Федерации осуществляется бесплатно.
– Какова ее стоимость для зарубежных граждан?
– Иностранным гражданам, по законам Российской Федерации, можно выполнить только трансплантацию фрагмента печени от родственного донора. Ее стоимость составляет примерно 80-100 тысяч долларов, включая все обследования.
– В России много клиник, где делают такие операции?
– Их делают в ФГБУ НМИЦ ТИО им. академика В. И. Шумакова.
– Какое место в мировом рейтинге занимает Россия по развитию трансплантологии?
– Наша трансплантология пока не достигла тех количественных показателей, которые за очень короткий срок достигли страны бывшего соцблока, например, Польша и Чехия. Поэтому России еще далеко до лидирующих позиций. Сейчас проводится большая работа по расширению пула органов и развития трансплантологии не только в центральных регионах, но и на периферии нашей страны. Но это еще большой путь, и я верю, что наши показатели сравняются с общемировыми.

Константин Сёмаш: «В России ежегодно появляется около ста детей, которым нужно делать трансплантацию печени».
– По поводу экспорта медуслуг: из каких стран приезжают в Россию для подобных операций?
– Чаще всего из ближнего зарубежья – стран СНГ.
О диагностике
– С какого возраста могут диагностировать заболевания, при которых необходима пересадка печени ребенку?
– Заболевание может развиться в любом возрасте, но чаще всего такие заболевания диагностируют с рождения. Можно заподозрить наличие билиарной атрезии у детей с первых дней жизни. Некоторые врожденные заболевания (например, генетические) требуют дополнительной дифференциальной диагностики. Чаще всего врачи роддомов могут спутать желтуху в исходе пороков развития желчевыводящих путей с желтухой новорожденных, и выписать больного пациента домой, не направив его на дополнительное обследование.
В тему. Трансплантолог Мохаммед Рела (Индия) внесен в Книгу рекордов Гиннеса за проведение успешной трансплантации 5-дневному младенцу. Всего он сделал более 3 тысяч пересадок печени. Этот показатель является рекордным по всему миру.
– Много ли существует заболеваний у детей, которые невозможно вылечить и есть только один способ сохранить жизнь – трансплантация печени?
– Чаще всего показанием к трансплантации печени у детей являются врожденные пороки развития: билиарная атрезия, поликистоз печени, либо генетические заболевания, такие как болезнь Байлера, болезнь Алажиля, синдром Криглера-Найяра, заболевания, связанные с нарушенным обменом ферментов в печени (метаболическая патология).
К примеру, при билиарной атрезии и при некоторых генетических заболеваниях нарушается желчеотток от печени и развивается цирроз, при котором тяжесть состояния ребенка прогрессирует с каждым днем все больше, и без должного лечения ребенок может не дожить и до полугода. Некоторые заболевания, такие как тирозинемия, могут очень быстро прогрессировать в рак печени, и нужно успеть сделать трансплантацию, пока у ребенка не развилась злокачественная опухоль. Аутоиммунный гепатит, когда организм вырабатывает антитела против своей же печени, то есть сам разрушает ее.
Практически все эти заболевания приводят к циррозу печени и к жизнеугрожающим состояниям, когда единственный шанс спасти ребенка — это сделать трансплантацию.
– Эти серьезные заболевания, с которыми рождается ребенок, можно выявить еще на стадии беременности?
– К сожалению, большинство врожденных заболеваний печени, за исключением некоторых генетических, невозможно диагностировать на стадии беременности.
О листе ожидания и донорах
– Обычно врачи рекомендуют при показаниях к пересадке печени искать родственного донора. Это значит, донором может стать кто-то из близких родственников больного ребенка? Есть какие-то жесткие требования к донору?
– Это правда. Сделать трансплантацию печени маленькому ребенку в нашей стране сейчас возможно двумя способами: от родственного донора, либо от посмертного донора.
Трансплантаций печени от посмертного донора маленьким детям в год делается около 10 операций. Это очень мало, так как нужно подобрать идеального донора для ребенка, чтобы можно было взять у него маленький кусочек печени (сплит трансплантация, когда печень делится на 2 фрагмента и эти фрагменты разделяют между двумя пациентами).
Второй способ – это если есть родственный донор. В нашей стране прижизненно стать донором может только кровный родственник реципиента. Таких трансплантаций в нашем центре делается около 100 в год.После наших операций доноры ведут прежний образ жизни, качество жизни после донации никак не меняется
После наших операций доноры ведут прежний образ жизни, качество жизни после донации никак не меняется
Донору проводится комплексное обследование, так как не каждый человек может быть донором части печени по причине неподходящей анатомии (большие размеры предполагаемого трансплантата, анатомические особенности строения и кровоснабжения печени и т.д.), либо по причине плохого здоровья. Донором может быть только здоровый человек, мы не можем подвергать жизнь и здоровье доноров опасности.
– Что будет с донором печени после пересадки? У него могут развиться серьезные осложнения?
– После операции донор проходит плановую реабилитацию. Печень после резекции регенерирует в течение нескольких недель. Смертельных исходов при родственной донации в России не было. Выписка после операции, при отсутствии осложнений, происходит на 5-7 послеоперационные сутки. Осложнения при родственной донации печени крайне редкие.
– Список ожидания донорского органа большой? Сколько нужно ждать – месяц, год, несколько лет?
– Если у больного ребенка есть обследованный родственный донор, то для этого пациента лист ожидания просто не актуален. Родственное донорство прекрасно тем, что можно сделать трансплантацию тогда, когда это нужно, и не ждать органа от посмертного донора.
Дети, у которых нет донора, попадают в лист ожидания органа от посмертного донора. Дети в этом листе всегда находятся в приоритете, и при появлении первого подходящего для них донора, будут прооперированы.
– Читала, что в России ежегодно около ста маленьких детей находятся на грани жизни и смерти из-за страшного диагноза, который предполагает пересадку печени. Сколько российских детей сейчас в списке ожидания?
– Действительно, в России ежегодно появляется около ста детей, которым нужно делать трансплантацию печени. Но списка ожидания нет. Дети, у которых выявляются показания к трансплантации печени, направляются к нам в центр на обследование. Также мы рекомендуем сразу обследовать потенциальных родственных доноров, чтобы мы могли провести трансплантацию печени в плановом порядке. При первой же возможности ребенок госпитализируется, дообследуется и ставится в операционный план. Только в случае отсутствия потенциальных родственных доноров, ребенок попадает в лист ожидания органа от посмертного донора. Повторюсь, в этом этом листе приоритет всегда остается за ребенком.
– Что нужно для того, чтобы попасть в лист ожидания? Всех ли в него заносят?
– Нужно быть гражданином Российской Федерации и иметь показания к трансплантации печени.
– Есть ли в России единый регистр доноров и реципиентов?
– К сожалению, такого регистра в нашей стране нет, однако сейчас ведется активная работа по его разработке.
Об операции
– В России много клиник, которые способны выполнить операцию по пересадке печени ребенку?
– Лидером в отношении родственной трансплантации печени является наш центр — Национальный медицинский исследовательский центр имени академика В. И Шумакова. Эти операции у нас поставлены на поток. Разработал программу родственной трансплантации в России Сергей Владимирович Готье, именно он руководит этой программой. В нашем центре делается больше всего таких трансплантаций. Есть еще пара центров в Москве, но, как правило, это несколько родственных трансплантаций печени в год.

– Сколько длится операция? В новостях была информация о том, что в начале этого года вы принимали участие в операции по пересадке печени в Узбекистане. Всего в ней участвовали 21 врач и 10 медработников среднего звена. Операция длилась 15 часов. Это был сложный случай или так всегда проходят подобные операции – с таким количеством медиков и столько по времени?
– Стоит отметить, что операции на самом деле не одна, а две. Они проходят в соседних операционных. В одной операционной оперируется донор, где производится «забор» фрагмента печени для дальнейшей пересадки. Особенность и сложность операции у донора в том, что фрагмент печени удаляется на работающем кровотоке, так как этот участок органа дожен быть все время «живым» и кровоснабжаемым. После эксплантации производится консервация трансплантата – он заполняется специальным консервирующим раствором температуры 1 градус Цельсия.
Если брать конкретный пример из Узбекистана, операция была не только жизнеспасающей, но и носила обучающий характер для наших коллег и дала старт программе трансплантации печени в Республике Узбекистан, ведь до этого трансплантация печени в Узбекистане не проводилась.
– Как ребенок переносит наркоз?
– При проведении трансплантации печени ребенку нужна очень квалифицированная анестезиологическая бригада: в таком случае ребенок будет переносить наркоз хорошо. Самые тяжелые периоды во время операции – это безпеченочная фаза (когда больная печень уже удалена), а также реперфузия (пуск кровотока по сосудам трансплантата).
В тему. Англичанину Стивену Фитли сейчас 23 года. В возрасте 6 недель ему поставили страшный диагноз «атрезия желчевыводящих путей». Первую пересадку печени Стивен перенес, когда ему был 1 год и 2 месяца. В последующем ему делали еще 14 операций, включая удаление селезенки. Всего парень пережил шесть трансплантаций печени.
– На одном форуме прочла: «Знакомые пытались убедить меня, что пересадка печени – это плохой вариант: и родственников сделаешь калеками, и трансплантаты долго не живут». Как вы можете прокомментировать это?
– С такими страшными диагнозами несчастные дети обречены на смерть. Мы можем дать им шанс на полноценную жизнь. Что касается доноров, то после наших операций они возвращаются к своей обычной жизни уже через месяц. Поэтому родители, которые доверяют врачам, доноры, которые жертвуют частичку себя, доктора и остальные работники медицины, которые работают на благо здоровья детей – все мы делаем большое общее дело, направленное на спасение жизни ребенка. Разговоры о неэффективности трансплантации, как правило, ничем не подкреплены.
О том, что ждет после операции
– Сколько может прожить человек после того, как ему пересадили печень?
– Это сложный вопрос, поскольку выживаемость после трансплантации печени зависит от очень большого количества факторов: совместимость донора и реципиента, исходная тяжесть состояния пациента, его возраст и антропометрические данные, были ли у пациента предшествующие операции на брюшной полости, имеются ли сопутствующие заболевания и прочие отягощающие факторы. Немаловажный фактор – это комплаентность пациента (то, как он выполняет назначения врача после трансплантации).
С учетом комплексной статистики, результаты трансплантации хорошие: большинство маленьких пациентов вырастают, ходят в школу, работают, занимаются спортом
Что уж говорить, если пациент, которому была сделана первая родственная трансплантация печени в России в 1999 году, ведет полноценный и активный образ жизни – на момент пересадки ему было 3 года.
– Сколько времени должно пройти, чтобы врач сказал пациенту, что орган прижился и уже все в порядке?
– При хороших раскладах, пациент может быть выписан уже через неделю после трансплантации (это касается взрослых реципиентов). Дети, особенно младенцы, наблюдаются в стационаре после трансплантации, в среднем, 14-30 дней.

Фото: Arnapress.kz
– От чего вынужден отказаться ребенок, которому пересадили печень? Есть ли какие-то пожизненные противопоказания?
– В глобальном смысле противопоказаний нет. После трансплантации и реабилитации ребенок может вести обычный образ жизни, как и другие дети. Единственное различие в том, что этот ребенок будет принимать иммуносупрессивные препараты, которые подавляют иммунитет для того, чтобы пересаженный орган не отторгался. Следовательно, нужен более тщательный контроль за гигиеной и окружением ребенка.
– Обследование после пересадки по полису ОМС – бесплатное?
– Да. Все обследования и медицинское обеспечение пациентов после трансплантации – бесплатно.
– Ученые пытаются создать искусственную печень из стволовых клеток. Пока простой обыватель воспринимает это как фантастику. Вы верите, что такое возможно?
– Да, такие эксперименты проводятся во всем мире, в том числе и у нас в стране, и в нашем научном центре. Думаю, за высокими технологиями будущее, ведь искусственное сердце уже разработано, существуют приборы, которые могут заменять функцию почек, легких и печени. Как видим, наука и технологии стремительно развиваются. Возможно, удастся воссоздать и печень из стволовых клеток.
Автор: Наталья Пригодич, оригинальное интервью опубликовано на сайте Yellmed.
Трансплантация печени
Трансплантация печени – это органозамещающий/ органосовмещающий метод оперативного лечения терминальных стадий заболеваний печени.
D13.4 Доброкачественные и злокачественные опухоли печени: (гемангиоматоз; аденоматоз; гамартоматоз; поликистоз печени; прочие доброкачественные и злокачественные опухоли печени)
Т86 Ретрансплантация (хроническое отторжение, первично нефункционирующий трансплантат, хроническая дисфункция трансплантата в результате рецидива диффузных заболеваний, некурабельные билиарные стриктуры, цирроз печени развившийся в трансплантате)
Пользователи протокола: анестезиологи-реаниматологи, хирурги, трансплантологи, инфекционисты, терапевты, врачи общей практики.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
• трансплантация части печени (редуцированная печень или часть разделенной печени - сплит-трансплантация), полученной от посмертного донора;
• ортотопическая трансплантация печени – пересадка донорской печени на место удалённой печени реципиента;
• гетеротопическая трансплантация добавочной печени – в этом случае донорская ткань печени пересаживается реципиенту и при этом сохраняется его собственная печень.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• развернутый биохимический анализ крови (общий белок и белковые фракции, электролиты, трансаминазы, билирубин и его фракции, амилазу, креатинин, мочевина, аммиак, лактат, С – реактивный белок);
• бактериологическое обследование (посевы отделяемого из зева, носа и влагалища, а также мочи, кала, мокроты);
Лечение
• терминальные стадии заболевания печени, при которых ожидаемая продолжительность жизни составляет менее 1 года (классы В и С по Child-Turcotte-Pugh);
• цирроз печени, сопровождающийся гепаторенальным синдромом, устойчивым асцитом, нарастающей печеночной недостаточностью;
• очаговое заболевание печени, при котором технически невозможна резекция (из-за большого очага или при множественных очагах);
• онкологические заболевания, за исключением гепатоцеллюлярной карциномы в пределах Миланских или UCSF критериев;
• полное отсутствие психологической готовности пациента к пересадке печени.
Меры безопасности и противоэпидемический режим согласно Санитарным правилам «Санитарно-эпидемиологические требования к объектам здравоохранения», утвержденным постановлением Правительства Республики Казахстан от 17 января 2012 года № 87.
Требования к оснащению: согласно приказа и.о. Министра здравоохранения Республики Казахстан от 3 ноября 2011 года № 763 «Об утверждении Положения о деятельности медицинских организаций, оказывающих нейрохирургическую помощь»; приказа МЗ РК № 199 от 29 марта 2013 года «О мерах по развитию службы трансплантации органов и тканей в Республике Казахстан»
• электрохирургический коагулятор с наличием режимов резания (рассечения), коагуляции, биполяра и лигирования сосудов;
• передвижной операционный стол для подготовки печеночного графта.
• провести перед операцией все гигиенические процедуры: прополоскать полость рта, почистить зубы, снять съемные зубные протезы, очистить полость носа, мужчинам побриться;
• выбор антибиотика проводится в соответственности с чувствительностью выделенной у пациента патологической флоры
• антибиотик вводится внутривенно за 30-60 минут до начала операции.
• базиликсимаб 20 мг, в/в, перед реперфузией.
• мониторинг состояния пациента (ЭКГ 5 отведений), IBP, CVP, измерение центральной гемодинамики (PAР, WP, СО, CI, PVR), пульсоксиметрия, температура пациента, капнография);
миорелаксанты (панкурония бромид 0,04-0,1 мг/кг в/в, рокурония бромид 0,1 мг/кг в/в, атракурия безилат 0,1 мг/кг в/в);
наркотические анальгетики (фентанил 10-25 мкг/кг в\в каждые 20-30 минут), ингаляционный анестетик (севофлуран), низкопоточная анестезия до 2 л/мин, пропофол 4-12 мг/кг/ч в\в, миорелаксация – рокурония бромид 0,5 мг/кг в\в каждые 60-90 мин.
панкурония 0,02-0,1 мг/кг в/в каждые 60-90 мин пипекурония бромидом 70—80 мкг/кг в/в каждые 60-90 мин.
• режим ИВЛ: нормовентиляция, дыхательный объем – 6-8 мл/кг идеальной массы тела, ПДКВ – 5-7 см.вод.ст , FiO2 – 50-60%, капнография – нормокапния;
• нейтрализация гепарина протамин-сульфатом под контролем активированного времени свёртывания (после завершения хирургического гемостаза)
• ингибиторы фибринолиза – апротинин, в ампулах, для в/в введения, максимальная суточная доза 500 - 2 млн./Ед
• гемотрансфузионная терапия (в соответствии с приказом «О внесении изменений в приказ и.о. Министра здравоохранения Республики Казахстан от 6 ноября 2009 года № 666 «Об утверждении Номенклатуры, Правил заготовки, переработки, хранения, реализации крови и ее компонентов, а также Правил хранения, переливания крови, ее компонентов и препаратов» Приказ Министра здравоохранения Республики Казахстан от 26 июля 2012 года № 501):
свежая эритроцитарная масса.
Расчет необходимой дозы для лечения является в основном эмпирическим из расчета, что 1МЕ фактора II или фактора Х на 1 кг массы тела, соответственно, увеличивает активность плазменного фактора II или Х на 0,02 и 0,017 МЕ/мл.
затем препарат вводится с 2-3-часовыми интервалами на протяжении первых 24-48 ч в зависимости от проводимого вмешательства и клинического состояния пациента.
Соматостатин при портальной гипертензии по 250 мг внутривенно болюсно, далее 250 мг внутривенно капельно в течение часа (инфузии можно продолжать до 5 дней).
• ингибиторы фосфодиэстеразы V (силденафил) 25-300 мг/сут.
Консервация и подготовка для трансплантации печеночного графта: донорской печени (от кадавра) или фрагмента печени (от прижизненного донора) выполняется в условиях операционной, на отдельном операционном столе (Back table).
Донорская печень или фрагмент печени помещается в специальный лоток, наполненный ледяной крошкой, после чего графт взвешивается, производятся измерения диаметров сосудистых и билиарных структур.
Последовательно канюлируются кровеносная (воротная) вена, затем инкреторная (печеночная) вена, производится промывание/перфузия печеночного графта до «чистых вод» через артерию и вену физиологическим раствором с гепарином 1000 ед, а затем консервирующим раствором (например, Кустодиол) 1000-3000 мл.
После перфузии, производится препаровка кровеносных и инкреторных сосудов, а также, желчного протока, для формирования анастомозов. По мере готовности бригады, выполняющей основной этап операции, лоток с печеночным графтом транспортируется к операционному столу, для проведения трансплантации.
Трансплантация печени реципиенту:
До начала операции, производится подготовка к работе аппарата для реинфузии крови и аппарата общего вено-венозного шунтирования (при планировании их использования), а также, подготовка энергетического коагуляционно-ультразвукового комплекса, операционного микроскопа.
Положение пациента: лежа на спине.
Обезболивание: Эндотрахеальный наркоз.
Обязательно проводятся катетеризации центральных вен (до 4), катетеризация лучевой артерии, установка катетера Сван-Ганца, датчика пульс-оксиметрии и инвазивного давления.
Обработка операционного поля у реципиента: не менее трех раз, с применением антисептических растворов.
Операционный доступ:
• доступ Старлза (лапаротомия трехлучевой формы по типу символа «Мерседес») (Рисунок 1).
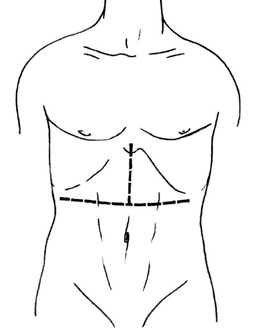
Рис. 1 Доступ Старлза
Производится ревизия органов брюшной полости, оценка состояния печени, селезенки, степени выраженности венозных коллатералей, эвакуация асцитической жидкости, с определением её количества.
В случае выраженной спленомегалии с синдромом гиперспленизма, может быть произведена спленэктомия.
Поэтапно мобилизируются левая и правая доли печени, с освобождением задней поверхности печени от нижней полой вены, путем тщательного лигирования и пересечения ветвей мелкого порядка.
Выделяется надпеченочный отдел нижней полой вены, дифференцируются печеночные вены. Дифференцируются элементы гепатодуоденальной связки, с прослеживанием печеночной артериальной ножки, общего портального сосуда, гепатикохоледоха. Выделяется подпеченочный отдел нижней полой вены.
Производится подключение аппарата общего вено-венозного шунтирования (допускается также выполнение операции без аппарата вено-венозного шунтирования).
Последовательно пережимаются кровеносные и инкреторные сосуды: печеночная артерия, сосуд портальной системы, желчный проток и сосуды, впадающие в нижнюю полую вену (ветви печеночной вены). Пересекаются желчные протоки; те их ветви, которые не планируется вовлекать в анастомоз, ушиваются ручным способом. На сосудистых зажимах, отсекаются сосудистые структуры (печеночной артерии, воротной вены, печеночной вены), с которыми планируется производить анастомозы. Ветви сосудов, не планируемые к вовлечению в анастомоз, прошиваются ручным или аппаратным способом.
Формируется анастомоз между соответствующими стволами печеночной вены реципиента и печеночной вены графта непрерывным швом нитью «пролен 4,0» или «пролен 5,0» одним из двух способов:
• широкий кава-кавальный анастомоз «бок в бок» (анастомоз по типу «Piggy back») (при имплантации целой донорской печени).
Формируется анастомоз между веной портальной системы реципиента и ветвью воротной вены печеночного графта, «конец в конец», также однорядным швом, нитью «пролен 4,0» или «пролен 5,0».
Производится контрольная ультразвуковая допплерография, оценивается внутрипеченочный венозный кровоток.
С использованием операционного микроскопа, производится формирование анастомоза артериальных структур реципиента и графта, «конец в конец», узловыми швами «пролен 7,0 – 8,0».
Производится контрольная ультразвуковая допплерография, оценивается внутрипеченочный артериальный кровоток.
• билио-билиоанастомоза «конец в конец» (при наличии у печеночного графта одного желчного протока размером не менее 5 мм);
• билиодегистивного анастомоза на сформированной по Roux петле тощей кишки (при наличии у печеночного графта одного или более желчных протоков размером менее 5 мм).
Ушивание анастомозов проводится на каркасном дренаже или без него однорядными узловыми швами, нитью «PDS 4,0».
с целью создания декомпрессии желчевыводящих путей и контроля состояния желчевыводящих путей в послеоперационном периоде (с оставлением до 3-х месяцев);
Проводится контроль наличия желчеистечения: через дренажную трубку вводится метиленовая синька. При обнаружении желчеистечения из сформированных анастомозов и/или мелких желчных протоков проводится их прошивание шовным материалом (пролен 4,0-5,0).
Устанавливаются контрольные дренажи – в правое и левое поддиафрагмальные пространства, подпеченочное пространство и в малый таз.
• нормализация показателей крови (тромбоцитов, общего белка, альбумина, мочевины, креатинина, общего билирубина, АлТ, АсТ, ГГТП, щелочная фосфатаза, триглицериды).
Информация
Источники и литература
Информация
1) Доскалиев Жаксылык Акмурзаевич – доктор медицинских наук, профессор, Академик, «Республиканский координационный центр трансплантации» директор учреждения.
2) Жариков Серик Нагашыбаевич – доктор медицинских наук, профессор, «Республиканский координационный центр по трансплантации» Заместитель директора учреждения, главный внештатный специалист по трансплантологии МЗСР РК.
3) Калиаскарова Кульпаш Сагындыковна – профессор АО «Медицинский университет Астана» кафедры гастроэнтерологии, главный внештатный гастроэнтеролог – гепатолог МЗСР РК.
4) Нерсесов Александр Витальевич – доктор медицинских наук, профессор РГП на ПХВ «Научно-исследовательский институт кардиологии и внутренних болезней» руководитель отдела гепатологии.
5) Токсанбаев Данияр Сапарович – кандидат медицинских наук, АО «Национальный научный центр хирургии имени А.Н. Сызганова», заведующий отделением гепатобилиарной хирургии и трансплантации печени.
6) Доскали Марлен Акмырзаулы – MD, PhD АО «Национальный научный медицинский центр», руководитель научного отдела органной трансплантации
7) Садыков Нариман Камильевич – кандидат медицинских наук, АО «Национальный научный центр хирургии имени А.Н. Сызганова», ведущий научный сотрудник отделения гепатобилиарной хирургии и трансплантации печени.
8) Макалкина Лариса Геннадиевна – PhD, РГП на ПХВ «Республиканский центр развития здравоохранения» МЗСР РК руководитель лекарственно–информационно–аналитического центра
Рецензенты:
Султаналиев Токан Анарбекович – доктор медицинских наук, профессор, АО «Национальный научный центр онкологии и трансплантологии», советник председателя правления, главный хирург
Указание условий пересмотра протокола: пересмотр протокола через 3 года и/или при появлении новых методов диагностики/ лечения с более высоким уровнем доказательности.
Советы по трансплантации печени
Ее выполнил 1 марта 1963 года Томас Шгарцл (Thomas Starzl) в клинике университета Колорадо (University of Colorado).
2. Улучшилась ли выживаемость трансплантата и больного при пересадке печени?
Да. Годичная выживаемость больных увеличилась до 87%, трансплантатов — до 79%.
3. Назовите наиболее частые показания к пересадке печени в Соединенных Штатах?
Более чем у половины реципиентов имеется нехолестатический цирроз. Ведущие заболевания в этой группе включают вирусный гепатит, алкогольный цирроз (цирроз Лаэннека (Laennec)) и синдром Бадда-Киари (Budd-Chiari). Холестатический цирроз отмечают еще у 15% больных, ведущими заболеваниями у которых являются первичный склерозирующий холангит и первичный билиарный цирроз.
Другие заболевания, при которых может потребоваться трансплантация, включают атрезию желчных протоков, острый некроз печени, злокачественные опухоли и метаболические расстройства.
4. Сколько трансплантаций выполняется ежегодно в Соединенных Штатах?
Более 4000. Однако ожидают пересадки более 8000 больных, число которых продолжает расти. Среднее время ожидания — более года, и многие больные умирают, не дождавшись операции. Нехватка доноров продолжает оставаться фактором, ограничивающим число трансплантаций.
5. Расскажите о последних достижениях хирургии в области трансплантации печени?
Сейчас пересадки выполняют без веновенозного шунта и без Т-образного желчного дренажа. Время операции сократилось до среднего значения в 5-6 часов. Пребывания после операции в реанимации часто не требуется, а в некоторых случаях нет необходимости даже в переливаниях крови и ее производных.
6. Сколько можно держать печень "во льду"?
В связи с улучшением качеств растворов для холодового хранения, в настоящее время печень можно хранить до 24 часов от получения до пересадки. Однако оптимальное время холодовой ишемии — менее 12 часов.
7. Какие послеоперационные осложнения часто наблюдают после пересадки печени?
Первичное нефункционирование (10%), тромбоз печеночной артерии (5% у взрослых, до 10% у детей) и желчные осложнения (10%).
8. Расскажите о технике "piggy-back".
Больную печень реципиента осторожно отсекают от полой вены, которая остается на месте. Затем надпеченочный сегмент нижней полой вены донора пришивают к общей манжетке, образованной устьями печеночных вен реципиента, после чего лигируют подпеченочный сегмент нижней полой вены донора. Этот метод позволяет выполнить трансплантацию без окклюзии полой вены, что позволяет уменьшить нарушения гемодинамики.
9. Является ли оптимальной трансплантация печени от живого донора?
Да. Хорошо разработана техника резекции левой латеральной доли с пересадкой ее ребенку, позволившая значительно сократить количество ожидающих операцию во многих педиатрических центрах. Быстро растет опыт пересадки от взрослого к взрослому всей доли печени. Несмотря па объем операции, ее можно выполнить безопасно. Впоследствии наблюдают быструю регенерацию долей печени как у донора, так и у реципиента.
10. Как применение ТВПШ улучшает результаты трансплантации печени?
Трансюгулярные внутрипеченочные портосистемные шунты (ТВПШ) могут служить мостом к трансплантации для больных, которым показана пересадка печени. Эта процедура позволяет успешно бороться с портальной гипертензией, позволяя обойтись без оперативного наложения тотального абдоминального шунта оперативным путем. Имеющийся портокавальный шунт осложняет операцию, но не является противопоказанием к пересадке печени.
11. Нужно ли выполнять трансплантацию печени при ее алкогольном поражении?
В центрах трансплантации существуют строгие критерии, которым должен соответствовать больной с алкогольным поражением, чтобы его включили в список ожидающих пересадку. Количество рецидивов (когда больные после трансплантации снова начинают пить) остается низким. В финансовом плане затраты сопоставимы (если не ниже) со стоимостью продолжения лечения болезни печени на последней стадии.
В настоящее время мы проводим лечение других заболеваний, спровоцированных самими больными, например курением. Общество должно понять, что кандидатов для трансплантации не стаскивают со стульев в баре.
12. Следует ли выполнять трансплантацию при злокачественных опухолях печени?
Трансплантацию успешно выполняют больным гепатоцеллюлярным раком, хотя продолжительность их жизни значительно меньше, если сравнивать с больными, которым пересадили печень в связи с другим заболеванием. Другие злокачественные опухоли печени, включая холангиоцеллюлярный рак, обычно считают противопоказанием к трансплантации. Целесообразность пересадки дефицитной донорской печени таким больным остается грудным вопросом.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:
