УЗИ печени при лимфоме
Обновлено: 18.05.2024
ДВККЛ — диффузная В-крупноклеточная лимфома
МРТ — магнитно-резонансная томография
МСКТ — мультиспиральная КТ
НХЛ — неходжкинские лимфомы
ПЛП — первичная лимфома печени
УЗИ — ультразвуковое исследование
HCV — вирус гепатита С
Лимфомы составляют 4,3% от всех первичных опухолей печени [1]. Лимфома печени может рассматриваться как «первичная», когда она возникает и локализована в печени. В 16—22% случаев неходжкинские лимфомы (НХЛ) в процессе диссеминации могут поражать печень [2]. В связи с этим для постановки диагноза первичной лимфомы печени (ПЛП) требуется комплексное обследование пациента для исключения поражения других экстранодальных органов, лимфатических узлов, селезенки, костного мозга и периферической крови. На основании гистологической картины и иммуногистохимических данных выделяют различные варианты ПЛП. Среди НХЛ, возникающих в печени, наиболее часто встречается диффузная В-крупноклеточная лимфома (ДВККЛ) [3—8]. В одном из исследований ДВККЛ составляла 71% от всех ПЛП [5]. Значительно реже встречаются другие варианты ПЛП: MALT-лимфома, лимфома Беркитта, фолликулярная лимфома, периферическая Т-клеточная неспецифицированная лимфома и анапластическая крупноклеточная лимфома [9—13]. Нам не встретилось в литературе ни одного описания лимфомы Ходжкина, которая первично поражала бы печень.
Приводим описание диффузной В-крупноклеточной лимфомы печени у пациентки с болезнью Шегрена (БШ).
Пациентка N., 1959 года рождения, с 1984 г. наблюдалась в НИИ ревматологии с диагнозом БШ. В течение многих лет принимала глюкокортикостероиды, цитостатики (хлорбутин, циклофосфан), получала курсы пульс-терапии метилпреднизолоном. В декабре 2010 г. госпитализирована в городскую клиническую больницу с жалобами на боли в правом верхнем отделе живота. При обследовании выявлены множественные очаговые образования в печени, которые были расценены как поражение печени солидной опухолью (гепатоцеллюлярная карцинома (?), метастазы из первично невыявленного очага (?). В марте 2011 г. обратилась в НИИ ревматологии с жалобами на резко выраженные боли в правом подреберье, слабость, профузную ночную потливость. При обследовании правая доля печени выступала на 4 см ниже края реберной дуги, резко болезненна при пальпации. Периферические лимфатические узлы и селезенка не увеличены. При ультразвуковом исследовании (УЗИ) органов брюшной полости выявлены множественные гипоэхогенные узлы в обеих долях печени с максимальным размером 110×105 мм в левой доле и 95×94 мм в правой доле. По результатам мультиспиральной компьютерной томографии (МСКТ) с внутривенным контрастированием органов грудной полости, брюшной полости и малого таза визуализированы множественные очаговые образования низкой плотности с однородной структурой и достаточно четкими контурами в обеих долях печени (рис. 1). Других патологических изменений в исследуемых областях не обнаружено. Общий анализ крови без особенностей. В биохимическом анализе отмечалось повышение активности аспартатаминотрансферазы 135 ед/л (норма

Рис. 1. Данные МСКТ. а — до контрастирования: множественные очаги низкой плотности с однородной структурой и достаточно четкими контурами в обеих долях печени; б — артериальная фаза контрастирования: определяется слабое и неоднородное накопление контраста в очагах; в — выделительная фаза: отмечается накопление контраста по периферии очагов. В структуре наибольшего образования стали дифференцироваться множественные тяжи.
С диагностической целью пациентке выполнена лапароскопия с биопсией узловых образований из обеих долей печени. При гистологическом исследовании выявили разрастание в ткани печени лимфомы из небольших клеток с округло-овальными и несколько неправильной формы ядрами с тонкодисперсным хроматином и плохо контурируемой цитоплазмой (рис. 2, а). При иммуногистохимическом исследовании опухолевые клетки экспрессировали CD45, CD20 (см. рис. 2, б), MUM1 (см. рис. 2, в), PAX5 и bcl-6, но были негативны при реакциях с CD2, CD3, CD4, CD5, CD8, CD10, CD30, VS38c, bcl-2 и TdT. Маркер пролиферативной активности Ki67 экспрессировали 90—95% опухолевых клеток (см. рис. 2, г). Таким образом, морфоиммуногистохимическая характеристика опухолевых клеток соответствовала ДВККЛ из активированных В-клеток (тип non-GCB).

Рис. 2. Гистологическая и иммуногистохимическая картина печени до ПХТ. Ув. 400. а — разрастание лимфомы из небольших клеток с округло-овальными и несколько неправильной формы ядрами с тонкодисперсным хроматином и плохо контурируемой цитоплазмой в ткани печени. Имеются фигуры митозов. Окраска гематоксилином и эозином; б — интенсивная мембранная экспрессия опухолевыми клетками CD20; в — экспрессия опухолевыми клетками MUM1; г — Ki67 экспрессируют 90—95% опухолевых клеток.
Проведено 8 курсов полихимиотерапии (ПХТ) по схеме R-CHOP + велкейд. По окончании ПХТ в сентябре 2011 г. при рестадировании стадии по данным магнитно-резонансной томографии (МРТ) с контрастированием в печени выявлены 2 очага неоднородной структуры с неровными контурами в III сегменте левой доли размером 33×25×26 мм (рис. 3) и в VI сегменте правой доли размером 30×26×18 мм. Пациентке выполнена резекция II, III и VI сегментов печени. При гистологическом исследовании в ткани печени выявлены инфильтраты из мелких лимфоидных клеток с ядрами неправильной формы (рис. 4, а). Иммуногистохимическое исследование продемонстрировало, что лимфоидные клетки экспрессировали CD2, CD3 (см. рис. 4, б) и CD8, но были негативны при реакциях с CD20, CD79а, PAX5 (см. рис. 4, в). Таким образом, лимфоидный инфильтрат состоял из Т-лимфоцитов. Данных, подтверждающих резидуальную В-клеточную лимфому, не получено. Пациентка находится под нашим наблюдением. В течение 38 месяцев сохраняется полная ремиссия лимфомы.

Рис. 3. Данные МРТ: накопление контрастного вещества по периферии очага в артериальную фазу контрастирования.

Рис. 4. Гистологическая и иммуногистохимическая картина печени после ПХТ. Ув. 400 а — инфильтрат из мелких лимфоидных клеток с ядрами неправильной формы в ткани печени. Окраска гематоксилином и эозином; б — лимфоидные клетки экспрессируют CD3; в — реакция с PAX5 отсутствует.
ПЛП впервые описана в 1965 г. A. Ata и соавт. [14]. Приблизительно 300 случаев ПЛП опубликовано в литературе до настоящего времени. ПЛП является очень редкой и составляет только 0,016% от всех НХЛ. Из всех первичных экстранодальных НХЛ только 0,4% возникают в печени [15].
Патогенез ПЛП неизвестен. В литературе обсуждается роль персистирующего воспалительного процесса, вызванного вирусами гепатита или аутоиммунным заболеванием. Полагают, что HCV преобладает среди пациентов с ПЛП и, вероятно, играет более важную роль в ее патогенезе, чем вирус гепатита В [16, 17]. Описаны случаи развития ПЛП у пациентов с аутоиммунными заболеваниями, в том числе первичным билиарным циррозом, системной красной волчанкой, ревматоидным артритом, БШ и целиакией [17—24]. Кроме того, ПЛП встречается у пациентов с ВИЧ-инфекцией или ятрогенной иммуносупрессией [25—28]. Хотя ПЛП может развиться в любом возрасте, наиболее часто она наблюдается в 5-й или 6-й декаде жизни. Соотношение мужчин и женщин составляет 2—3:1 [29].
Клиническая картина ПЛП неспецифична. Большинство пациентов обращаются с жалобами на лихорадку, снижение массы тела, ночные поты (так называемые «В» симптомы). Кроме того, пациенты могут жаловаться на дискомфорт или боль в правом подреберье, тошноту, рвоту, зуд, слабость. В биохимическом анализе крови может наблюдаться повышение активности трансаминаз, ЛДГ и лабораторных показателей холестаза, при этом уровни α-фетопротеина и карциноэмбрионального антигена в норме. У большинства пациентов при УЗИ или МСКТ выявляется солитарное образование или множественные очаги в паренхиме печени [30]. При УЗИ печени эти образования гипоэхогенны или изоэхогенны, а при МСКТ с контрастированием выглядят как гиподенсные иногда негомогенные образования [31].
В редких случаях ПЛП может манифестировать как острая печеночная недостаточность, без очагового поражения. У этих пациентов диагностика ПЛП особенно сложна. Наблюдаются быстро нарастающая печеночная недостаточность, прогрессирование гепатомегалии и гиперлактатемия. Такая клиническая картина наиболее часто ассоциирована с лимфомой Беркитта, ДВККЛ и анаплазированной крупноклеточной лимфомой. В этом случае только быстрая постановка диагноза и назначение соответствующей ПХТ дают шанс спасти пациента от смерти [32—34].
Основой диагностики лимфомы печени является гистологическое исследование биоптата. Для уточнения варианта лимфомы необходимо проведение иммуногистохимического, и в ряде случаев молекулярного и цитогенетического исследований. Как отмечено выше, в печени могут возникать разные варианты В- и Т-клеточных лимфом, при которых требуется различная лечебная и химиотерапевтическая тактика.
Из факторов риска развития лимфомы наша пациентка имела 27-летний анамнез БШ и длительный прием иммуносупрессивных препаратов и цитостатиков. Известно, что по сравнению с общей популяцией у пациентов с БШ в 6,6 раза увеличивается риск развития НХЛ и 9 раз — риск развития ДВККЛ [35]. До настоящего времени, насколько нам известно, описаны 5 случаев ПЛП у пациентов с БШ. У 2 из этих пациентов БШ сочеталась с первичным билиарным циррозом. В 3 случаях наблюдалась MALT-лимфома [17], а у 2 пациентов вариант лимфомы не был четко охарактеризован [20, 22]. По представленным в статьях данным, эти лимфомы медленно прогрессировали и имели В-клеточный иммунофенотип, что позволяет охарактеризовать их как В-клеточные лимфомы низкой степени злокачественности. Ни одного случая первичной ДВККЛ печени у пациентов с БШ не описано.
Обследование нашей пациентки выявило множественные очаговые образования в печени, что изначально расценено как гепатоцеллюлярная карцинома (ГЦК) или метастатическое поражение печени солидной опухолью. Однако высокий уровень ЛДГ, анамнез БШ и нормальные уровни α-фетопротеина и карциноэмбрионального антигена наводили на мысль о лимфоме. В редких случаях реактивная лимфоидная гиперплазия печени, которая манифестирует в виде одиночного или (менее часто) 2 либо 3 узловых образований, также входит в круг дифференциального диагноза ПЛП [36]. Вне зависимости от результатов лабораторного и инструментального исследований окончательный диагноз лимфомы печени основывается на результатах гистологического и иммуногистохимического исследований. Тщательное обследование с проведением МСКТ грудной, брюшной полостей и малого таза, гистологическим и цитологическим исследованием костного мозга и цитологическим анализом периферической крови позволило исключить у нашей пациентки вторичное поражение печени НХЛ и установить диагноз ПЛП. В нашей практике мы используем алгоритм, предложенный C. Hans и соавт. [37], для разделения ДВККЛ на лимфомы, происходящие из активированных В-клеток, и лимфомы из клеток герминативного центра. Оценка ряда иммуногистохимических маркеров (CD10, MuM1, Bcl6) позволила отнести ДВККЛ нашей пациентки в категорию ДВККЛ, происходящей из активированных В-клеток. По нашему опыту, у большинства пациентов с БШ ДВККЛ происходят из активированных В-клеток (собственные не опубликованные данные). Это имеет не только академический интерес. Известно, что ДВККЛ из активированных В-клеток имеют худший прогноз, чем ДВККЛ из клеток герминативного центра [38—40]. Этот негативный прогноз может быть нивелирован добавлением велкейда (бортезомиб) в классический протокол ПХТ R-CHOP [41, 42]. Результаты этих исследований послужили основанием использовать протокол R-CHOP + велкейд для лечения ДВККЛ печени у нашей пациентки.
Диагностика ПЛП остается трудной задачей вследствие редкости этой патологии и недостаточной информированности врачей. Клинико-инструментальная картина ПЛП может ошибочно расцениваться как ГЦК или метастазы солидной опухоли, либо манифестировать как острая печеночная недостаточность.
Единого стандарта лечения ПЛП не существует. Это связано с тем, что в печени могут возникать различные варианты НХЛ, при которых требуется разная тактика лечения (хирургическое удаление, лучевая терапия или комбинация этих подходов), а при необходимости химиотерапии — использование различных схем ПХТ.
УЗИ при раке печени (начало)
Злокачественные опухоли или рак печени необходимо выявлять на ранних стадиях, в этом помогает ультразвуковая диагностика. Первичные лимфомы печени проявляются на УЗИ как одиночные неспецифические очаговые образования. Печеночные отложения внепеченочных лимфом имеют много общих характеристик с метастазами других злокачественных процессов.
В некоторых случаях единственным печеночным проявлением лимфом по данным УЗИ является неспецифическая гепатомегалия. В таких случаях края печени обычно имеют нормальный вид, но при наличии выраженного инфильтративного процесса может быть краевой признак, такой как при метастатическом заболевании. Там также могут быть явные изменения в эхоструктуре, в том числе наличие микроузлов, макроузлов, инфильтрации и смешанных аномалий. После химиотерапии может развиться некроз, быстро приводящий к изменению эхообразований.

Связанные признаки при ультрасонографии
Наиболее важным ассоциированным признаком является спленомегалия, которая может быть гомогенной или гетерогенной. Другие важные связанные признаки включают забрюшинную аденопатию и выпоты, включая перитонеальный, плевральный и перикардиальный. Различные ультразвуковые признаки лимфом перечислены ниже:
- Неспецифическая гепатомегалия
- Гетерогенная гепатомегалия
- Узлы
- Инфильтрация
- Синдром «Метели»
- Синдром «Сито»
- Комбинация перечисленных признаков
- Спленомегалия
- Абдоминальная лимфаденопатия
- Плевральный выпот
- Перикардиальный выпот
- Асцит
Злокачественные опухоли (рак печени) при ультразвуковом исследовании
Гепатоцеллюлярные карциномы и фиброламеллярные гепатокарциномы, считаются наиболее частыми проявлениями рака. Большинство гепатоцеллюлярных карцином (ГЦА) (65% -85%, эпидемиология варьируется в разных частях мира) развиваются при цирротической печени. При этом, цирроз печени, вызванный алкогольной интоксикацией или вирусным гепатитом, имеет различные пропорции в разных регионах. Гормоны и, в частности, оральная контрацепция, являются фактором риска в отношении аденом и, в меньшей степени, фиброламеллярных карцином.
Афлатоксин играет роль в патогенезе гепатоцеллюлярных карцином в Африке и Азии. Гемохроматоз и первичный билиарный цирроз также являются предрасполагающими условиями.
Как проявляется рак печени при ультразвуковом исследовании
Аденоматозные гиперпластические узелки являются предраковыми поражениями. Существует несколько морфологических типов гепатоцеллюлярные карцином:
- Проникающие опухоли имеют узловой характер, без внешней капсулы и распространяются в соседней ткани.
- Обширные опухоли представляют собой изолированные образования, в основном узловые, хорошо очерченные капсулой и / или периферическим ободком из сжатой нормальной ткани. Септа - отдельные интранодулярные опухолевые территории, макроскопический рисунок которых может быть различным (мозаичный рисунок). Прогрессирующие опухоли распространяются через капсулу в соседние ткани.
- Диффузные опухоли типичны для гепатоцеллюлярных карцином, развивающихся в печени, состоящих из множества небольших рассеянных узелков.
- Последний тип - ранний или мелкоузловой, который первоначально определялся как узелок диаметром менее 4 см, но теперь определяется как узелок диаметром менее 2 см.
Сонографические модели при раке печени на УЗИ
На УЗИ при раке печени повреждения могут быть гиперэхогенными узлами и могут иметь конфигурацию «бычий глаз». Гипоэхогенные узелки или сложные поражения также могут быть обнаружены. Эхогенность гепатокарциномы зависит от структуры их тканей (обилие сосудов, жира или внутренних перегородок; главным образом, жира). Обильное содержание жира приводит к гиперэхогенному типу, напоминающему ангиому. Гиперэхогенность жира в узле печени неспецифична и даже сбивает с толку. Денситометрия с эластографией, компьютерной томографией (КТ) и флэш-последовательной магнитно-резонансной томографии (МРТ), подавляющие жир, могут быть очень полезны для характеристики жировых компонентов. Большие узелки часто менее эхогенные.
При больших размерах первичные опухоли также могут подвергаться некрозу. Очень похожие поражения наблюдаются на УЗИ при метастазах. На самом деле, около половины гепатокарцином при постановке диагноза являются мультинодулярными, что можно ожидать в глобально поврежденной печени, такой как цирротическая печень.
При исследовании 50 человек с гепатокарциномами печени мы обнаружили 29 изолированных узлов и 21 множественный узел. Диаметр изолированных узелков варьировал от 1,1 до 15 см, 8 были менее 3 см, 24 были гиперэхогенными, 14 были гипоэхогенными, 14 имели гало-эффект, а 12 имели смешанный мозаичный рисунок: все признаки контура и текстуры ткани, описанные в предыдущей главе, также наблюдаются при первичных опухолях.
Рядом исследователей был проведен детальный морфологический анализ ультразвуковых изображений гепатом. При них, как правило, часто визуализируются внутрипочечные перегородки. Однако это не было подтверждено моими собственными наблюдениями. В предыдущей главе мы рассмотрели анализ хода сосудов в узле: проявление гладкого сосудистого ветвления, проходящего через узел, позволяет исключить рак печени.
Изменения в эхотекстуре, связанные с ранее существовавшим циррозом, могут затруднить оценку печени. Врач УЗИ должен попытаться увидеть маленькие узелки диаметром менее 2 см. Диагноз малой гепатокарциномы основывается на повторном скрининге у пациентов с циррозом. Скрининг с помощью ультразвука в настоящее время распространен, но его истинная надежность еще обсуждается.
Точное гистологическое исследование имеет основополагающее значение при выборе правильной хирургической тактики. Биопсия под ультразвуковым контролем проводится регулярно у таких пациентов и хорошо отработана. Поскольку многие гепатокарциномы имеют значительную гиперваскуляризацию, следует избегать прямой пункции поверхностных поражений. Косой прокол через нормальные ткани является предпочтительным.
Однако цитологический диагноз гепатокарциномы часто затруднителен, поскольку злокачественные клетки могут напоминать нормальные гепатоциты. У молодого пациента гистология иногда обнаруживает фиброламеллярную гепатокарциному. Такие опухоли часто инкапсулированы. Они метастазируют реже, чем обычные гепатокарциномы. Шестьдесят процентов фиброламеллярных гепатокарцином имеют центральное изображение рубца, 80% кальцинированных очагов. Однако следует подчеркнуть, что изображения центрального рубца на УЗИ не являются специфическими для рака печени. Иногда они обнаруживаются при циррозе печени и во многих очаговых узловых гиперплазиях. Большинство фиброламеллярных гепатокарцином представляют собой одиночные узлы.

Допплерография может помочь в диагностике гепатокарциномы. Как упомянуто выше, ожидается, что трехмерное ультразвуковое допплеровское ультразвуковое моделирование восстановит сосудистую архитектуру опухолей печени, как показано селективной ангиографией. Между тем, цветное ультразвуковое допплерографическое картирование в большинстве гепатоцеллюлярных карцином показывает множественные цветные пятна, соответствующие срезам сосудов, и часто некоторые периферические сосуды (рисунок «корзина»): «поющая» опухоль с дуплексным ультразвуковым доплером или «светящаяся» опухоль с цветным картированием является признаком, указывающим на гепатокарциному.
Этот доплеровский паттерн, при подозрении на рак печени, очень отличается от одной гепатоцеллюлярной карциномы к другой: некоторые из них сильно васкуляризованы, другие намного меньше, что связано с наличием обильного жира или некроза. К сожалению, цветовые узоры при гепатокарциномах похожи на такие же проявления, связанные с другими типами опухолей, как злокачественных, так и доброкачественных. Дуплексное ультразвуковое доплеровское исследование может быть более конкретным, поскольку показано, что только гепатоцеллюлярные аденомы показывают сдвиги скорости выше 4 кГц, но такие пики скорости редки.
Лимфоузлы при неходжкинской лимфомы на УЗИ
Основные факты при ультразвуковом исследовании лимфоузлов шеи при лимфоме
- Множественные двусторонние, ненекротически расширенные узлы в обычных и необычных шейных и затылочных узловых цепях
- На УЗИ лимфатические узлы неходжкинской лимфомы (НХЛ) обычно округлые с резкими границами
- Нечеткая граница указывает на экстракапсулярное распространение, подразумевающее агрессивное заболевание
- Солидный узел, у которого отсутствуют нормальные эхогенные ворота (72-73%)
- Используя современные датчики высокого разрешения, несмотря на их солидную природу, лимфоузлы НХЛ имеют тенденцию к заднему усилению
- При ультразвуковом сканировании лимфоузлы неходжкинской лимфомы показывают интранодальный ретикулярный / микронодулярный рисунок с использованием более новых датчиков с высоким разрешением
- Кальцификация редкая находка и если присутствует, обычно встречается после лучевой терапии
- Несмотря на большой размер узлов, кистозный некроз встречается редко и если от определяется на УЗИ, то это предполагает агрессивное течение неходжкинской лимфомы
- Цветной допплер: смешанная васкуляризация с выраженным сосудистым рисунком и наличием периферической васкуляризации. Периферическая сосудистая сеть редко встречается в узлах НХЛ
Основной дифференциальный диагноз
- Метастазы в лимфоузлы шеи от системного первичного рака
- Реактивная аденопатия
- Туберкулезный аденит
Клинические проблемы. Заболеваемость увеличивается с возрастом и у пациентов с ослабленным иммунитетом
Повышенная ассоциация с вирусом Эпштейна-Барра или HTLV-1 (Т-лимфотропный вирус), особенно с африканской болезнью Беркитта и СПИДом.
Диагностический контрольный список
- Если на УЗИ подозревается НХЛ, вместо цитологии при ТАБ может быть выполнена расширенная биопсия.
- Выбор основной биопсии или эксцизионной биопсии в НХЛ зависит от местной практики и опыта
- УЗИ не оценивает поражение заглоточного пространства и средостения
- КТ или ПЭT проводят для определения степени заболевания
Терминология. Сокращения. Неходжкинская лимфома (НХЛ). Определения. Рак, развивающийся в лимфо-ретикулярной системе, предположительно возникает из лимфоцитов и их производных
Основные характеристики при ультразвуковом сканировании шеи
Лучший диагностический признак на УЗИ. Множественные двусторонние ненекротически увеличенные узлы в обычных (яремная цепь, задний треугольник шеи) и необычных [ретрофарингеальное пространство (РФП), подчелюстное пространство (ПЧП), затылочные] узловые цепи. Может также представляться как один доминирующий некротический узел с несколькими меньшими окружающими лимфоузлами
Расположение. Поражение лимфатических узлов встречается в шейных цепях. Уровни II, III и IV часто участвуют в патологии. Поверхностная аденопатия, уровень V и спинномозговые узлы также распространенная проблема. Ненодальная лимфатическая болезнь встречается в небных миндалинах (наиболее распространенных), язычной ткани миндалин и аденоидах. Ненодальная экстралимфатическая болезнь встречается в околоносовых пазухах, основании черепа и щитовидной железе
Морфология. Лимфатические узлы круглые или овальные, как правило, без экстракапсулярного расширения
Если узлы показывают некроз ± экстранодальное распространение на УЗИ, подразумевается агрессивный HTLV-1. СПИД-ассоциированные лимфомы часто агрессивны

Ультрасонографические данные. Узлы НХЛ обычно круглые с четкими границами. Отложение опухоли в узлах создает больший акустический импеданс между узлом и прилегающими мягкими тканями, что приводит к резкой границе. Нерезкая граница указывает на экстракапсулярное распространение, подразумевая агрессивное заболевание неходжкинской лимфомы. Солидный узел и отсутствие нормальных эхогенных ворот встречается у 72-73% пациентов.
Обычно на УЗИ это гипоэхогенный лимфоузел по сравнению с соседними мышцами и ранее описывалось как псевдокистозные узлы с задним усилением. При использовании более старых преобразователей внутренние эхосигналы в узлах были очень низкими, почти анэхогенными, напоминающими кисту. Используя современные датчики высокого разрешения, несмотря на их солидную природу, мы видим, что узлы НХЛ имеют тенденцию к заднему усилению. Равномерная клеточная инфильтрация внутри узлов создает меньше границ между структурами и облегчает прохождение ультразвука. Это, в сочетании с низкой внутренней эхогенностью, приводит к так называемому псевдокистозу. Лимфоузлы неходжкинской лимфомы показывают интранодальный ретикулярный или микронодулярный рисунок с использованием более новых преобразователей высокого разрешения
Кальцификация на УЗИ встречается редко, и если присутствует, то обычно после лучевой терапии. Несмотря на большой размер лимфатических узлов, кистозный некроз встречается не часто, и если выявляется, то предполагает агрессивный тип неходжкинской лимфомы
Цветовой допплер: смешанная сосудистая сеть с выраженными внутриузловыми сосудами и наличием периферической сосудистой системы. Одна только периферическая сосудистая сеть редко встречается в узлах НХЛ. Спектральный допплер: переменное интранодальное внутрисосудистое сопротивление, которое носит неспецифический характер.
Результаты КТ. Плотность узлов ≤ мышц. Кальцификация чрезвычайно редка и, если присутствует, обычно после лучевой терапии. При КТ с контрастированием выявляются множественные яйцевидные образования в двух или нескольких цепях лимфатических узлов шеи. Единственный доминирующий однородный узел с рассеянными окружающими меньшими узлами. Лимфатические узлы могут быть различными по внешнему виду, начиная от изоденсных мышц и заканчивая диффузным усилением. Узловые образования могут казаться некротическими с периферическим усилением ободка и центральной частью низкой плотности. Можно увидеть переменную внешность у одного и того же пациента с некоторыми узлами низкой плотности и некоторыми кажущимися некротическими

МРТ данные
• T1WI. Узлы изоинтенсивны для мышц
• T2WI. Узлы гиперинтенсивные для мышц
• T1WI C +. Узлы усиливаются мягким, однородным образом. Некротическая аденопатия усиливается периферически
Результаты ядерной медицины. ПЭТ. Нодальный и ненодальный тип НХЛ сильно зависят от радиофармпрепарата. Изображения с Галлий-67 полезны для скрининга всего тела лимфомы, но имеют низкую специфичность
Дифференциальная диагностика при ультразвуковом исследовании шеи
- Метастазы первичных опухолей в лимфоузлы шеи. Множественные гипоэхогенные узлы в зонах известного места дренирования первичной опухоли. На УЗИ лимфоузел гипоэхогенный, округлый, ± интранодальный некроз, периферическая сосудистая сеть. Если история первичной опухоли неизвестна, проявление при ультразвуковом сканировании может быть неотличимо от НХЛ
- Реактивная аденопатия. Солидные, гипоэхогенные, эллиптические узлы с эхогенным рисунком эхогенных ворот и хиларной васкулярностью с низким сопротивлением
- Туберкулезный аденит. Множественные круглые, некротические, спаянные лимфатические узлы ± эхогенные ворота, бессосудистая или смещенная сосудистая сеть
- Саркоидоз. Диффузные шейные узлы, которые могут точно имитировать неходжкинскую лимфому, связанные с медиастинальными узлами ± кальцификация
- Лимфома Ходжкина. НХЛ узлового типа нельзя дифференцировать от узловой лимфомы Ходжкина. НХЛ: чаще встречается у пожилых пациентов ± экстранодальная болезнь
Патология. Общие характеристики. Этиология. Моноклональная нерегулируемая пролиферация лимфоцитов.
Связанные аномалии. Часто ассоциируется со СПИДом как у детей, так и у взрослых. Нормальная узловая архитектура разрушена лимфомными клетками
Постановка диагноза, оценка и классификация
- Неходжкинская лимфома, узловой тип, обычно низкий класс
- Экстранодальные заболевания чаще среднего или высокого класса
- Пересмотренная European-American Lymphoma (REAL) классификация. В-клеточные новообразования. Предшественник В-лимфобластной лейкемии / лимфомы. Периферические В-клеточные новообразования. Т-клеточные и предполагаемые новообразования NK-клеток. Предшественник Т-лимфобластной лейкемии / лимфомы. Периферические Т-клеточные и NK-клеточные новообразования
Критерии постановки стадии лимфом по Ann Arbor
Стадия I: один узловой регион или один экстралимфатический орган
Стадия II: вовлечение ≥2 узловых областей или поражение одиночного внелимфатического органа и смежных узлов на одной стороне диафрагмы
Стадия III: положительные узловые области с обеих сторон диафрагмы
Стадия IV: мультифокальное вовлечение с ≥ 1 экстралимфатическим органом
Клинические проблемы и проявления. Наиболее распространенные признаки / симптомы. Большая, безболезненная, маленькая, резиноподобная опухоль шеи. Системные симптомы: ночные поты, рецидивирующая лихорадка, необъяснимая потеря веса, усталость и кожная сыпь.
Клинический профиль. Безболезненная образование шеи у больного СПИДом чаще всего НХЛ
Демография. Возраст. Медиана: 50-55 лет. Пол. Мужчины: Женщины = 1,5: 1,0
Эпидемиология. НХЛ является вторым наиболее распространенным новообразованием головы и шеи. Неходжкинская лимфома = 5% всех случаев рака головы и шеи. Факторы риска НХЛ. Заболеваемость увеличивается с возрастом и с ослабленным иммунитетом. Четкая связь с вирусом Эпштейна-Барра или HTLV-1, особенно с африканскими лимфоцитами Беркитта и СПИДа.
Заболеваемость. Лимфома Ходжкина: 7000 случаев / год, Естественная история и прогноз. Непредсказуемая естественная история болезни, которая может перейти в постоянную или временную ремиссию или продолжать прогрессировать, несмотря на лучевую и химиотерапию. Прогноз зависит от стадии и реакции на терапию. Результат очень плохой в связанной со СПИДом НХЛ. Расчетные показатели излечения: I и II стадии: 85% с использованием лучевой терапии. Стадии II и IV: 50% с комбинированной лучевой терапией и химиотерапией
Лечение. Выбор лечения НХЛ зависит от стадии, типа клеток, возраста пациента. Обычно лечится с помощью лучевой (XRT) ± химиотерапией. Неходжкинская лимфома, ограниченная головой и шеей, может лечиться только с помощью XRT. Распространенную НХЛ лечат химиотерапией. Трансплантация костного мозга проводится в несколько этапов
Итог
УЗИ печени при лимфоме
ФГБУ «Государственный научный центр «Федеральный медицинский биофизический центр им. А.И. Бурназяна», Москва, Россия
В-крупноклеточная лимфома с поражением печени и поджелудочной железы
Журнал: Доказательная гастроэнтерология. 2016;5(4): 49‑53
Описан случай первичной лимфомы поджелудочной железы и печени у пациентки 76 лет. Приведены данные литературы о частоте встречаемости, клинической картине, особенностях инструментальной диагностики. Внимание акцентировано на обязательном проведении иммуногистохимического исследования биоптатов новообразований, результаты которого определяют тактику и схему лечения больного.
Первичная панкреатическая лимфома (ППЛ) является чрезвычайно редким заболеванием: частота встречаемости 0,4—2,0% от всех внеузловых злокачественных лимфом, 0,5—0,9% — от всех опухолей поджелудочной железы (ПЖ). Наиболее часто ППЛ локализуется в головке ПЖ (более 80%), значительно реже — в теле и хвосте. Существуют единичные описания, когда ППЛ представляла собой не солитарный узел, а состояла из нескольких первичных опухолевых узлов. Практически все ППЛ, о которых было сообщено до настоящего времени, имеют В-клеточный тип [1, 2].
Наиболее часто ППЛ проявляется болями в животе, похуданием, желтухой, диареей, общей слабостью, а в ряде случаев может манифестировать симптомокомплексом острого панкреатита, кишечной непроходимости, желудочно-кишечного кровотечения или стеноза выходного отдела желудка. Поскольку опухоль нередко достигает крупных размеров, она может пальпироваться в верхних отделах живота в виде неподвижного болезненного округлого плотноэластического образования. Длительность персистирования симптомов до момента обращения за медицинской помощью и установления диагноза невелика и составляет в среднем 5 нед, что меньше, чем при раке ПЖ (4 мес и более) [1, 2].
Трансабдоминальное ультразвуковое исследование и компьютерная томография— методики выбора при диагностике лимфом. Как и при УЗИ, большинство лимфом при компьютерной томографии (КТ) выглядят как гомогенный очаг низкой плотности. Только в отдельных случаях очаги носят характер гетерогенных, что затрудняет проведение дифференциальной диагностики со злокачественным поражением ПЖ [2, 3].
Тонкоигольная аспирационная биопсия является высокоточным малоинвазивным методом обнаружения ППЛ. Типичным признаком ППЛ является обнаружение лимфоцитов с крупными ядрами, в 3—4 раза превышающими ядра нормальных лимфоцитов, с одним или несколькими заметными ядрышками с зонами некрозов и кариорексиса [2].
Тактика лечения ППЛ определяется локализацией, размером опухоли, ее распространенностью, гистологической структурой, иммунофенотипом и развившимися осложнениями. Основные подходы к специфическому лечению предусматривают оперативные вмешательства, химио- и лучевую терапию или комбинацию этих методов. Немаловажную роль играют дополнительные лечебные подходы, включающие заместительную ферментную терапию, коррекцию углеводного обмена, купирование боли, дезинтоксикационную терапию, что в целом значительно улучшает качество жизни больных [2, 5].
Химиотерапия является методом выбора при лечении большинства пациентов с лимфомой П.Ж. Наиболее распространенными режимами лечения являются схемы CVP, CHOP и MACOP-B. Полного излечения у пациентов с ППЛ при комплексном подходе удается достичь более чем в 30% случаев. К хирургическим методам прибегают, если имеется осложненное течение лимфомы (сдавление двенадцатиперстной кишки, холедоха, дистального отдела главного панкреатического протока), а также в случае невозможности морфологической верификации диагноза при использовании малоинвазивных методов исследования [2].
Первичная лимфома печени (ПЛП) впервые описана в 1965 г. A. Ata и соавт. ПЛП является очень редкой и составляет лишь 0,016% от всех неходжкинских лимфом (НХЛ). Из всех первичных экстранодальных НХЛ только 0,4% развиваются в печени [4, 5].
Для постановки диагноза ПЛП требуется комплексное обследование пациента для исключения поражения других экстранодальных органов, лимфатических узлов, селезенки, костного мозга и периферической крови. Среди НХЛ, возникающих в печени, наиболее часто (71%) встречается диффузная В-крупноклеточная лимфома (ДВККЛ) [6—8].
Клиническая картина ПЛП неспецифична. Большинство пациентов обращаются с жалобами на лихорадку, снижение массы тела, ночные поты (так называемые «В» симптомы). Кроме того, пациенты могут жаловаться на дискомфорт или боль в правом подреберье, тошноту, рвоту, зуд, слабость. В биохимическом анализе крови может наблюдаться повышение активности трансаминаз, лактатдегидрогеназы (ЛДГ) и лабораторных показателей холестаза, при этом уровни α-фетопротеина и карциноэмбрионального антигена в норме. У большинства пациентов при УЗИ или мультиспиральной КТ (МСКТ) выявляется солитарное образование или множественные очаги в паренхиме печени. При УЗИ печени эти образования гипоэхогенны или изоэхогенны, а при МСКТ с контрастированием выглядят как гиподенсные, иногда негомогенные образования [3, 5].
Основой диагностики лимфомы печени является гистологическое исследование биоптата. Для уточнения варианта лимфомы необходимо проведение иммуногистохимического (ИГХ), и в ряде случаев молекулярного и цитогенетического исследований. Диагностика ПЛП остается трудной задачей вследствие редкости этой патологии и недостаточной информированности врачей. Клинико-инструментальная картина ПЛП может ошибочно расцениваться как гепатоцеллюлярная карцинома или метастазы солидной опухоли, либо манифестировать как острая печеночная недостаточность [3, 5—7].
Единого стандарта лечения ПЛП не существует. Это связано с тем, что в печени могут возникать различные варианты НХЛ, при которых требуется разная тактика лечения (хирургическое удаление, лучевая терапия или комбинация этих методов), а при необходимости химиотерапии — использование различных схем полихимиотерапии (ПХТ) (например, протокол R-CHOP) [9—11].
В качестве клинического примера приводим историю болезни пациентки С., 76 лет, которая поступила сжалобами на общую слабость, озноб, сопровождающийся повышением температуры тела до 38,3 °С, преимущественно в вечерние часы.
Считает себя больной с начала мая 2016 г., когда впервые отметила появление ознобов и лихорадки, заложенность носа. Амбулаторно наблюдалась с диагнозом острый ринофарингит; принимала ципрофлоксацин, амоксиклав без эффекта. В общем анализе крови была выявлена анемия, тромбоцитопения, ускоренная СОЭ, в связи с чем больная была направлена на госпитализацию в ФМБЦ для верификации диагноза.
Из сопутствующих заболеваний: рак левой молочной железы (комбинированное лечение в 1996 г.), артериальная гипертензия (принимает бисопролол 5 мг, лизиноприл 5 мг), сахарный диабет 2-го типа (принимает метформин 2000 мг/сут).
Общее состояние удовлетворительное. Индекс массы тела — 28,54 кг/м 2 , поверхность площади тела — 1,781 м 2 . При физикальном обследовании установлены следующие отклонения: избыточное развитие подкожной жировой клетчатки, незначительное повышение артериального давления — 145 и 80 мм рт.ст., частота пульса — 80 ударов в минуту.
В клиническом анализе крови выявлена нормохромная, нормоцитарная анемия легкой степени тяжести (гемоглобин — 103 г/л, эритроциты — 3,49∙10 12 /л) и тромбоцитопения (86∙10 9 /л). Анализ мочи — без отклонений от нормы. Результаты биохимического исследования крови и онкомаркеров представлены в табл. 1, 2.
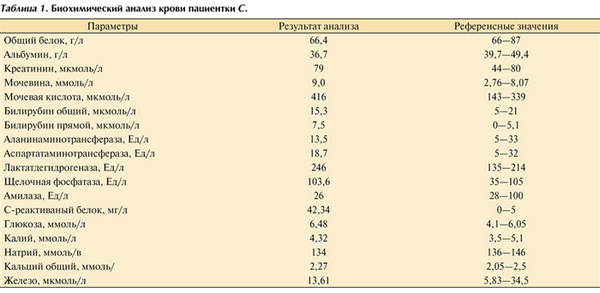
Таблица 1. Биохимический анализ крови пациентки С.

Таблица 2. Результаты исследования онкомаркеров пациентки С.
Маркеры инфицирования вирусами гепатитов В и С не обнаружены. По данным УЗИ органов брюшной полости (май 2016 г.): печень расположенатипично, правая доля толщиной 125 мм, левая доля толщиной 50 мм, структура паренхимыдиффузно неоднородная, зернистая, смазанная, с эффектом акустического затухания, гиперэхогенная, сосудистый рисуноксмазан, обеднен на периферии; воротная вена в воротах печенине расширена, проходима (11 мм); печеночные вены не расширены. В V6—7 сегментах выявлены гипоэхогенные образования округлой формы размерами 45×29 мм, 32×23 мм, 31×22 мм, по ходу гастродуоденальной связки и в проекции головки поджелудочной железы округлые гипоэхогенные образования размерами 32×26 мм, 20×18 мм, 20×10 мм (измененные лимфоузлы?). Желчный пузырь, желчные протоки, поджелудочная железа, селезенка не изменены. Свободная жидкость в брюшной полости не определяется. Заключение: признаки очаговых образований печени и измененных лимфоузлов брюшной полости, диффузных изменений печени по типу жировой дистрофии, диффузных изменений поджелудочной железы.
Для уточнения характера очаговых изменений проведена компьютерная томография (КТ) органов грудной клетки и органов брюшной полости с внутривенным контрастированием.
Данные КТ органов грудной полости (23.05.2016): в плащевых отделах обоих легких определяются единичные очаги фиброза размером до 2—3 мм. В S6 левого легкого определяется очаг округлой формы около 6 мм в диаметре. В S9 левого легкого определяются два близко расположенных очага округлой формы, диаметром 3 мм и 4 мм. Инфильтративных изменений в легких не выявлено. Корни легких структурные. Просвет трахеи и крупных бронхов свободный. Внутригрудные лимфатические узлы не увеличены. Сердце без особенностей, атеросклероз грудного отдела аорты и коронарных артерий. Выпота в серозных полостях нет. Дегенеративные изменения скелета. Заключение: данных за пневмонию не получено. Единичные очаги в нижней доле левого легкого, возможно в рамках поствоспалительного фиброза (рекомендовано контрольное КТ-исследование в динамике). Дегенеративные изменения скелета.
КТ органов брюшной полости с внутривенным контрастированием (23.05.2016): печень обычно расположена, краниокаудальный размер правой доли до 159 мм. В правой доле печени определяются единичные гиповаскулярные образования округлой формы, имеющие зону кистозной плотности в центральных отделах, в S7 до 24 мм в диаметре, на границе S7/6 деформирующее внешний контур печени образование размером до 44×32 мм, в S6 — до 30 мм. С нижней поверхностью S4, рядом с ямкой желчного пузыря, сливается образование, схожей структуры, расположенное преимущественно за пределами контура печени, округлой формы, размером до 27×12×20 мм, внутри- и внепеченочные желчные протоки не расширены. Желчный пузырь не увеличен, без рентгеноконтрастных включений. Селезенка не увеличена, структура однородная. В перешейке поджелудочной железы определяется гиповаскулярное образование с экзофитным ростом, неправильной округлой формы, размерами до 30×32×35 мм. Образование контактирует с поверхностью хвостатой доли печени, прилежит к сосудам портального бассейна в области конфлюэнса, а также по поверхности образование огибают общая печеночная артерия, гастродуоденальная артерия и собственная печеночная артерия, кровоснабжающая левую долю печени (правая доля печени кровоснабжается собственной печеночной артерией, идущей от верхней брыжеечной артерии). Остальные отделы поджелудочной железы с признаками атрофии. Вирсунгов проток не расширен. Прилежащая передняя парапанкреатическая клетчатка рядом с перешейком железы тяжистая, в ней определяются единичные лимфатические узлы размером до 6 мм. Надпочечники типичной Y-образной формы, правый надпочечник без объемных образований, в латеральной ножке левого надпочечника определяется образование размерами 12×11 мм, плотностью при нативном исследовании до 22 HU, накапливающее контрастный препарат в артериальную фазу до 97 HU и сбрасывающее его к отсроченной фазе до 48 HU. Почки обычно расположены, кортикомедуллярная дифференцировка сохранена. В синусах обеих почек определяются парапельвикальные кисты размерами: справа — до 32×16 мм, слева — до 25×17 мм. В нижнем сегменте левой почки также определяется киста размером до 39×32 мм. Чашечно-лоханочная система не расширена, выделительная функция синхронна, своевременна. Сосудистые ножки дифференцированы. В малом сальнике немногочисленные лимфатические узлы размером до 7 мм каждый, интрааортокавальные и по ходу почечных ножек справа размерами до 14 мм, в печеночно-двенадцатиперстной связке узлы максимальным размером до 28×16 мм. Выпота в брюшной полости нет. Атеросклеротические изменения аорты и подвздошных сосудов. Заключение (рис. 1, рис. 2):опухоль поджелудочной железы. Метастатическое поражение печени. Абдоминальная и забрюшинная лимфаденопатия. Образование в левом надпочечнике также вероятно метастатического характера. Кисты почек.

Рис. 1. КТ брюшной полости с внутривенным контрастированием. а — поперечный срез, стрелками указаны объемные образования поджелудочной железы и печени; б — поперечный срез, очаговые образования правой доли печени.

Рис. 2. КТ брюшной полости с внутривенным контрастированием (сагиттальный срез, стрелкой указано образование поджелудочной железы).
При ЭГДС (май 2016 г.) выявлен хронический гастрит с признаками атрофии.
По данным колоноскопии (май 2016 г.) получена долихосигма. Сигмоидит. Полип нисходящего отдела толстой кишки (8—9×3—4 мм). Фовеолярная гиперплазия прямой кишки (3×5 мм). Взята биопсия из патологически измененных участков слизистой кишки.
Заключение
На основании проведенного обследования пациентке С. был выставлен предварительный диагноз: опухоль поджелудочной железы Т4NxM1 c метастатическим поражением печени, абдоминальных и забрюшинных лимфоузлов.
С целью верификации гистологического диагноза проведена трепан-биопсия очагового образования печени с ИГХ-исследованием, получена картина диффузной В-крупноклеточной лимфомы.
Пациентка консультирована гематологом, установлен окончательный диагноз: лимфома, диффузная В-крупноклеточная IVВ стадии, с поражением печени, поджелудочной железы, забрюшинных лимфоузлов.
С учетом возраста пациентки и сопутствующей патологии с 24.06.2016 начат 1-й курс ПХТ R-CHOP (ритуксимаб, циклофосфан, адриабластин, винкристин, преднизолон) с редукцией дозы антрациклинов на 50% и преднизолона на 25%. С 18.07.2016 проведен 2-й курс R-CHOP, лечение перенесла удовлетворительно.
По данным КТ после двух курсов ПХТ размер образований в печени уменьшился: в S7 — до 15 мм, в S7/6 — до 35×20 мм, в S6 — до 18 мм, образование по краю S4 рядом с ямкой желчного пузыря — до 12×8 мм, ранее определяемое в области перешейка поджелудочной железы — до 20×15 мм. Уменьшился также размер абдоминальных лимфатических узлов (так в печеночно-двенадцатиперстной связке — с 28×16 мм до 14×7 мм).
В последующем в августе-сентябре 2016 г. проведены 3-й и 4-й курс ПХТ R-CHOP без осложнений, больная выписана.
Таким образом, пациентка изначально поступала с подозрением на солидную опухоль поджелудочной железы с метастатическим поражением печени, что определяло плохой прогноз. Однако благодаря проведению трепанобиопсии печени с ИГХ биоптата удалось верифицировать диагноз и добиться положительной динамики на фоне адекватной ПХТ. Наблюдение за пациенткой продолжено.
Лимфома

Лимфома - это поражение иммунной системы и внутренних органов, в которых скапливаются измененные клетки, нарушающие работу тканей.
Опухоль развивается в лимфатической системе, которая помогает нам бороться с инфекциями и другими заболеваниями. Циркулирующая в ней лимфа омывает все клетки организма и доставляет в них необходимые вещества, забирая отходы. В расположенных по всей ее сети лимфатических узлах опасные вещества обезвреживаются и выводятся из организма.
Лимфосистема дополняет кровеносную и помогает жидкостям перемещаться по телу. В отличие от крови, скорость движения которой задает «насос» - сердце, лимфа медленно циркулирует самостоятельно.
Как развивается лимфома?
Онкология начинается с появления в организме всего лишь одной измененной клетки иммунной системы. Всего выделяют 2 основных их типа:
- В-лимфоциты: вырабатывают антитела - белки, защищающие организм от бактерий и вирусов. Именно в них образуется большинство лимфом.
- Т-лимфоциты, одна часть которых уничтожает микробы и неправильные клетки, а вторая - помогает повысить или замедлить активность иммунитета.
Почти все ненормальные клетки выявляются и уничтожаются нашим иммунитетом, но некоторым из них удается выжить. Они постепенно размножаются, распространяются по всему телу, создают опухоли, скапливаются во внутренних органах и нарушают их работу.
Заболевание может возникать в любой области, где находится лимфатическая ткань, основными участками которой являются:
- Лимфатические узлы - небольшие органы размером с горошину, представляющие из себя скопления клеток иммунной системы, в том числе лимфоцитов. В организме человека их более 500.
- Селезенка, расположенная под нижними ребрами на левой стороне тела. Она производит лимфоциты, хранит здоровые клетки крови и отфильтровывает поврежденные, а также разрушает микробов и чужеродные вещества.
- Костный мозг - губчатая ткань внутри определенных костей. Здесь образуются новые клетки крови, в том числе часть лимфоцитов.
- Тимус, или вилочковая железа - небольшой орган, расположенный за верхней частью грудины перед сердцем. В нем происходит созревание и развитие некоторых лимфоцитов.
- Миндалины, или гланды - скопления лимфатической ткани в задней части глотки. Эти органы помогают вырабатывать антитела - белки, не позволяющие размножаться вдыхаемым или проглатываемым микроорганизмам.
- Пищеварительный тракт: желудок, кишечник и многие другие органы также содержат лимфатическую ткань.
Лимфома - это рак?
Раком официальная медицина России и некоторых других стран называет злокачественные опухоли - опасные для жизни новообразования, которые развиваются в эпителиальных клетках, содержащихся в коже или слизистых оболочках, и выстилающих внутреннюю поверхность органов.
Лимфома - это не рак, а онкологическое заболевание. Она образуется из лимфоцитов, а ее клетки также умеют бесконтрольно делиться, накапливаться в тканях, нарушая их работу, и создавать дополнительные очаги заболевания в различных частях тела.
Типы лимфом
Врачи выделяют 2 их основных класса:
Лимфома Ходжкина, или лимфогранулематоз: чаще всего начинается в лимфатических узлах верхней части тела - на груди, шее или в подмышках. Как правило, она распространяется в различные лимфоузлы по лимфатическим сосудам, но в редких случаях на поздних стадиях проникает в кровоток и распространяется на другие части тела, такие как печень, легкие или костный мозг. Данный диагноз ставится при выявлении в организме особых клеток - Березовского-Рид-Штернберга, которые представляют из себя измененные В-лимфоциты.
К неходжкинским лимфомам относят все остальные типы заболевания - их насчитывается около 30. У каждого из них есть свои, особые признаки: расположение первичной опухоли, строение и скорость развития.
Причины развития лимфом
Врачам и ученым точно не известно, почему именно в организме человека начинает развиваться заболевание. Они знают лишь о факторах, которые повышают вероятность образования каждого из типов онкологии.
Для лимфом Ходжкина они выглядят следующим образом:
- Вирус Эпштейна - Барр, вызывающий инфекционный мононуклеоз - поражение лимфоидной ткани, включая аденоиды, печень, селезенку и лимфатические узлы. У части пациентов части вируса обнаруживаются в клетках Березовского-Рид-Штернберга, но у большинства больных его признаков нет.
- Возраст: диагноз может быть поставлен в любом возрасте, но чаще всего он встречается у 20-летних и людей старше 55.
- Пол: среди мужчин заболевание более распространено, чем среди женщин.
- Наследственность и семейный анамнез: риск повышен для братьев и сестер, а также для однояйцевых близнецов Однояйцевые близнецы развиваются из одной яйцеклетки, оплодотворенной одним сперматозоидом. Они бывают только одного пола, имеют одинаковые гены и крайне похожи внешне. обладателей лимфомы Ходжкина. Причина этого точно не известна - возможно, все дело в том, что члены одной семьи в детстве переносят одни инфекции, либо имеют общие унаследованные генные изменения, увеличивающие вероятность развития данного типа онкологии.
- Ослабленная иммунная система. Шансы получить данный диагноз возрастают у людей с ВИЧ инфекцией и нарушениями работы иммунитета, развивающимися в том числе из-за приема подавляющих его препаратов, что нередко требуется после пересадки органов.
Список таких факторов для неходжкинских лимфом выглядит иначе:
- К ним относят воздействие радиации, включая ее дозы, полученные в ходе лучевой терапии, проводимой для лечения других типов онкологии.
- Различные вещества, включая гербициды и инсектициды, убивающие сорняки и насекомых, а также химиотерапевтические препараты.
- Возраст: как правило, чем старше человек, тем выше его риски - в большинстве случаев заболевание встречается в возрасте 60+, но некоторые его виды возникают и у молодых людей.
- Сбои в работе иммунной системы - влияют на шансы возникновения всех видом лимфом.
- Некоторые вирусы могут влиять на ДНК лимфоцитов, в которой зашифрована вся информация о нашем теле, и преобразовывать их в онкологические клетки.
- Инфекции, постоянно стимулирующие иммунитет, и вынуждающие нашу естественную защиту работать в усиленном режиме, также повышают риск получения тяжелого диагноза.
- Наличие близких кровных родственников - родителей, детей, братьев или сестер с данным диагнозом также увеличивает вероятность развития заболевания.
- Некоторые исследования показали, что грудные имплантаты, особенно с шероховатой поверхностью, могут спровоцировать возникновение анапластической крупноклеточной лимфомы. Она развивается на коже, в лимфоузлах или рубцовых тканях, образовавшихся в месте разреза.
Симптомы и признаки лимфомы
Как правило, на ранних этапах данный тип онкологии никак себя не проявляет, а ее обладатель хорошо себя чувствует и не подозревает о болезни - почти все ее симптомы появляются позже, на запущенных стадиях.
Один из наиболее частых признаков - появление припухлости на шее, в подмышках, паху или над ключицей, которая представляет из себя увеличенный лимфатический узел. Обычно такое новообразование не болит, но со временем нередко увеличивается, а рядом с ним или в других областях тела появляются новые шишки.
Лимфомы, которые начинают развиваться или разрастаются в брюшной полости, способны вызвать отек или боль в животе, тошноту и рвоту. Такие ощущения возникают из-за укрупнения лимфоузлов или внутренних органов, таких как селезенка или печень, либо скопления большого количества жидкости.
Изменившаяся в размерах селезенка может давить на желудок, вызывая потерю аппетита и чувство сытости после небольшого количества пищи.
Увеличившиеся тимус Тимус, или вилочковая железа - небольшой орган, расположенный за верхней частью грудины перед сердцем. В нем происходит созревание и развитие некоторых лимфоцитов. или лимфоузлы грудной клетки могут оказывать давление на трахею, по которой воздух проходит в легкие. Это приводит к появлению кашля, затруднению дыхания, болевым ощущениям или тяжести в груди.
Поражения головного мозга способны вызывать головную боль, слабость, изменение личности, проблемы с мышлением и судороги.
Другие типы заболевания могут распространяться на окружающие головной и спинной мозг ткани, из-за чего у пациента двоится в глазах, немеет лицо и ухудшается речь.
Лимфомы кожи часто проявляются в виде зудящих красных бугорков или шишек.
Кроме того, симптомами могут быть:
Диагностика лимфомы
Большинство пациентов обращаются к врачу из-за наличия определенных признаков заболевания или плохого самочувствия.
Специалисты начинают обследование с осмотра и опроса - о семейных диагнозах, возможных факторах риска и других проблемах со здоровьем. Затем изучают лимфатические узлы и другие части тела, в которых содержится лимфатическая ткань, включая селезенку и печень. После чего назначают целый ряд исследований:
- Анализы крови: позволяют измерять уровни различных клеток в крови, обнаруживать повреждения костного мозга, оценивать работу почек и печени, а также выявлять инфекции и другие нарушения.
- Биопсия - забор частички подозрительной ткани и передача ее для исследования в лабораторию. В зависимости от течения заболевания, докторам может понадобиться биопсия лимфатических узлов, костного мозга, спинномозговой Спинномозговая жидкость омывает и защищает головной и спинной мозг. , а также плевральной - содержащейся в грудной клетке, или перитонеальной - находящейся в животе жидкости.
- Компьютерная томография, КТ- позволяет выявлять очаги заболевания в брюшной полости, тазу, груди, голове и шее.
- Магнитно-резонансная томография, МРТ - создает подробное изображение мягких тканей. Метод обычно используется для исследования спинного или головного мозга.
- Рентгенограмма - помогает обнаруживать увеличенные лимфатические узлы в области грудной клетки или в костях.
- Ультразвук, УЗИ- используется для изучения увеличенных лимфоузлов или различных органов, таких как печень, селезенка или почки.
- Позитронно-эмиссионная томография, ПЭТ - позволяет выявлять лимфомы в увеличенных лимфоузлах, даже в тех, которые выглядят нормальными на КТ. Кроме того, с ее помощью можно определить, поддается ли заболевание лечению.
В онкологическом центре «Лапино-2» проводится полная диагностика лимфомы - быстро, без очередей и потерь драгоценного времени, на самом современном оборудовании.
Наши специалисты ведут пациента «от» и «до» - от обследования до проведения любого лечения.
Стадии лимфомы
Сразу после обнаружения заболевания врачи определяют его стадию - выясняют, как далеко оно успело распространиться и какие ткани повредило. Данная информация крайне важна для специалистов, поскольку она позволяет не только понимать прогнозы пациента, но и подбирать для него самое подходящее лечение.
Стадии лимфомы Ходжкина:
I: измененные клетки обнаружены только в одной группе лимфатических узлов или одном лимфоидном органе, таком как миндалины.
II: они присутствуют в 2 или более группах лимфоузлов, расположенных по одну сторону от диафрагмы Диафрагма - это мышца, которая отделяет грудную полость от брюшной. , либо распространились из одного поврежденного лимфоузла на соседний орган.
III: клетки лимфомы есть в лимфоузлах по обе стороны диафрагмы; либо не только в лимфатических узлах над диафрагмой, но и в селезенке.
IV: заболевание распространилось по крайней мере в один орган, не входящий в лимфатическую систему, такой как печень, костный мозг или легкие.
Стадии неходжкинских лимфом:
I: измененные клетки обнаруживаются только в 1 группе лимфатических узлов или одном лимфоидном органе, например, миндалинах; либо в 1 области одного органа за пределами лимфатической системы.
II: они присутствуют в 2 или более группах лимфоузлов по 1 сторону от диафрагмы; либо в лимфатических узлах и 1 области расположенного рядом одного органа, или в еще одной группе лимфоузлов на той же стороне диафрагмы.
III: клетки лимфомы есть в лимфоузлах по обе стороны от диафрагмы; либо они присутствуют и в лимфатических узлах над диафрагмой, и в селезенке.
IV: заболевание распространилось по крайней мере в один орган, не входящий в лимфатическую систему, такой как печень, костный мозг или легкие.

Лечение лимфомы
Лечение лимфомы - задача непростая. Для ее решения требуется не один доктор, а целая команда профессионалов своего дела - химиотерапевта, радиолога, хирурга, онколога, гематолога и других.
В онкологическом центре «Лапино-2» есть все необходимые специалисты - врачи мирового уровня, которые проводят полную диагностику заболевания и любую необходимую терапию.
У нас вам не придется пересдавать анализы, переделывать исследования и задаваться вопросом «что делать дальше?». Мы полностью ведем пациента и даем ему четкий план действий, следуя которому он получает лучший результат из возможных.
Для борьбы с данным типом онкологии применяется несколько методов:
Основным из них является химиотерапия - препараты, которые уничтожают измененные клетки. Они принимаются в виде таблеток или вводятся в вену, попадают в кровоток и распространяются по всему телу. Лечение проводится циклами, каждый из которых длится несколько недель, после чего следует период отдыха, за время которого организм восстанавливается.
Трансплантация костного мозга или стволовых клеток, из которых образуются клетки крови. Процедура позволяет назначать более высокие дозы химиотерапии, иногда вместе с лучевой терапией, благодаря чему лимфома уничтожается эффективнее. Пересадка возможна не только донорского, но и своего собственного, собранного за несколько недель до вмешательства материала.
Лучевая терапия - уничтожение измененных клеток с помощью радиации. Данный метод подходит для большинства пациентов, и особенно хорошо работает, если заболевание успело поразить небольшое количество тканей. Его применяют как самостоятельно, так и в сочетании с химиотерапией.
Иммунотерапия - препараты, которые помогают собственной иммунной системе человека лучше распознавать и разрушать неправильные клетки. Существует несколько их типов, применяемых при лимфомах. К ним относят:
- моноклональные антитела - белки, разработанные для атаки определенного вещества на поверхности лимфоцитов;
- ингибиторы иммунных контрольных точек - лекарства, не позволяющие измененным клеткам маскироваться под здоровые;
- Т-клеточная терапия: изъятие из крови пациента и изменение в лаборатории иммунных клеток, их размножение и возвращение в организм, где они отыскивают и уничтожают очаги заболевания.
Хирургия: часто используется для получения образцов подозрительных тканей и определения их типа, но редко - для терапии как таковой. В редких случаях операции назначаются при поражениях селезенки или других органов, которые не входят в лимфатическую систему - например, щитовидная железа или желудок.

Прогнозы и продолжительность жизни при лимфоме
Перспективы каждого человека индивидуальны - они зависят от множества различных факторов, таких как тип заболевания, его стадия, ответ на лечение, возраст и общее состояние здоровья.
Наличие некоторых из них говорит о менее благоприятных прогнозах:
- повышенная температура, ночная потливость и снижение веса;
- высокая СОЭ - скорость оседания эритроцитов Эритроциты - это клетки крови, которые доставляют кислород к тканям и органам. - от 50 у людей с вышеперечисленными симптомами, и более 30 у всех остальных;
- возраст старше 45 лет;
- мужской пол;
- высокий уровень лейкоцитов Лейкоциты - это клетки крови, основной задачей которых является борьба с инфекциями. - более 15 тысяч;
- уровень гемоглобина Гемоглобин - это белок клеток крови, переносящий по телу железо. Он удерживает кислород, необходимый для работы всех тканей. ниже 10,5;
- низкий уровень альбумина Альбумин - это белок крови, который переносит различные химические соединения и участвует в обмене веществ. в крови - менее 4.
Для составления примерных прогнозов врачи используют специальный термин - «пятилетняя выживаемость». Это статистический показатель, который ничего не говорит о шансах конкретного человека. Он показывает только количество людей с определенным типом заболевания на конкретной стадии, остающихся в живых спустя 5 или более лет с момента постановки диагноза.
У пациентов с лимфомой Ходжкина эта цифра выглядит следующим образом:
- На локализованном этапе, пока онкология присутствует только в одной группе лимфатических узлов, в одном лимфоидным органе или ткани за пределами лимфатической системы - она составляет примерно 91%.
- На региональном, при повреждении расположенных рядом с лимфоузлами структур, двух или более групп лимфатических узло, находящихся по одну сторону от диафрагмы - около 94%.
- При распространении заболевания на другие части тела, такие как легкие, печень или костный мозг, либо на лимфоузлы ниже и выше диафрагмы - 81%.
Для пациентов с различными видами неходжкинских лимфом - диффузной В-крупноклеточной Диффузная В-крупноклеточная лимфома - это целая группа опухолей лимфатической системы, которая развивается из В-клеток вилочковой железы, или тимуса. и фолликулярной Фолликулярная лимфома - самая распространенная из медленно растущих типов заболевания, она составляет 20-30% от всех впервые диагностированных неходжкинских лимфом. она составляет 73% и 96%, 73% и 90%, 57% и 85% соответственно.
Читайте также:
