Малые ядерные РНК (UмяРНК) и малые ядерные рибонуклеопротеидные частицы (мяРНП)
Обновлено: 18.05.2024
Кэпированиепредставляет собой образование на 5'-конце мРНК особой структуры — кэпа (шапочки). Кэпирование происходит еще до полного завершения транскрипции и защищает 5'-конец РНК от действия нуклеаз. Кэпирование РНК осуществляется с участием GTP(гуанозинтрифосфата), из состава которого GMP переносится на 5'-дифосфат первого нуклеотида мРНК.
Полиаденилирование осуществляется, ферментом поли(А)-полимеразой и приводит к образованию на З'-конце олиго(А)-фрагмента, содержащего 100 — 200 остатков адениловой кислоты подряд и называемого также «поли(А)-хвостом». Эта поли (А)-последовательность добавляется к РНК после присоединения кэпа. Сначала 3'-конец РНК отщепляется ферментами в точке, отстоящей на 10-35 рибонуклеотидов от консервативной последовательности ААUААА, а затем происходит полиаденилирование этого конца молекулы РНК. Поли(А)-хвост находят практически у всех мРНКэукариотических ороганизмов, за исключением транскриптов гистоновых генов. Последовательность ААUААА встречается не во всех эукариотических РНК-транскриптах. По-видимому, это связано с мутациями, препятствующими полиаденилированию. В отсутствие 3'- хвоста РНК-транскрипты быстро деградируют под действием ферментов.
Т.о. 5'-кэп и 3'-хвост чрезвычайно важны для дальнейшего процессинга и транспортировки мРНК в цитоплазму. Поли(А)-хвост определяет стабильность мРНК и время ее жизни в клетке. Кроме того, способствует выходу мРНК из ядра в цитоплазму, а также существенен для регуляции трансляции.
Механизмы сплайсинга: автокатализ РНК (Клаг,400)
Для разных типов ядерной РНК, а также для РНК мтх и хлп существуют свои собственные механизмы сплайсинга.
В зависимости от специфичности механизма сплайсинга, интроны можно разделить на несколько групп. К первой группе относятся интроны, входящие в состав первичного рРНК-транскрипта, для удаления которых не требуется дополнительных компонентов. Эти интроны сами обладают ферментативной активностью, необходимой для их вырезания. Впервые этот факт был обнаружен в 1982 г (Томас Чех с сотр.) у жгутикового простейшего тетрахимены (Tetrachymena). Из-за автокаталитических свойств самосплайсирующиеся РНК иногда называют рибозимами.
Процесс самовырезания (автоэсцизия) (рис. 145_Коничев)

(рис.12-12, Клаг) представляет собой две нуклеофильные реакции, или реакции трансэтерификации, в которых гуанозин взаимодействует с первичным итранскриптом и действует как кофактор. При этом З'-гидроксильная группа гуанозина переносится на нуклеотид, примыкающий к 5'-концу интрона. Во второй реакции эта гидроксильная группа взаимодействуетс фосфатной группой на З'-конце правого интрона, в результате интрон вырезается, а концы двух соседних экзонов соединяются с образованием зрелой мРНК.
Интрон 26S рРНК тетрахимены — IVS, состоит из 413 нуклеотидов. В результате реакции трансэтерификации без дополнительных затрат энергии осуществляется лигирование двух экзонов с образованием зрелой 26S рРНК. Вырезанный интрон затем циклизуется. Из его состава путем двухэтапного ауторасщепления освобождается фрагмент, содержащий 19 нуклеотидов, в результате чего образуя РНК длиной 376 нуклеотидов (L -19 IVS), которая и представляет собой истинный РНК-фермент (рибозим), обладающий каталитическими свойствами. Этот рибозим обладает устойчивой структурой, имеет эндонуклеазную активность, расщепляя длинные одноцепочечные РНК, и проявляет специфичность, распознавая в о составе атакуемого субстрата тетрануклеотиды CUCU . В структуре интронов типа I выявлены характерные внутренние олигопуриновые последовательности (у тетрахимены это последовательность GGAGGG), называемые адапторными последовательностями, которые участвуют в образовании активного центра РНК-ферментов и выполняют важнейшую роль в каталитическом расщеплении РНК.
Такое самовырезание интронов характерно для пре-рРНК других простейших. Этот механизм , по-видимому, действует и при удалении интронов из первичных транскриптов иРНК и тРНК в митохондриях и хлоропластах, которые относятся к группе II.
Для вырезания интроноввторой группытакже необходимы две автокаталитические реакции, но гуанозин не требуется.
Дальнейшие исследования позволили установить, что каталитической активностью обладают не только крупные РНК (~400 нуклеотидов у тетрахимены и РНКазы Р), но и короткие 13 —20-членные олигонуклеотиды, которые могут быть синтезированы in vitro. Такие рибозимы стали называть минизимами. Одна из детально исследованных моделей функционирования таких рибозимов получила название «головка молотка» (рис. 146). Третичная структура «головки молотка» стабилизируется ионами двухвалентных металлов, которые нейтрализуют отрицательно заряженные атомы кислорода фосфодиэфирных связей и одновременно соединяют фосфатные группы ковалентными связями, что существенно для образования стабильного переходного состояния (фермент-субстратного комплекса). Как и в случае катализа, осуществляемого ферментами белковой природы, рибозимы и атакуемый субстрат
(природные или синтетически полученные молекулы РНК) образуют фермент-субстратный комплекс, а затем — фермент-продуктный комплекс (см. рис. 146).
Механизмы сплайсинга: сплайсосома. (Процессинг мРНК у эукариот)
В ядерных пре-мРНК интроны могут достигать в длину 20 000 нуклеотидов. Поэтому их удаление требует более сложного механизма, чем самовырезание (автоэксцизия). (рис.12-13). Нуклеотидные последовательности на концах интронов в этих молекулах сходны: на 5'-концах часто находится динуклеотид (GU)ГУ, а на З'-конце - динуклеотид (AG)АГ. C этими последовательностями связываются молекулы специальных белков, которые формируют комплекс, называемый сплайсомой. Основной компонент сплайсосом - малые ядерные рибонуклеопротеины, или мяРНП, которые найдены только в ядре и обогащены остатками уридина. Поэтому малые ядРНК часто обозначают U1, U2 …U6.
[Коничев, с.292.В сплайсинге пре-мРНК
у высших эукариот задействован ряд белков, а также РНК особого вида - малые ядерные РНК (мяРНК). Малые ядерные РНК имеют последовательности протяженностью от 65 до 1000 и более нуклеотидов (10S —90S), богатые уридиловыми нуклеотидами, и поэтому называются также uPHK (Ul, U2 и т.д.). У дрожжей выявлено 25 различных мяРНК, у позвоночных животных — 15. У шпорцевых лягушек Xenopus laevis ряд мяРНК (U3, U8, U14 и U22) участвуют в процессинге рибосомальных РНК, связываясь с пограничными участками спейсерных последовательностей (см. рис. 143). Малые ядерные РНК выявлены не только у позвоночных животных и дрожжей, но также у насекомых и архибактерий. Они представляют собой, вероятно, очень древнюю группу молекул. Нуклеотидная последовательность всех соответствующих uPHK
эукариот совпадает более чем на 90 %, что, в частности, относится к U1 человека и дрозофилы. Высокий консерватизм структуры uPHK говорит о том, что сплайсинг представляет собой очень древний процесс, начавшийся с аутосплайсинга (см. выше) и трансформировавшийся в сплайсинг с участием особых рибонуклеопротеидных частиц — мяРНП. Гены мяРНК транскрибируются РНК-полимеразой II и имеют различную локализацию в геноме: часть из них представляет собой дискретные независимые гены,
не имеющие интронов, тогда как гены других мяРНК располагаются внутри интронов генов, кодирующих белки. Так, у Xenopus U13 кодируется тремя уникальными последовательностями, находящимися
в интронах 5, 6 и 8 генов белков теплового шока, а ген U16 находится внутри интрона рибосомального белка L1. Последнее обстоятельство имеет важное значение, так как показывает, что процессинг рРНК и процессинг мРНК белков рибосом может быть скоординирован при участии мяРНК. Кроме того,
предполагают, что мяРНК способны служить РНК-шаперонами, участвуя в фолдингерРНК, т.е. помогая ей принять необходимую структуру в пространстве. Малые ядерные РНК присутствуют в ядрах в комплексах с белками, получившими название малыерибонуклеопротеиновые частицы (мяРНП). Стабильным компонентом мяРНП является белок фибрилларин — очень консервативный по структуре белок с молекулярной массой 34 кДа, локализованный в ядрышках. Комплекс, состоящий из множества мяРНП, который катализирует сплайсинг ядерных про-мРНК, носит название сплайсингосомы.]
Известно, мяРНК типа U1, содержит нуклеотидную последовательность, гомологичную 5'-концу интрона. Спаривание этих последовательностей дает начало сплайсоме. Затем к ней присоединяется мяРНК типа U2, U4, U5 и U6 начинается сплайсинг. Как и в случае интронов первой группы происходит две реакции трансэтерификации. Сначала З'- гидроксильная группа аденина (А), локализованного в интроне, взаимодействует с 5'-сайтом сплайсинга, разрезая цепь РНК. Затем несколько мяРНП формируют промежуточный комплекс и начинается вторая реакция: свободный 5'-конец интрона соединяется с остатком аденина. В результате формируется характерная петлеобразная структура типа лассо, содержащая удаленный интрон. Затем концы экзонов лигируют и комплекс мяРНК освобождает транскрипт.
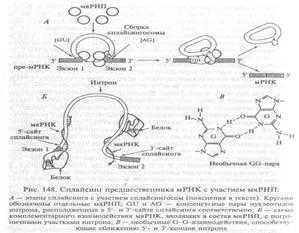
[ Коничев, с.294. Взаимодействие разных мяРНК, входящих в состав сплайсингосомы, со сплайсируемой пре-мРНК в 5'- и З'-сайтах сообщает интрону петлеобразную структуру. При этом сближаются концы экзонов, чему способствует образование неканонических (отличающихся от уотсон-криковских пар) водородных связей между двумя гуанинами, содержащимися в 5'- и З'-сайтах сплайсинга (см. рис. 148). Сближение экзонов создает условие для атаки З'-конца интрона адениловым нуклеотидом, расположенным вблизи З'-конца. В результате разрыва фосфодиэфирной связи между экзоном 1 и 5'-концом интрона последний взаимодействует с адениловым нуклеотидом и образованием в интроне петли типа «лассо» (см. рис. 148_Коничев). Вслед за этим освободившийся З'-ОН-конец экзона 1 разрезает З'-сайт сплайсинга, выщепляет интрон и, соединяясь с экзоном 2, образует в итоге зрелую (сплайсированную) молекулу мРНК]
Это важно знать:
Коммуникационный процесс Связующие процессы Коммуникация - это процесс обмена информацией, опытом и сведениями.
Порядок движения документов в организации Главным правилом организации документооборота является оперативное движение документа по кратчайшему пути с меньшими затратами.
Электромагнитный момент и механические характеристики асинхронного двигателя Электромагнитный момент асинхронного двигателя создается взаимодействием тока в обмотке ротора с вращающимся магнитным полем.
Февральская революция 1917 : причины, основные события, итоги. Двоевластие:особенности и последствия Начало революции 23 февраля 1917г. Свершилась в Петрограде. В результате которой.
Схема беседы в психологическом консультировании 1. Беседа — основная форма осуществления психологического консультирования. Главное отличие консультационной беседы от.
Биология и медицина
snRNP (snurps, Малые ядерные рибонуклеопротеины, мяРНП)
snRNP (snurps, малые ядерные рибонуклеопротеины) - комплекс малых ядерных РНК (snRNA) с белками. Размер этих комплексов обычно порядка 250 нуклеотидов или менее. В ядре много таких комплексов белков с малыми РНК - U1, U2, . U12 РНК. Эти комплексы (молекулярная масса которых равна 250000) содержат набор белков, при этом некоторые белки присутствуют в нескольких типах snRNP, тогда как другие - только в одном типе snRN. Так, U1 , U2 , U5 и U4/U6 snRNP содержат общие белки.
Полагают, что индивидуальные snRNP узнают специфические последовательности нуклеиновых кислот за счет спаривания оснований РНК- РНК. Один из snRNP участвует в реакции расщепления, генерирующей 3'-концы новообразуемых гистоновых мРНК; некоторые snRNP участвуют в сплайсинге РНК. Например, U1 snRNP связывается с 5'-сайтом сплайсинга за счет нуклеотидной последовательности U1 РНК, которая комплементарно спаривается с девятинуклеотидной консенсусной последовательностью 5'-сайта сплайсинга.
Процессинг мРНК у эукариот
Посттранскрипционные модификации пре-мРНК особенно существенны для эукариот, что связано с мозаичным строением их генов, содержащих некодирующие последовательности — интроны. Число интронов в генах эукариот может достигать нескольких десятков, что диктует необходимость существования четкой системы сплайсинга первичных транскриптов. В сплайсинге пре-мРНК у высших эукариот задействован ряд белков, а также РНК особого вида —малые ядерные РНК (мяРНК). Малые ядерные РНК имеют последовательности протяженностью от 65 до 1000 и более нуклеотидов (10S—90S), богатые уридиловыми нуклеотидами, и поэтому называются также uPHK (Ul, U2 и т. д.). У дрожжей выявлено 25 различных мяРНК, у позвоночных животных — 15. У шпорцевых лягушек Xenopus laevis ряд мяРНК (U3, U8, U14 и U22) участвуют в процессинге рибосомальных РНК, связываясь с пограничными участками спейсерных последовательностей (см. рис. 10.3). Малые ядерные РНК выявлены не только у позвоночных животных и дрожжей, но также у насекомых и архибактерий. Они представляют собой, вероятно, очень древнюю группу молекул. Нуклеотидная последовательность всех соответствующих иРНК эукариот совпадает более чем на 90 %, что, в частности, относится к Ш человека и дрозофилы. Высокий консерватизм структуры иРНК говорит о том, что сплайсинг представляет собой очень древний процесс, начавшийся с аутосплайсинга (см. выше) и трансформировавшийся в сплайсинг с участием особых рибонуклеопротеидных частиц — мяРНП. Гены мяРНК транскрибируются РНК-полимеразой II и имеют различную локализацию в геноме: часть из них представляет собой дискретные независимые гены, не имеющие интронов. тогда как гены других мяРНК располагаются внутри интронов генов, кодирующих белки. Так, у Xenopus ШЗ кодируется тремя уникальными последовательностями, находящимися в интронах 5, 6 и 8 генов белков теплового шока, а ген U16 находится внутри интрона рибосомального белка L1. Последнее обстоятельство имеет важное значение, так как показывает, что процессинг рРНК и процессинг мРНК белков рибосом может быть скоординирован при участии мяРНК. Кроме того, предполагают, что мяРНК способны служить РНК-шаперонами, участвуя в фолдинге рРНК, т. е. помогая ей принять необходимую структуру в пространстве.
Малые ядерные РНК присутствуют в ядрах в комплексах с белками, получившими название малые рибонуклеопротеиновые частицы (мяРНП). Стабильным компонентом мяРНП является белок фибрилларин — очень консервативный по структуре белок с молекулярной массой 34 кДа, локализованный в ядрышках. Комплекс, состоящий из множества мяРНП, который катализирует сплайсинг ядерных про-мРНК, носит название сплайсингосомы. Сплайсинго- сома собирается на интроне перед его выщеплением и содержит несколько различных мяРНП. У млекопитающих мяРНП сплайсин- госом всегда содержат РНК Ш, U2, U4, U5 и U6. Сплайсингосомы — элипсовидные частицы размером 25 х 50 мкм, имеют коэффициент седиментации 50—60S. Малые ядерные РНП собираются в сплайсингосомы в определенной последовательности.
Различные мяРНК по комплементарному принципу связываются с пограничными участками интронов в сплайсируемой РНК (рис. 10.10). Для этого взаимодействия существенны короткие консенсусные последовательности интронов: GU — на 5'-конце и AG — на З'-конце. Точечные мутации в этих последовательностях ведут к нарушению сплайсинга и прекращению синтеза соответствующих белков. Подобные мутации в генах глобина человека ведут к анемии. Консенсусные последовательности 5'- и З'-сайтов сплайсинга имеют следующий вид:
Взаимодействие разных мяРНК, входящих в состав сплайсинго- сомы, со сплайсируемой пре-мРНК в 5'- и З'-сайтах сообщает нитрону петлеобразную структуру. При этом сближаются концы экзонов, чему способствует образование неканонических (отличающихся от уотсон-криковских пар) водородных связей между двумя гуанинами, содержащимися в 5'- и З'-сайтах сплайсинга (см. рис. 10.8). Сближение экзонов создает условие для атаки 5'-конца интрона аде- ниловым нуклеотидом, расположенным вблизи З'-конца. В результате разрыва фосфодиэфирной связи между экзоном I и 5'-концом интрона последний взаимодействует с адениловым нуклеотидом

Рис. 10.8. Сплайсинг предшественника мРНК с участием мяРНП:
а — этапы сплайсинга с участием сплайсингосом. Пояснения см. в тексте. Кругами обозначены отдельные мяРНП; GU и AG — консенсусные пары нуклеотидов интрона, расположенные в 5'- и З'-сайте сплайсинга соответственно; б — схема комплементарного взаимодействия мяРНК, входящих в состав мяРНП, с пограничными участками интрона; в — необычные G-G-взаимодействия, способствующие сближению 5'- и З'-конпов интрона и образованием в интроне петли типа «лассо» (см. рис. 10.8). Вслед за этим освободившийся З'-ОН-конец экзона 1 разрезает З'-сайт сплайсинга, выщепляет интрон и, соединяясь с экзоном 2, образует в итоге зрелую (сплайсированную) молекулу мРНК.
Полагают, что сплайсинг, катализируемый сплайсингосомами, возник из аутосплайсинга. Об этом свидетельствует сходство последовательности реакций, приводящих к вырезанию интронов: образование петлеобразной структуры в результате сближения двух эк- зонов; высвобождение 5'-конца интрона (под действием активного гуанилового нуклеотида в сплайсинге интронов типа 1, и то же — под действием аденилового нуклеотида в сплайсинге интронов типа II); атака высвободившегося 5'-конца экзона фосфодиэфирной связи в З'-сайте сплайсинга; высвобождение З'-конца интрона и его существование в петлеобразной форме. С учетом широко распространенного мнения о том, что РНК представляла собой главный биополимер в первобытных клетках, сплайсинг в этих клетках, вероятно, катализировался РНК-ферментами, а некоторые самосплай- сируюшие интроны сохранились и до настоящего времени (как, например, интроны рРНК тетрахимены). На более поздних ступенях эволюции большинство клеток утратили способность к аутосплайсингу и функции рибозимов перешли к отдельным компонентам сплайсингосом.
Альтернативный сплайсинг. Несколько интронов, содержащихся в мРНК, могут сшиваться в разных комбинациях с образованием различных матричных последовательностей. Такая дифференциация путей созревания мРНК получила название альтернативного сплайсинга. Этот сплайсинг был впервые открыт у аденовирусов, у которых часть кодирующих последовательностей удаляется подобно нитронам, а 5'-кэп соединяется с любым из других экзонов, и, таким образом, образуются различные мРНК, кодирующие разные белки (рис. 10.9). Этот вид сплайсинга позволяет небольшому числу первичных вирусных транскриптов кодировать значительное количество белков, в пропорциях, необходимых для существования вируса.
У эукариот альтернативный сплайсинг мРНК, содержащих большое количество интронов, является эффективным способом регуляции активности генов, создает возможность для возникновения изоформ белков (см. тему 2), наборы которых могут существенно различаться в различных клетках, тканях и органах многоклеточных организмов. Альтернативный сплайсинг позволяет организму синтезировать разные по структуре и свойствам белки на базе одного гена. Такие гены кодируют семейства родственных белков, участвующих в мышечных сокращениях, формировании цитоскелета, нервных волокон, молекул иммуноглобулинов, пептидных гормонов и т. д.

Рис. 10.9. Три различные мРНК, возникающие из одной молекулы-предшественника у аденовирусов (по Б. Албертсу и др., 1994). Пояснения см. в тексте
В формировании альтернативных мРНК могут быть задействованы три основных механизма. Первый из них состоит в том, что для образования различных мРНК могут использоваться разные промоторы. В этом случае образуются транскрипты, имеющие разные по длине 5'-концы и разное количество экзонов. Такой механизм сплайсинга выявлен для пре-мРНК легкой цепи миозина позвоночных животных.
Второй тип альтернативного сплайсинга имеет место при изменении сайта полиаденилирования первичного транскрипта. В этом случае изменяются размеры и структура З'-концевого участка пре- мРНК (рис. 10.10). Таким способом образуются два вида мРНК тяжелой цепи иммуноглобулинов.
Третий тип альтернативного сплайсинга включает выбор различных экзонов из одинаковых пре-мРНК. При этом для формирования зрелых РНК могут использоваться различные экзоны, а часть из них не включается в сплайсинг. Таким образом происходит сплайсинг пре-мРНК тропонина Т скелетных мышц млекопитающих, содержащий 18 экзонов. При этом выбор экзонов зависит от стадии

Рис. 10.10. Типы альтернативного сплайсинга пре-мРНК:
а — альтернативные промоторы (тип I); б —альтернативные сайты полиаденилирования (тип II); в — выбор различных экзонов (тип III). Темные участки — экзоны, светлые — интроны; сплошными и пунктирными линиями соединены 5'- и З'-сайты сплайсинга в зависимости от того, имеет ли пре- мРНК разные 5'-концы, разные З'-концы или одинаковые 5'- и З'-концы
развития организма: экзон 16 присутствует в мРНК тропонина Т у взрослых, а экзон 17 — в мРНК этого белка у эмбрионов. Тонкие механизмы выбора сайта сплайсинга еше неизвестны. Однако одной из причин возникновения альтернативных продуктов могут служить мутации, приводящие к разрушению нормальных сайтов сплайсинга и возникновению новых сайтов (рис. 10.11). Такой механизм альтернативного сплайсинга выявлен у больных тапассеми- ей (группа наследственных заболеваний, при которых резко падает содержание гемоглобина). Потеря в результате мутации одного из сайтов сплайсинга еще не означает отмену сплайсинга в целом, так как оставшийся другой сайт «ищет» подходящий участок и может соединяться с таким скрытым, ранее не реализовавшимся сайтом сплайсинга с образованием новой мРНК. Таким образом, мутации в мозаичных генах эукариот могут стимулировать образование новых белков, а альтернативный сплайсинг может играть решающую роль в эволюции высших организмов.
Процесс созревания РНК, кроме вышеохарактеризованных сплайсинга, копирования и полиаденилирования, включает еще ряд модификаций первичной структуры, называемых редактированием РНК. К этим реакциям относятся модификации азотистых оснований (дезаминирование, метилирование, восстановление и др.), в результате которых образуются необычные для РНК минорные основания (инозин, тимин, дегидроурацил и др.). К редактированию относятся и вставки нуклеотидов (чаще всего уридиловых) внутрь транскрибированной цепи РНК. Несмотря на то, что ферментативный аппарат редактирования мало изучен, очевидно, что этот процесс может быть очень важен для коррекции информационного значения кодонов мРНК, а следовательно, и для первичной структуры кодируемых ими белков. В результате трансляции таких «отредактированных» РНК в клетке могут синтезироваться белки, аминокислотная последовательность которых будет не вполне соответствовать нуклеотидной последовательности ДНК матрицы (гена).

Рис. 10.11. Аномальный процессинг мРНК р-глобина у больных талассемией:
а — первичный транскрипт мРНК нормального (3-глобина (зрелая мРНК состоит из трех экзонов); б — мутация, приводящая к появлению нового сайта сплайсинга и удлинению экзона 2; в — мутация, приводящая к появлению дополнительного экзона между экзонами 2 и 3. Мутантные сайты обозначены стрелками. Темные участки — экзоны, светлые — интроны; заштрихованные участки — новые последовательности нуклеотидов, которые включаются в зрелую мРНК в результате мутации; линии соединяют 5'- и З'-сайты сплайсинга
Ярким примером редактирования мРНК является редактирование мРНК апопротеина В (Апо-В) — липопротеина, участвующего в транспортировке жиров и клеток печени и тонкого кишечника в кровь. В печени в результате транскрипции образуется мРНК, служащая для синтеза белка, состоящего из 4563 аминокислотных остатков. Аналогичная мРНК в клетках тонкого кишечника редактируется таким образом, что в одном из кодонов, кодирующих глутамин (кодон САА), происходит дезаминирование цитозина, в результате чего цитозин превращается в урацил и возникает терминирующий кодон UAA. Этот кодон прекращает трансляцию мРНК в середине ее молекулы, и поэтому в тонком кишечнике синтезируется укороченный белок, состоящий из 2152 аминокислотных остатков (рис. 10.12).
Синтезированная в ядрах эукариотических клеток гетерогенная ядерная РНК (гяРНК) сразу после синтеза связывается с белками и образует гяРНП-частицы. В состав гяРНП-частиц входит не менее восьми разных белков. Все эти РНК-связывающие белки содержат в своем составе высококонсервативную последовательность: NH2. Lys (Arg) -Gly-Phe (Туг) - Ala (Gly) -Phe (Tyr) -Val-X-Phe (Tyr). COOH. Гете - рогенная ядерная РНК, открытая О. П. Самариной и Г. П. Георгиевым в 1960 г., представляет собой пре-мРНК, названную авторами ДНК-подобной РНК (дРНК). Дальнейшие работы в области изучения структуры гяРНК показали, что высокомолекулярные предшественники мРНК в ядрах ассоциированы с глобулярными белковыми частицами — информоферами, т. е. носителями информационной РНК.

Рис. 10.12. Редактирование мРНК апопротеина В
В гене апопротеина показан триплет (САА) на нематричной цепи ДНК. Остальные пояснении см. в тексте
На каждый информофер накручивается отрезок РНК длиной —600 нуклеотидов, и образуется мономерная частица с коэффициентом седиментации 30S. При этом происходит частичное «плавление» вторичной структуры РНК. На протяжении всего периода, пока гяРНК находится в ядре, она, вероятно, находится в комплексе с информоферами. Отдельные этапы процессинга, вероятно, требуют изменения структуры гяРНП. В процессе выхода процессированной мРНК из ядра в цитоплазму она теряет связь с информоферами, связывается с другими белками и присутствует в цитоплазме в виде информосом — цитоплазматических РНП-частиц, открытых в лаборатории А. С. Спирина в 1964 г. Эта форма существования мРНК имеет прямое отношение к регуляции трансляции (биосинтеза белка) в рибосомальном аппарате клеток.
Малые ядерные РНК
Малые ядерные РНК (мяРНК, snRNA) — класс РНК, которые встречаются в ядре эукариотических клеток. Они транскрибируются РНК-полимеразой II или РНК-полимеразой III и участвуют в важных процессах, таких как сплайсинг (удаление интронов из незрелой мРНК), регуляции факторов транскрипции (7SK РНК) или РНК-полимеразы (B2 РНК) и поддержании целостности теломер.
Малые ядерные РНК всегда ассоциированы со специфическими белками, комплексы мяРНК с белками называются малые ядерные рибонуклеопротеины (мяРНП). Малые ядерные РНК содержат большое число уридиновых нуклеотидов.
Важной группой мяРНК являются малые ядрышковые РНК (snoRNA), участвующие в процессинге рРНК, тРНК и собственно мяРНК.
монофосфаты (АМФ • ГМФ • UMP • ЦМФ) • дифосфаты (АДФ • ГДФ • УДФ • ЦДФ) • трифосфаты (АТФ • ГТФ • УТФ • ЦТФ) • циклические (цАМФ • цГМФ • cADPR)
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Малые ядерные РНК" в других словарях:
малые ядерные РНК класса U — Группа ассоциированных с белками небольших (от 60 до 400 нуклеотидов) молекул РНК, составляющих значительную часть содержимого сплайсом и участвующих в процессе вырезания интронов; у 4 из 5 хорошо изученных типов Usn РНК U1, U2, U4 и U5 на 5… … Справочник технического переводчика
малые ядерные РНК snurps класса U — Usn RNAs малые ядерные РНК класса U. Группа ассоциированных с белками небольших (от 60 до 400 нуклеотидов) молекул РНК, составляющих значительную часть содержимого сплайсом и участвующих в процессе вырезания… … Молекулярная биология и генетика. Толковый словарь.
малые ядерные РНК — snurps, small nuclear RNA малые ядерные (низкомолекулярные ядерные) РНК. Обширная группа (105 106) ядерных РНК небольшого размера (100 300 нуклеотидов), ассоциированная с гетерогенной ядерной РНК , входят в состав … Молекулярная биология и генетика. Толковый словарь.
Малые интерферирующие РНК — или короткие интерферирующие РНК (англ. siRNA, small interfering RNA) это класс двухцепочечных РНК, длиной 20 25 нуклеотидов. Малые интерферирующие РНК принимают участие в процессах РНК интерференции (англ. RNAi), понижая… … Википедия
Малые ядрышковые РНК — (мякРНК, англ. snoRNA) класс малых РНК, участвующих в химических модификациях (метилировании и псевдоуридилировании) рибосомных РНК, а также тРНК и малых ядерных РНК. По классификации MeSH малые ядрышковые РНК считаются подгруппой… … Википедия
малые ядерные (низкомолекулярные ядерные) РНК — Обширная группа (105 106) ядерных РНК небольшого размера (100 300 нуклеотидов), ассоциированная с гетерогенной ядерной РНК, входят в состав мелких рибонуклеопротеиновых гранул ядра; М.я.РНК являются необходимым компонентом системы сплайсинга… … Справочник технического переводчика
низкомолекулярные ядерные РНК — низкомолекулярные ядерные РНК. См. малые ядерные РНК. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
Малые РНК, образующие шпильки — Малые РНК, образующие шпильки, или короткие РНК, образующие шпильки (shRNA short hairpin RNA, small hairpin RNA) молекулы коротких РНК, образующие во вторичной структуре плотные шпильки. ShRNA могут быть использованы для выключения экспрессии… … Википедия
РНК — Пре мРНК со стеблем петлёй. Атомы азота в основаниях выделены голубым, кислорода в фосфатном остове молекулы красным Рибонуклеиновые кислоты (РНК) нуклеиновые кислоты, полимеры нуклеотидов, в состав которых входят остаток ортофосфорной кислоты … Википедия
РНК (биология) — Пре мРНК со стеблем петлёй. Атомы азота в основаниях выделены голубым, кислорода в фосфатном остове молекулы красным Рибонуклеиновые кислоты (РНК) нуклеиновые кислоты, полимеры нуклеотидов, в состав которых входят остаток ортофосфорной кислоты … Википедия
Нуклеопротеиды
Нуклеопротеиды — комплексы нуклеиновых кислот с белками.
К нуклеопротеидам относятся устойчивые комплексы нуклеиновых кислот с белками, длительное время существующие в клетке в составе органелл или структурных элементов клетки в отличие от разнообразных короткоживущих промежуточных комплексов белок — нуклеиновая кислота (комплексы нуклеиновых кислот с ферментами — синтетазами и гидролазами — при синтезе и деградации нуклеиновых кислот, комплексы нуклеиновых кислот с регуляторными белками и т. п.).
Содержание
Структура и устойчивость

В зависимости от типа входящих в состав нуклеопротеидных комплексов нуклеиновых кислот различают рибонуклеопротеиды и дезоксирибонуклеопротеиды.
Устойчивость нуклеопротеидных комплексов обеспечивается нековалентным взаимодействием. У различных нуклеопротеидов в обеспечение стабильности комплекса вносят вклад различные типы взаимодействий, при этом нуклеиново-белковые взаимодействия могут быть специфичными и неспецифичными. В случае специфичного взаимодействия определённый участок белка связан со специфичной (комплементарной участку) нуклеотидной последовательностью, в этом случае вклад водородных связей, образующихся между нуклеотидными и аминокислотными остатками благодаря пространственному взаимному соответствию фрагментов, максимален. В случае неспецифичного взаимодействия основной вклад в стабильность комплекса вносит электростатическое взаимодействие отрицательно заряженных фосфатных групп полианиона нуклеиновой кислоты с положительно заряженными аминокислотными остатками белка.
Примером специфичного взаимодействия могут служить нуклеопротеидные комплексы рРНК — субъединицы рибосом; неспецифичное электростатическое взаимодействие характерно для хромосомных комплексов ДНК — хроматина и комплексов ДНК-протамины головок сперматозоидов некоторых животных.
Нуклеопротеиды диссоциируют на белки и нуклеиновые кислоты при воздействии агентов, разрушающих или ослабляющих нековалентные связи:
- повышенные концентрации солей или мочевины, увеличивающих ионную силу раствора,
- ионогенные поверхностно-активные вещества,
- некоторые полярные органические соединения (формамид и диметилформамид, фенол и т. п.).
Некоторые нуклеопротеиды (рибосомные субчастицы, нуклеокапсиды вирусов) обладают способностью к самосборке, то есть к образованию, при соответствующих условиях, нуклеопротеидов in vitro без участия клеточных структур или агентов; такая самосборка возможна в случае специфичных нуклеиново-белковых взаимодействий (нуклеиново-белковым узнавании). В любом случае, при образовании нуклеопротеидов происходят существенные конформационные изменения нуклеиновых кислот и, в некоторых случаях, белков, образующих нуклеопротеидный комплекс.
Распространённость и биологическая роль
Наиболее сильные конформационные изменения при образовании нуклеопротеидов претерпевают нуклеиновые кислоты, и эти изменения наиболее существенны в случае образования дезоксирибонуклеопротеидов. В отличие от одноцепочечной РНК, способной образовывать вторичные и третичные структуры за счёт антипараллельного комплементарного спаривания смежных отрезков цепи. Двухцепочечная ДНК такой возможности не имеет и существует в растворах в виде значительно более «рыхлых», по сравнению с компактными глобулами РНК, клубков. Однако связывание ДНК с сильноосновными белками (гистонами и протаминами) за счёт электростатического взаимодействия приводит к значительно более плотно упакованным нуклеопротеидным комплексам — хроматинам, обеспечивающим компактное хранение ДНК и, соответственно, наследственной информации в составе хромосом эукариот. С другой стороны, большая конформационная подвижность РНК и её каталитические свойства приводят к большому разнообразию рибонуклеопротеидов, выполняющих различные функции.
Дезоксирибонуклеопротеиды
- — комплекс ДНК с гистонами в клетках эукариот. За счёт электростатического взаимодействия нить ДНК совершает двойной оборот вокруг октамера гистонного комплекса H2a, H2b, H3 и H4, образуя нуклеосомы, соединённые нитью ДНК. При присоединении к комплексу гистона H1 шесть нуклеосом образуют кольцеобразный комплекс, в результате происходит конденсация хроматина с образованием фибриллярной структуры, которая далее при присоединении топоизомеразы II и ряда вспомогательных белков способна конденсироваться в гетерохроматин. ДНК, связанная в таком нуклеопротеидном комплексе не транскрибируется.
- Отдельным важным классом дезоксирибонуклеопротеидов являются вирусные нуклеопротеиды. Для репликации генетического материала ДНК-содержащих вирусов необходим перенос вирусной ДНК в ядро клетки, и такой транспорт и проникновение в ядро осуществляются в виде нуклеопротеидных комплексов, белки которых несут специфичные участки — сигналы ядерной локализации (Nuclear Localization Signal, NLS), обеспечивающие транспорт через ядерные поры.
Рибонуклеопротеиды
В клетках в наибольших количествах содержатся два класса рибонуклеопротеидов:
- Нуклеопротеидные комплексы рибосомальных РНК (рРНП) — субъединицы рибосом — органелл, на которых происходит трансляция мРНК и синтез белков. Рибосомы представляют собой агрегаты из двух различных рРНП-субъединиц.
- Малые ядерные рибонуклеопротеиды (мяРНП) — нуклеопротеидные комплексы малых ядерных РНК, являющиеся субъединицами сплайсосом (участников сплайсинга ядерных транскриптов — предшественников зрелых РНК).
- Нуклеопротеидные комплексы мРНК — матричные рибонуклеопротеиды (мРНП), в русскоязычной литературе часто называемые информосомами (название предложено по аналогии с синонимическим названием мРНК — информационная РНК А. С. Спириным, идентифицировавшим такие комплексы в 1964 году в цитоплазмезародышейрыб). Биологическая роль мРНП весьма разнообразна: они, предположительно, участвуют в транспорте мРНК, стабилизации (защите от деградации при транспорте) и трансляционной регуляции. мНРП также являются химически наиболее разнообразным классом нуклеопротеидов и их разнообразие определяется транскриптомом, то есть совокупностью мРНК, синтезируемых в клетке.
Нуклеокапсиды вирусов
Нитевидный нуклеокапсид вируса табачной мозаики:
1 — РНК, 2 — белковая субъединица, 3 — упакованный нуклеокапсид.
Нуклеокапсиды вирусов представляют собой достаточно плотно упакованные комплексы белков с нуклеиновой кислотой (ДНК или РНК у ретровирусов) и как функционально, так и структурно близки хроматину, представляя собой компактную форму вирусного генома.
Существует два основных типа нуклеокапсидных структур: палочковидная (нитевидная), либо сферическая («изометрическая»).
В первом случае связанные белковые субъединицы периодически располагаются вдоль нити нуклеиновой кислоты таким образом, что она сворачивается в спираль, образуя своего рода «инвертированную нуклеосому», в которой, в отличие от нуклеосом эукариот, белковая часть расположена не внутри, а снаружи структуры. Такая структура нуклеокапсидов типична для вирусов растений (в частности, вируса табачной мозаики) и миксо-, парамиксо- и рабдовирусов, нуклеокапсиды которых имеют спиральную форму.
В изометрических структурах упаковка нуклеиновой кислоты вирусного генома более сложна: белки оболочки нуклеокапсида относительно слабо связаны с нуклеиновой кислотой или нуклеопротеидами, что налагает минимум ограничений на способ упаковки нуклеиновой кислоты. Нуклеопротеиды «сердцевины» при этом могут быть весьма сложно организованы: так, в паповавирусах двухцепочечная кольцевая ДНК, связываясь с гистонами, образует структуры, очень похожие на нуклеосомы.
Читайте также:
