КТ, МРТ печени при гемохроматозе
Обновлено: 02.05.2024
КТ, МРТ печени при болезни Вильсона-Коновалова
а) Терминология:
1. Аббревиатура:
• Болезнь Вильсона-Коновалова (БВК)
2. Синонимы:
• Гепатолентикулярная дегенерация
3. Определение:
• Аутосомно-рецессивное заболевание, характеризующееся патологическим накоплением меди:
о В первую очередь в печени, затем в нервной и других тканях
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Раннее возникновение цирроза без специфических лучевых признаков
• Локализация:
о На ранних стадиях: диффузное распределение меди в печени, накапливающейся в цитоплазме гепатоцитов
о На поздних стадиях: в лизосомах; затем в узлах
• Ключевые моменты:
о Специфические лучевые признаки поражения печени, обусловленные болезнью Вильсона-Коновалова, отсутствуют
(Слева) На аксиальной Т1 ВИ МР томограмме у юноши 79 лет с поражением печени, которое, как выяснилось впоследствии, обусловлено болезнью Вильсона-Коновалова, определяется уменьшение размеров и рубцовые изменения печени на фоне спленомегалии.
(Справа) На аксиальной Т2 ВИ МР томограмме у этого же пациента определяется асцит, уменьшение размеров печени с наличием в ее структуре многочисленных мелких, гипоинтенсивных очагов (типичные регенераторные узлы), наличие которых не является характерным признаком болезни Вильсона-Коновалова. (Слева) На аксиальной КТ без контрастного усиления у этого же пациента определяется уменьшение размеров печени с наличием узлов в ее структуре, расширение фиссур наряду с признаками портальной гипертензии. Плотность печени слегка ниже плотности селезенки. Данные, полученные при исследовании биоптата печени, подтвердили болезнь Вильсона-Коновалова. У большинства пациентов, страдающих этим заболеванием, при лучевой визуализации не обнаруживается каких-либо изменений со стороны печени.
(Справа) Микропрепарат биоп -тата печени (окраска гематоксилин-эозином) в случае болезни Вильсона-Коноввалова: признаки хронического портального и перипортального гепатита наряду с апоптозом гепатоцитов. (Слева) На аксиальной КТ с контрастным усилением у мальчика 14 лет с нарушенной функцией печени определяются изменения, обусловленные циррозом, с наличием узлов и расширением фиссур. Присутствуют признаки портальной гипертензии, в т. ч. асцит и варикозное расширение вен.
(Справа) На аксиальной КТ с контрастным усилением у этого же пациента также визуализируются варикозно расширенные вены. Отсутствуют какие-либо специфические признаки, которые позволили бы заподозрить болезнь Вильсона-Коновалова. Цирроз у детей является ключевым клиническим признаком, однако для подтверждения диагноза требуется биопсия печени.
2. КТ при болезни Вильсона-Коновалова:
• Изменения со стороны печени (жировая инфильтрация, цирроз) не являются специфическими и аналогичны таковым при других заболеваниях
• Медь имеет большое атомное число и может приводить к повышению плотности печени на КТ:
о Что, однако, обнаруживается нечасто, поскольку сопутствующая жировая инфильтрация обусловливает уменьшение плотности паренхимы печени
• Множественные гиперденсные регенераторные узлы (на КТ без контрастного усиления):
о Идентичны иным узловым изменениям при циррозе печени
• Множественные мелкие диспластические узлы накапливают контраст в артериальную фазу (нетипичная, редкая находка)
3. МРТ при болезни Вильсона-Коновалова:
• Медь никак не проявляет себя на МРТ
• Регенераторные узлы, содержащие железо, гипоинтенсивны на Т1 и Т2 ВИ
4. Рекомендации по визуализации:
• Лучший метод диагностики:
о КТ и МРТ используются для оценки цирроза:
- Не при диагностике болезни Вильсона-Коновалова
(Слева) На корональной МР томограмме у женщины 24 лет с на -рушением печеночной функции определяется уменьшение размеров печени и увеличение селезенки.
(Справа) На аксиальной Т2 ВИ у этой же пациентки определяются множественные, мелкие регенераторные узлы, идентичные таковым при циррозе другой этиологии. (Слева) На аксиальной Т1 ВИ МР томограмме (GRE in-phase) определяется только пери портальный отек - неспецифический признак гепатита, в т.ч., обусловленного иными причинами.
(Справа) На аксиальной Т1 ВИ МР томограмме (GRE opposed-phase) у этой же пациентки определяется диффузное «выпадение» сигнала в печени, что свидетельствует о стеатозе. (Слева) На аксиальной Т1 ВИ МР томограмме (GRE in-phase) у этой же пациентки определяется расширение фиссур-характерный, хотя и неспецифический, признак цирроза.
(Справа) На аксиальной Т1 ВИ МР томограмме (GRE opposed-phase) у этой же пациентки определяется диффузное снижение сигнала в печени, характерное для стеатоза. При исследовании биоптата печени подтвердился стеатоз на фоне отложения избыточного количества меди в печени, обусловленного болезнью Вильсона-Коновалова.
в) Дифференциальная диагностика болезни Вильсона-Коновалова:
1. Стеатоз (жировой гепатоз):
• Снижение плотности печени ниже значений плотности селезенки на КТ без контрастного усиления
• Отсутствие патологических изменений со стороны сосудов печени
2. Гепатит:
• Гепатомегалия, перипортальный отек, лимфаденопатия
• Плотность печени обычно остается неизменной
г) Патология:
1. Общая характеристика:
• Этиология:
о Уменьшение экскреции меди с желчью, усиление всасывания меди в кишечнике, нарушение выделения меди с мочой
• Генные изменения:
о Заболевание с аутосомно-рецессивным типом наследования
2. Макроскопические и хирургические особенности:
• Стеатоз, фиброз и, в конечном счете, цирроз печени
3. Микроскопия:
• Отложения меди в синусоидах печени и по периферии портальных сосудов
• Медь инициирует воспалительную реакцию, приводящую к фиброзу
д) Клинические особенности:
1. Проявления болезни Вильсона-Коновалова:
• Клинически профиль:
о Хронический гепатит, цирроз, острая печеночная недостаточность:
- У подростков или у «молодых взрослых»
о Острый фульминантный гепатит: проявляется внезапным появлением желтухи, асцитом; прогрессирует с развитием энцефалопатии, печеночной недостаточности
о Лабораторные данные: уровень церулоплазмина в крови ниже 20 мг/дл
о Диагноз устанавливается на основании биопсии печени и количественного определения меди:
- Количество меди при заболевании превышает 250 мкг на один грамм сухой массы печени
- Для установления диагноза достаточно наличия колец Кайзера-Флейшера на фоне снижения уровня церулоплазмина
2. Демография:
• Пол:
о Фульминантная форма болезни Вильсона-Коновалова чаще встречается у женщин (М:Ж = 1:2)
• Эпидемиология:
о Распространенность заболевания составляет 1:30000 (не является редким)
3. Течение и прогноз:
• Накопление меди в количествах, при которых она начинает оказывать токсическое воздействие, происходит в базальных ганглиях, почечных сосочках, роговице, костях, суставах
• Цирроз печени в сочетании с болезнью Вильсона-Коновалова также является предрасполагающим фактором развития гепатоцеллюлярного рака
• Ранние и острые проявления заболевания, например, молниеносная печеночная недостаточность, приводят к неблагоприятному исходу
• Благоприятный прогноз при терапии хелатообразующими препаратами (на ранней стадии), при трансплантации печени (на поздней стадии)
4. Лечение:
• Основная и поддерживающая терапия с использованием препаратов, связывающих медь
• Трансплантация печени с целью лечения и предотвращения рецидива
е) Список использованной литературы:
1. Schilsky ML: Liver transplantation for Wilson's disease. Ann N Y Acad Sci. 1315:45-9, 2014
2. Weiss KH et al: Clinical considerations for an effective medical therapy in Wilson's disease. Ann N Y Acad Sci. 1315:81 -5, 2014
3. Eapen CE: Copper and liver disease. Gut. 61(1):63, 2012
4. Bennett J et al: Clinical molecular diagnosis of Wilson disease. Semin Liver Dis. 31(3):233-8, 2011
5. Harada M et al: Excess copper chelating therapy for Wilson disease induces anemia and liver dysfunction. Intern Med. 50(14): 1461-4, 2011
6. Johncilla M et al: Pathology of the liver in copper overload. Semin Liver Dis. 31 (3):239-44, 2011
7. Cheon JE et al: Clinical application of liver MR imaging in Wilson's disease. KoreanJ Radiol. 11 (6):665-72, 2010
КТ, МРТ печени при гемохроматозе
а) Определения:
• Заболевание, характеризующееся избыточным отложением железа в различных органах, их структурными изменениями и нарушением функции
• Гемосидероз:
о Избыточное отложение железа без органного повреждения
1. Общая характеристика:
• Лучший диагностический критерий:
о Повышение плотности печени на КТ без контрастного усиления, значительное снижение интенсивности сигнала на Т2 ВИ и на GRE in-phase
• Ключевые моменты:
о Гемохроматоз подразделяется на два типа:
- Первичный(врожденный):
Аутосомно-рецессивное заболевание, приводящее к повышенному всасыванию железа в кишечнике
Протекает с поражением паренхимы печени, сердца, селезенки
- Вторичный:
Обусловлен множественными гемотрансфузиями, приемом препаратов железа в большом количестве и т.д.
Характеризуется поражением ретикулоэндотелиальной системы (РЭС): печени, селезенки, лимфоузлов, костного мозга

(Слева) На аксиальной КТ без контрастного усиления у женщины 54 лет, страдающей серповидноклеточной анемией, определяется, что паренхима печени имеет плотность намного выше, чем плотность мышц или почек. Селезенка в этом случае не берется для сравнения, поскольку она ишемически изменена и содержит обызвествления. Обратите внимание, что некоторые лимфоузлы имеют повышенную плотность.
(Справа) На КТ срезе у этой же пациентки визуализируется плотное пигментное вещество в многочисленных лимфатических узлах, скорее всего, кальций или железо. В поджелудочной железе явных включений железа не выявлено.
2. КТ при гемохроматозе:
• КТ без контрастного усиления:
о Равномерное повышение плотности печени:
- Вплоть до 75-135 ед. Хаунсфилда (в норме 45-60 ед. Хаунсфилда)
• КТ с контрастным усилением:
о Избыток железа в паренхиме печени становится не столь очевидным
о На поздних стадиях заболевания возникают признаки цирроза, возможно, также портальной гипертензии
4. Рекомендации по визуализации:
• Лучший метод диагностики:
о MPT (T2*GRE) для диагностики гемохроматоза печени
(Слева) На GRE МР томограмме «в фазе» у мужчины 37 лет с первичным гемохроматозом определяется выраженное снижение интенсивности сигнала от паренхимы печени. Сигнальные характеристики селезенки и костного мозга не изменены.
(Справа) На GRE МР томограмме «в противофазе» у этого же пациента определяется незначительное снижение интенсивности сигнала от печени - типичный признак наличия избыточного количества железа в ее паренхиме (изменения противоположны таковым при стеатозе). (Слева) На Т2 ВИ МР томограмме у пациента 71 года с вторичным гемохроматозом определяется выраженное снижение интенсивности сигнала от печени, обусловленное избыточным содержанием железа. Также в печени визуализируется округлое образование.
(Справа) На Т1 ВИ МР томограмме без контрастного усиления у этого же пациента визуализируется то же самое образование в печени.
в) Дифференциальная диагностика гемохроматоза:
1. Прием амиодарона:
• Амиодарон-антиаритмический препарат, содержащий йод
• Обусловливает диффузное равномерное повышение плотности печени на КТ без контрастного усиления
2. Болезни накопления гликогена:
• ↑ или ↓ плотности печени на КТ без контрастного усиления:
о В зависимости от конкретного типа заболевания
г) Патология. Общая характеристика:
• Этиология:
о Первичный (врожденный) гемохроматоз:
- Аутосомно-рецессивное заболевание
- Заболевание широко распространено, но редко диагностируется (гемохроматозом страдает один из 200 представителей некоторых этнических групп Европы)
- Заболевание связано с патологическим повышением всасывания железа в кишечнике
о Вторичный гемохроматоз:
- Обусловлен приемом большого количества железа с пищей и лекарственными препаратами
- Встречается у пациентов с неэффективным эритропоэзом, страдающих анемией, которым выполнялись множественные переливания крови
• Ассоциированные изменения:
о Цирроз, гепатоцеллюлярный рак
о Прогрессирующее поражение сердца, печени, поджелудочной железы
(Слева) На Т1 ВИ МР томограмме в артериальную фазу контрастного усиления (у этого же пациента) определяется, что образование интенсивно накапливает контраст (является гиперваскулярным).
(Справа) На Т1 ВИ МР томограмме в отсроченную фазу контрастного усиления в этом же случае определяется «вымывание» контраста из образования, вокруг него видна капсула. Эти изменения являются типичными для ГЦР на фоне гемохроматоза. (Слева) На аксиальной КТ без контрастного усиления у молодой женщины, страдающей серповидноклеточной анемией, визуализируется уменьшенная в размерах селезенка, «перегруженная» кальцием (аутоспленэктомия). При отсутствии селезенки сигнальные характеристики которой используются для сравнения, сложно оценить увеличение интенсивности сигнала от печени.
(Справа) На аксиальной Т2 ВИ МР томограмме у женщины 25 лет с серповидноклеточной анемией определяется явное выпадение сигнала в печени, селезенке и костном мозге. Обратите внимание, что селезенка уменьшена в размерах вследствие хронической ишемии и инфаркта. Поджелудочная железа имеет обычные размеры и сигнальные характеристики. (Слева) Ha GRE Т1 ВИ МР томограмме «в фазе» у пациента с гемохроматозом определяется как диффузное, так и очаговое выпадение сигнала в печени, особенно в латеральном ее сегменте.
(Справа) На GRE МР томограмме «в противофазе» у этого же пациента отсутствует «выпадение» сигнала в печени. Этот феномен является обратным таковому при очаговом стеатозе, когда «в противофазе» определяется снижение интенсивности сигнала (с укороченным временем эха при 1,5Т).
1. Проявления:
• Типичные признаки/симптомы:
о В первые десять лет с момента возникновения заболевание протекает бессимптомно
о Классическая триада первичного гемохроматоза:
- Цирроз, диабет, гиперпигментация кожи
о Другие признаки/симптомы:
- Застойная сердечная недостаточность, аритмия
- Артралгия, импотенция, атрофия половых желез
• Осложнения:
о Перипортальный фиброз, обусловливающий развитие цирроза на поздних стадиях
о Гепатоцеллюлярный рак (14-30%)
о Инсулинзависимый сахарный диабет (30-60%) о Сердечная недостаточность (30%)
2. Демография:
• Пол:
о М:Ж= 10:1
о Женщины, получающие препараты железа с профилактической целью во время менструаций и беременности
3. Течение и прогноз:
• При ранней диагностике и лечении ожидаемая продолжительность жизни не снижена:
о Дефероксамин (комплексообразующий препарат для лечения пациентов с гемохроматозом)
о Флеботомия в доцирротической стадии
• Ожидаемая продолжительность жизни при отсутствии лечения составляет 4,4 года с момента установления диагноза
е) Диагностическая памятка. Советы по интерпретации изображений:
• Первичная форма заболевания: необходимо оценить наличие изменений, обусловленных гемохроматозом, со стороны поджелудочной железы (и других органов)
• Вторичная форма: необходимо оценить изменения селезенки
• Преимуществом МРТ является визуализация достоверных изменений, обусловленных повышенным накоплением железа в печени, которые могут симулировать некоторые заболевания на КТ
• После флеботомии или терапии хелатообразующими препаратами плотность печени на КТ может возвращаться к норме
Гемохромaтоз печени
Гемохроматоз печени – это генетическое аутосомно-рецессивное заболевание, характеризующееся повышенным всасыванием и отложением железа в печени и других паренхиматозных органах. В клинике превалирует триада признаков: цирроз, гиперпигментация кожных покровов, эндокринные нарушения. Диагностика основана на изучении семейного анамнеза, выявлении нарушений обмена железа, МРТ печени с последующей биопсией, выявлении гомозиготного носительства гена гемохроматоза. Специфическое лечение включает назначение препаратов, выводящих излишки железа из организма, эфферентные методики – кровопускание, цитаферез. Заболевание неизлечимо.

Общие сведения
Гемохроматоз печени – наследственное заболевание, при котором происходит нарушение метаболизма железа в организме, его избыточное отложение в органах и тканях. Несмотря на системный характер нарушений, наиболее тяжело при гемохроматозе поражается печень – в ней развиваются цирротические изменения. Отложение железа в коже проявляется гиперпигментацией, в железах внутренней секреции – эндокринными нарушениями, сахарным диабетом.
Впервые патология была описана в 1871 г., с тех пор исследования в этой области не прекращаются. На сегодняшний день выявлен ген, отвечающий за развитие гемохроматоза, связанный с HLA-комплексом гистосовместимости. Ген этот рецессивный, поэтому для появления клиники гемохроматоза необходимо наличие данной мутации у обоих родителей пациента. Гемохроматоз печени – заболевание редкое, гетерозиготное носительство встречается у 10% населения, а гомозиготность – лишь в 0,3%. Мужчины страдают в десять раз чаще женщин.
Причины
Генетическая природа гемохроматоза печени и его тесная связь с HLA-комплексом гистосовместимости была доказана в 1976 году. В настоящее время ученым практически удалось выделить ген, отвечающий за развитие данного заболевания. Носительство гена может быть гомозиготным, при котором отмечается развернутая клиническая картина, и гетерозиготным. У носителей гетерозиготных генов обычно выявляется небольшое повышение уровня железа в крови, однако излишнего отложения в тканях, а значит и клинических проявлений, не возникает.
Патогенез
В норме утилизация железа организмом регулируется потребностями тканей в этом микроэлементе. Железо всасывается в начальных отделах тонкой кишки и связывается в крови с транспортным белком трансферрином. По мере необходимости железо поступает в ткани и там используется либо откладывается в связанной форме, в виде ферритина. Самые емкие депо железа – эритроциты, печень и мышцы. С течением времени ферритин в тканях начинает разрушаться с образованием пигмента гемосидерина. Не менее трети всех запасов железа хранится в виде гемосидерина, его количество повышается при нарушениях обмена железа.
В организме здорового человека в среднем содержится примерно 4 г железа. С пищей ежедневно поступает около 10-20 г железа, но потребляется из них не более десятой части, причем при необходимости перенос железа внутрь клеток может производиться даже против градиента концентрации. При полном заполнении депо железа данный элемент практически прекращает всасываться в кишечнике, а при его недостатке скорость всасывания возрастает в десятки раз.
При мутации гена гемохроматоза печени поломка в ферментной системе приводит к формированию ложного сигнала о низком уровне железа в организме. Ионы этого металла начинают всасываться в повышенном количестве, что в результате приводит к накоплению не менее чем 1 г излишков железа в год. После того, как весь пул железосвязывающих белков будет связан с металлом, железо, как сильный элемент, активирует окислительные процессы в клетке. Это приводит к образованию большого количества свободных радикалов, а те, в свою очередь, вызывают некроз клеток, повышенный синтез коллагена, раковое перерождение тканей.
Симптомы гемохроматоза печени
Для появления первых симптомов обычно требуется не менее 20 лет, пока общее содержание железа в организме не превысит 20-40 г. На начальном этапе заболевания, даже при наличии генетической предрасположенности, перегрузки организма железом не наблюдается. Следующим этапом является перегрузка тканей ионами железа без клинических проявлений. И только на поздней стадии появляются типичные клинические признаки.
Первыми проявлениями гемохроматоза печени на протяжении долгих лет могут служить лишь слабость, повышенная утомляемость, снижение половой функции у мужчин (снижение либидо и т. п.) и аменорея у женщин. Нарушение обмена железа приводит к кальцинозу суставов, трофическим изменениям в коже и хрящах, половых органах. На более поздних стадиях заболевания клиническая картина становится развернутой: отложение гемосидерина в коже сопровождается гиперпигментацией открытых мест, подмышечных впадин и промежности.
Из внутренних органов первой поражается печень: происходит некроз гепатоцитов, избыточное образование коллагена, что в будущем приводит к циррозу. Изначально печень увеличивается в размерах, становится плотной, болезненной при пальпации. Затем орган уменьшается, развивается симптоматика печеночно-клеточной недостаточности и портальной гипертензии. Более чем у 80% пациентов отмечаются эндокринопатии: поражаются гипофиз и эпифиз, щитовидная, поджелудочная и половые железы. Практически у всех больных с эндокринопатиями развивается сахарный диабет, зачастую инсулинозависимый.
Очень часто в процесс вовлекаются суставы, центральная нервная система. Отложение гемосидерина в сердце отмечается у 90-100% пациентов, но клиническая симптоматика возникает не более чем у трети больных. Гемохроматоз сердца проявляется кардиомиопатией, гипертрофией миокарда, тяжелой сердечной недостаточностью.
Диагностика
Консультация гепатолога необходима не только для оценки клинических данных, но также для подробного разбора семейного анамнеза, выявления наследственного характера заболевания. Если в ходе осмотра и беседы с пациентом возникает подозрение на гемохроматоз печени, назначается ряд дополнительных анализов и консультация генетика. УЗИ гепатобилиарной системы при гемохроматозе печени позволяет выявить значительное повышение эхогенности печеночной ткани за счет отложений гемосидерина.
Аналогичные изменения можно обнаружить и в других органах при проведении ультрасонографии поджелудочной железы, УЗИ щитовидной железы, ЭхоКГ. Если предварительный диагноз подтверждается с помощью МРТ печени, то пациент направляется на пункционную биопсию печени с последующим морфологическим исследованием биоптатов. Абсолютным доказательством правомочности диагноза является обнаружение дефектного гена гемохроматоза печени при кариотипировании.

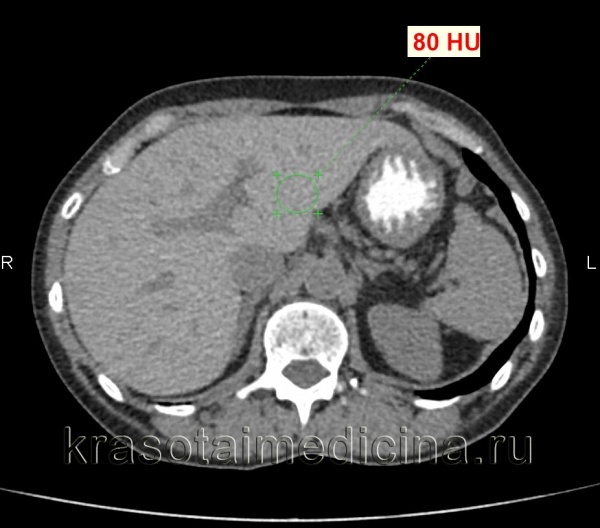
КТ органов брюшной полости. Диффузное повышение плотности печени до 80 ед. Хаунсфилда (преконтрастное изображение) за счет диффузного отложения железа.
Лечение гемохроматоза печени
Методов полного излечения патологии в современной гастроэнтерологии не существует, поэтому терапия направлена на купирование симптомов заболевания. Для начала назначается диета с пониженным содержанием железа и повышенным уровнем белка. В последующем используются методики, позволяющие усилить выведение железа из организма. Наиболее доступный способ уменьшить пул железа – кровопускание. Для правильного расчета объема кровопускания учитываются уровни гемоглобина, гематокрита, трансферрина. При заборе 500 мл крови теряется 200-250 мг железа. В среднем производится эксфузия 300 мл крови дважды в неделю.
Более сложным методом, требующим специального оборудования, является цитаферез – при этом осуществляется удаление клеточных элементов, а плазма возвращается в кровяное русло. Сеансы кровопусканий или цитафереза проводятся до развития умеренной анемии. Так как на фоне исходной анемии использование эфферентных методик ограничено, то в качестве подготовки и сопровождения цитафереза назначается рекомбинантный эритропоэтин. Данный препарат усиливает утилизацию железа, благодаря чему снижается его концентрация в тканях, повышается гемоглобин. Курс введения эритропоэтина – 10-15 недель.
Другим методом лечения гемохроматоза печени является использование дефероксамина – 500 мг этого препарата выводит из организма почти 45 мг железа. Курс лечения дефероксамином составляет не менее 30-40 дней. Одновременно проводят симптоматическую терапию цирроза печени, сердечной и печеночной недостаточности, сахарного диабета.
Прогноз и профилактика
Течение заболевания длительное, а прогноз благоприятный лишь при своевременном начале лечения. Если патогенетическая терапия была инициирована до значительной перегрузки организма железом, развития цирроза, диабета и полиорганной недостаточности - выживаемость увеличивается на несколько десятилетий. В случае развития цирроза риск гепатоцеллюлярной карциномы возрастает в 200 раз. Смерть обычно наступает от печеночной недостаточности и ее осложнений. Профилактика не разработана.
Гемохроматоз сердца ( Пигментный миокардит , Сидерокардиоз )
Гемохроматоз сердца (сидерокардиоз, пигментный миокардит) – поражение сердца, обусловленное врожденным нарушением метаболизма железа, его неконтролируемой абсорбцией в кишечнике, избыточным содержанием в сыворотке крови и отложением в миокарде. Гемохроматоз сердца проявляется нарушениями сердечного ритма, недостаточностью кровообращения, артериальной гипотонией; сопровождается пигментацией кожи, циррозом печени, сахарным диабетом. Диагноз гемохроматоза сердца подтверждают данные лабораторного исследования метаболизма железа, ЭКГ, МРТ и КТ. При гемохроматозе сердца показаны диета, кровопускания, плазмаферез и гемосорбция, сердечные и гормональные препараты; при осложнениях - трансплантация печени, эндопротезирование суставов.
Гемохроматоз – полисистемное заболевание, обусловленное наследственным нарушением метаболизма железа, его избыточным накоплением в организме и токсическим повреждением тканей и органов. Основные клинические формы гемохроматоза включают поражение сердца, печени, эндокринных желез и суставов.
Поражение миокарда наблюдается в 80-90% случаев заболевания гемохроматозом; в кардиологии этот процесс обозначают как «дегенеративное ржавение» сердца. Из-за отложения чрезмерного количества пигмента гемосидерина, сердце и другие органы приобретают ржаво-бурую окраску, резко уплотняются и увеличиваются в размерах. При гемохроматозе сердца отмечаются дистрофические и атрофические изменения мышечных волокон с разрастанием фиброзной ткани (кардиосклероз), приводящие к снижению сократительной функции миокарда и развитию недостаточности кровообращения.
Гемохроматоз сердца наблюдается преимущественно у лиц мужского пола в возрасте 40-60 лет, т. к. у женщин имеется регулярная физиологическая потеря железа при менструациях.
Причины гемохроматоза сердца
Около 2/3 от общего количества железа в организме входит в состав гемоглобина эритроцитов, миоглобина, других белков и ферментов; 1/3 - депонирована в виде ферритина и гемосидерина в паренхиматозных клетках печени, почек, селезенки, мышцах, костном и головном мозге. Уровень железа регулируется динамикой его всасывания в ЖКТ, преимущественно в верхних отделах тонкой кишки. В норме из 10-20 мг железа, поступающего с пищей, энтероцитами абсорбируется 1-2 мг.
При гемохроматозе сердца отмечается интенсивное всасывание железа в кишечнике и резкое увеличение его запасов: в миокарде - в 5-25 раз, в печени и поджелудочной железе - в 50-100 раз. Свободное железо, обладая сильным редокс-потенциалом, способно запускать цепные свободнорадикальные реакции и вызывать токсическое повреждение макромолекул белков, липидов и нуклеиновых кислот.
Гемохроматоз сердца может быть первичным и вторичным. Первичный гемохроматоз сердца – наследственное заболевание, проявляющееся в четырех формах: аутосомно-рецессивной; ювенильной; связанной с мутацией в трансферриновом рецепторе 2-го типа и аутосомно-доминантной.
Вторичный гемохроматоз сердца развивается при избыточном поступлении железа в организм в случае длительного неконтролируемого приема железосодержащих препаратов, при повторных частых гемотрансфузиях.
Симптомы гемохроматоза сердца
Многообразие симптоматики гемохроматоза определяется поражением различных органов: сердца, кожных покровов, печени, поджелудочной железы, гипофиза, суставов и др. Течение заболевания обычно медленное, с постепенным развитием и преобладанием отдельных проявлений. Классическая триада, наиболее характерная для терминальной стадии гемохроматоза, включает цирроз печени, пигментацию кожи, сахарный диабет.
Имеются случаи заболевания с первичным поражением сердца без развития сахарного диабета и пигментации кожи. При гемохроматозе отмечаются выраженный фиброз сердечной мышцы с преимущественным нарушением проводящей системы сердца. Гемохроматоз проявляется увеличением размеров сердца и расширением его полостей, сбоем сердечного ритма (пароксизмальной тахикардией, мерцательной аритмией), право- или левожелудочковой сердечной недостаточностью, артериальной гипотонией, периферическими отеками.
При гемохроматозе сердца кожа приобретает бронзовый оттенок, особенно на открытых участках (лице, шее, конечностях, области половых органов). Цирроз печени характерен для 90-95% случаев гемохроматоза и сопровождается болями в животе, диспепсией, гепатомегалией, исхуданием, иногда не резко выраженной желтухой. Сахарный диабет, наблюдающийся на поздних стадиях у 70 – 80 % больных гемохроматозом сердца, проявляется жаждой, полиурией.
При гемохроматозе может отмечаться недоразвитие половых органов, снижение либидо, бесплодие, атрофия яичек и феминизация - у мужчин, нарушение менструального цикла - у женщин. Возможно развитие артропатий, периферических невритов, надпочечниковой недостаточности, редко - портальной гипертонии с расширением вен пищевода.
Прогрессирование гемохроматоза может осложняться нарушениями ритма сердца, сердечной недостаточностью, инфарктом миокарда, острой печеночной недостаточностью, асцитом, внутренним кровотечением из вен пищевода, тромбозом сосудов печени и селезенки, иногда - печеночной и диабетической комой, раком печени.
Диагностика гемохроматоза сердца
Диагноз гемохроматоза сердца устанавливается по наличию характерной клинической картины, результатам лабораторных и инструментальных исследований (ЭКГ, ЭхоКГ, МРТ и МСКТ органов брюшной полости, рентгенографии суставов, биопсии печени).
Признаки кардиомиопатии при гемохроматозе сердца обычно сочетаются с пигментацией кожи, циррозом печени, патологией эндокринной системы, сахарным диабетом, поражением суставов.
В диагностике ранних стадий гемохроматоза сердца большое значение имеет определение уровня железа, ферритина и трансферрина в сыворотке крови, общей железосвязывающей способности сыворотки (ОЖСС) и процента насыщения трансферрина железом (НТЖ), десфераловый тест. Для гемохроматоза сердца характерно значительное увеличение количества сывороточного железа (до 54-72 мкмоль/л) и ферритина; снижение показателей ОЖСС и трансферрина, диспротеинемия, гипергликемия. Важные признаки перегрузки железом при гемохроматозе сердца – это повышение коэффициента НТЖ до 60-90%, резкое увеличение выделения железа с мочой при нагрузке десфералом (> 2 мг в течение 6 ч).
С целью оценки степени тяжести гемохроматоза сердца, признаков поражения других органов проводятся общий и биохимический анализ крови, определение глюкозы и гликозилированного гемоглобина крови, общий анализ мочи. Для электрокардиограммы типичны признаки гипертрофии левого желудочка и внутрижелудочковой блокады, говорящие о длительной перегрузке левого желудочка и нарушении сердечного ритма.
Рентгенография суставов при гемохроматозе сердца позволяет выявить признаки гипертрофического остеоартрита, хондрокальциноза суставных хрящей и менисков. Молекулярно-генетическое исследование используется для определения наследственной природы избытка железа в организме. МРТ и КТ обнаруживают повышенную плотность печени.
Для подтверждения диагноза гемохроматоза выполняют биопсию печени с количественным определением концентрации железа в печеночной ткани, цитологическим исследованием биоптатов на наличие отложений избытка гемосидерина в гепатоцитах и портального цирроза. Дифференциальную диагностику гемохроматоза сердца проводят с приобретенным гемосидерозом, миокардитом, ишемической болезнью сердца, ревматизмом, сахарным диабетом.
Лечение гемохроматоза сердца
Лечение гемохроматоза сердца направлено на снижение количества железа в организме, предупреждение развития серьезных осложнений и проводится с использованием немедикаментозных, медикаментозных и хирургических методов. Пациентам с гемохроматозом сердца показана диета с ограничением продуктов и препаратов с высоким содержанием железа, алкоголя, легкоусвояемых углеводов.
Систематические кровопускания (1-2 раза в неделю по 500 мл крови), гирудотерапия, плазмаферез и гемосорбция помогают снизить уровень запасов железа в организме, улучшают самочувствие больных с гемохроматозом сердца. Кровопускания можно выполнять амбулаторно до снижения показателей метаболизма железа (Fe, Hb, ферритина) до нижней границы нормы. После кровопусканий проводится введение плазмы или альбумина, рекомендуется прием пищи, богатой белком.
Патогенетическое лечение гемохроматоза включает внутримышечное или внутривенное введение дефероксамина, способствующего усиленному выведению железа с мочой и предупреждающего развитие цирроза в печени. В комплексной терапии нарушений функции печени, сердечно-сосудистой и эндокринной системы при гемохроматозе сердца используют инсулин, гормональные, сердечные препараты. Хирургическое лечение показано больным с гемохроматозом сердца при развитии цирроза печени (трансплантации печени) и выраженной артропатии (эндопротезирование суставов).
Прогноз гемохроматоза сердца
Прогноз гемохроматоза сердца неблагоприятный при поздней диагностике заболевания, наличии тяжелого поражения миокарда, печени, поджелудочной железы. В отсутствии лечения больные живут не более 4-5 лет. Причинами смерти при гемохроматозе сердца могут быть сердечная недостаточность (около 33%), цирроз печени (32%), рак печени (23%), интеркуррентная патология. При своевременном лечении гемохроматоза сердца продолжительность жизни существенно возрастает.
Пациентам с гемохроматозом сердца ежеквартально показан контрольный осмотр с участием кардиолога, гастроэнтеролога, эндокринолога и гематолога.
Гемохроматоз ( Бронзовый диабет , Пигментный цирроз )
Гемохроматоз – наследственное полисистемное заболевание, сопровождающееся активным всасыванием железа в ЖКТ и его последующей аккумуляцией во внутренних органах (сердце, поджелудочной железе, печени, суставах, гипофизе). Клиника гемохроматоза характеризуется бронзовой пигментацией кожи и слизистых оболочек, развитием цирроза печени, сахарного диабета, кардиомиопатии, артралгий, нарушения половой функции и т. д. Диагноз гемохроматоза подтверждается при определении повышенной экскреции железа с мочой, высокого содержания железа в сыворотке крови и биоптатах печени, а также с помощью рентгенографии, УЗИ, МРТ внутренних органов. Лечение пациентов с гемохроматозом основано на соблюдении диеты, введении дефероксамина, проведении кровопусканий, плазмафереза, гемосорбции, симптоматической терапии. При необходимости решается вопрос о трансплантации печени и артропластике.
Гемохроматоз (бронзовый диабет, пигментный цирроз) – генетически обусловленное нарушение метаболизма железа, приводящее к отложению железосодержащих пигментов в тканях и органах и развитию полиорганной недостаточности. Заболевание, сопровождающееся характерным симптомокомплексом (пигментация кожи, цирроз печени и сахарный диабет) было описано в 1871 г., а в 1889 г. получило название гемохроматоза за характерную окраску кожи и внутренних органов. Частота наследственного гемохроматоза в популяции составляет 1,5-3 случая на 1000 населения. Мужчины болеют гемохроматозом в 2-3 раза чаще, чем женщины. Средний возраст развития патологии - 40-60 лет. Ввиду полисистемности поражения, изучением гемохроматоза занимаются различные клинические дисциплины: гастроэнтерология, кардиология, эндокринология, ревматология и др.
В этиологическом аспекте выделяют первичный (наследственный) и вторичный гемохроматоз. Первичный гемохроматоз связан с дефектом ферментных систем, приводящим к отложению железа во внутренних органах. В зависимости от генного дефекта и клинической картины выделяют 4 формы наследственного гемохроматоза:
- I - классический аутосомно-рецессивный, HFE-ассоциированный тип (более 95% случаев)
- II – ювенильный тип
- III - наследственный HFE-неассоциированный тип (мутации в трансферриновом рецепторе 2-го типа)
- IV– аутосомно-доминантный тип.
Вторичный гемохроматоз (генерализованный гемосидероз) развивается в результате приобретенной недостаточности ферментных систем, участвующих в обмене железа, и часто ассоциирован с другими заболеваниями, в связи с чем выделяют следующие его варианты: посттрансфузионный, алиментарный, метаболический, смешанный и неонатальный.
В клиническом течении гемохроматоз проходит 3 стадии: I - без перегрузки железом; II – с перегрузкой железом, но без клинических симптомов; III – с развитием клинических проявлений.
Причины гемохроматоза
Первичный наследственный гемохроматоз является заболеванием с аутосомно-рецессивным типом передачи. В его основе лежат мутации гена HFE, расположенного на коротком плече 6-ой хромосомы. Дефект HFE-гена приводит к нарушению трансферрин-опосредованного захвата железа клетками 12-перстной кишки, следствием чего является формирование ложного сигнала о дефиците железа в организме. В свою очередь, это способствует повышенному синтезу железосвязывающего белка DCT-1 энтероцитами и усиленной абсорбции железа в кишечнике (при нормальном поступлении микроэлемента с пищей). В дальнейшем происходит чрезмерное отложение железосодержащего пигмента гемосидерина во многих внутренних органах, гибель их функционально активных элементов с развитием склеротических процессов. При гемохроматозе ежегодно в организме человека накапливается 0,5-1,0 г железа, а проявления заболевания манифестируют при достижении общего уровня железа 20 г (иногда 40-50 г и больше).
Вторичный гемохроматоз развивается в результате избыточного экзогенного поступления железа в организм. Такое состояние может возникать при частых повторных гемотрансфузиях, неконтролируемом приеме препаратов железа, талассемии, некоторых видах анемии, кожной порфирии, алкогольном циррозе печени, хронических вирусных гепатитах В и С, злокачественных новообразованиях, следовании низкобелковой диете.
Симптомы гемохроматоза
Клиническая манифестация наследственного гемохроматоза приходится на зрелый возраст, когда содержание общего железа в организме достигает критических значений (20-40 г). В зависимости от преобладающих синдромов различают гепатопатическую (гемохроматоз печени), кардиопатическую (гемохроматоз сердца), эндокринологическую формы заболевания.
Заболевание развивается постепенно; в начальной стадии преобладают неспецифичные жалобы на повышенную утомляемость, слабость, похудание, снижение либидо. В этой стадии больных могут беспокоить боли в правом подреберье, сухость кожи, артралгии, обусловленные хондрокальцинозом крупных суставов. В развернутой стадии гемохроматоза формируется классический симптомокомплекс, представленный пигментацией кожи (бронзовая кожа), циррозом печени, сахарным диабетом, кардиомиопатией, гипогонадизмом.
Обычно наиболее ранним признаком гемохроматоза выступает появление специфической окраски кожи и слизистых оболочек, выраженной, главным образом, на лице, шее, верхних конечностях, в области подмышек и наружных гениталий, рубцов кожи. Интенсивность пигментации зависит от давности течения заболевания и варьирует от бледно-серого (дымчатого) до бронзово-коричневого цвета. Характерно выпадение волос на голове и туловище, вогнутая (ложкообразная) деформация ногтей. Отмечаются артропатии пястно-фаланговых, иногда коленных, тазобедренных и локтевых суставов с последующим развитием их тугоподвижности.
Практически у всех больных выявляется увеличение печени, спленомегалия, цирроз печени. Нарушение функции поджелудочной железы выражается в развитии инсулинзависимого сахарного диабета. В результате поражения гипофиза при гемохроматозе страдает половая функция: у мужчин развивается атрофия яичек, импотенция, гинекомастия; у женщин – аменорея и бесплодие. Гемохроматоз сердца характеризуется кардиомиопатией и ее осложнениями – аритмией, хронической сердечной недостаточностью, инфарктом миокарда.
В терминальной стадии гемохроматоза развивается портальная гипертензия, асцит, кахексия. Гибель пациентов, как правило, наступает вследствие кровотечения из варикозно расширенных вен пищевода, печеночной недостаточности, острой сердечной недостаточности, диабетической комы, асептического перитонита, сепсиса. Гемохроматоз значительно увеличивает риск развития рака печени (гепатоцеллюлярной карциномы).
Диагностика гемохроматоза
В зависимости от преобладающих симптомов пациенты с гемохроматозом могут обращаться за помощью к различным специалистам: гастроэнтерологу, кардиологу, эндокринологу, гинекологу, урологу, ревматологу, дерматологу. Между тем, диагностика заболевания едина при различных клинических вариантах гемохроматоза. После оценки клинических признаков больным назначается комплекс лабораторно-инструментальных исследований, позволяющих убедиться в правомерности диагноза.
Лабораторными критериями гемохроматоза служат значительное повышение уровня железа, ферритина и трансферрина в сыворотке крови, увеличение выведения железа с мочой, снижение общей железосвязывающей способности сыворотки крови. Диагноз подтверждается с помощью пункционной биопсии печени или кожи, в образцах которых обнаруживается отложение гемосидерина. Наследственная природа гемохроматоза устанавливается в результате проведения молекулярно-генетической диагностики.
С целью оценки тяжести поражения внутренних органов и прогноза заболевания исследуются печеночные пробы, уровень глюкозы крови и мочи, гликозилированный гемоглобин и др. Лабораторная диагностика гемохроматоза дополняется инструментальными исследованиями: рентгенографией суставов, ЭКГ, ЭхоКГ, УЗИ органов брюшной полости, МРТ печени и др.
Лечение гемохроматоза
Основной целью проводимой терапии служит удаление избытка железа из организма и недопущение развития осложнений. Больным с гемохроматозом назначается диета, предусматривающая ограничение пищевых продуктов с высоким содержанием железа (яблок, мяса, печени, гречневой крупы, шпината и пр.), легкоусвояемых углеводов. Запрещается прием мультивитаминов, аскорбиновой кислоты, БАДов, содержащих железо, алкоголя. Для выведения избытков железа из организма прибегают к кровопусканиям под контролем показателей гемоглобина, гематокрита крови, ферритина. С этой же целью могут использоваться экстракорпоральные методы гемокоррекции – плазмаферез, гемосорбция, цитаферез.
Патогенетическая медикаментозная терапия гемохроматоза основана на внутримышечном или внутривенном введении пациенту дефероксамина, связывающего ионы Fe3+. Одновременно проводится симптоматическое лечение цирроза печени, сердечной недостаточности, сахарного диабета, гипогонадизма. При выраженной артропатии определяются показания к проведению артропластики (эндопротезирования пораженных суставов). У пациентов с циррозом решается вопрос о проведении трансплантации печени.
Несмотря на прогрессирующее течение заболевания, своевременная терапия позволяет продлить жизнь пациентов с гемохроматозом на несколько десятилетий. При отсутствии лечения средняя продолжительность жизни больных после диагностики патологии не превышает 4-5 лет. Наличие осложнений гемохроматоза (главным образом, цирроза печени и застойной сердечной недостаточности) является прогностически неблагоприятным признаком.
При наследственном гемохроматозе профилактика сводится к проведению семейного скрининга, раннему выявлению и началу лечения заболевания. Избежать развития вторичного гемохроматоза позволяет рациональное питание, контроль за назначением и приемом препаратов железа, проведением переливаний крови, отказ от приема алкоголя, наблюдение за больными с заболеваниями печени и системы крови.
Читайте также:
