Кости при эмболии - лучевая диагностика
Обновлено: 29.04.2024
Эмболия – это жизненноопасная сосудистая патология артериального русла, при которой происходит частичное или полное перекрытие просвета, нарушение кровотока и развитие серьезных осложнений. Закупорка сосуда может происходить оторвавшимся от венозных стенок тромбом, частичками жировой ткани, пузырьками газа, образующимися при попадании воздуха в вены, а также инородными телами, являющимися посторонними для организма веществами. Частичная или полная окклюзия, развивающаяся на фоне эмболии, становится причиной нарушения нормального кровообращения, вследствие чего ткани организма начинают испытывать дефицит кислорода и жизненно важных веществ. Лечение эмболии может быть консервативным или хирургическим, все зависит от вида патологии и характера ее течения.
Что такое эмболия?
Эмболия сосудов – патологическое расстройство, при котором к системе кровообращения циркулируют частицы разной природы, которые в норме должны полностью отсутствовать в кровяном русле. Частицы, называемые эмболами, могут стать причиной внезапной закупорки сосудов, что неминуемо приводит к нарушению местного кровоснабжения. Развивается гипоксия тканей, сопровождающаяся нарушением их функционирования, вплоть до гибели.
Виды эмболии
В основу классификации патологии положены разновидностиэмболов и их окончательная локализация после прекращения движения по кровеносной системе. Каждый вид эмболии имеет свою природу, симптоматику, отличаются и методы терапии, применяемые для устранения проблемы.
Жировая эмболия
- головной и спинной мозг;
- легкие;
- сердечная мышца.
Воздушная и газовая эмболия
Развивается в результате перекрытия сосуда пузырьками воздуха или газа. Это случается при повреждении крупных вен в результате травмирования. Если вовремя не закрыть рану и не остановить кровотечение, это может стать причиной засасывания в просвет воздуха, который, проникнув в кровоток, попадает в сердце и разносится по всему артериальному руслу.
Газовая эмболия возникает в результате резкого перепада атмосферного давления. С такими ситуациями сталкиваются аквалангисты. Если дайвер быстро всплывает из большой глубины, вдыхаемая им газовая смесь не успевает усвоиться настолько быстро, как это происходит на большой глубине. В результате пузырьки воздуха не растворяются в крови, перекрывая мелкие сосуды по всему организму, развивается кесонная болезнь. Через несколько минут после всплытия у аквалангиста могут возникнуть признаки инсульта или произойти потеря сознания. Газовая эмболия является распространенной причиной смерти среди аквалангистов.
Легочная эмболия
- окклюзия мелких ветвей легочной артерии;
- эмболия долевых или сегментарных ветвей;
- массивная закупорка, при которой кровяной сгусток перекрывает главный ствол легочной артерии или одну из основных ветвей.
Эмболия артерий и сосудов
Самыми опасными ее формами являются тромботические поражения артериальных сосудов головного мозга, почек, кишечника. Во всех случаях окклюзии крупных магистральных сосудов в течении короткого времени развивается некроз тканей, приводящий к отмиранию определенных участков органа. такие осложнения приводят либо к глубокой инвалидизации, либо к гибели больного.
Эмболии периферических артерий конечностей протекают намного легче. Их проще диагностировать и начать своевременное лечение, которое позволяет предупредить тяжелые осложнения. При отсутствии лечения развивается некроз тканей конечности и гангрена. Единственным выходом, позволяющим спасти жизнь больного в такой ситуации, является ампутация пораженной конечности.
Кости при эмболии - лучевая диагностика
Рентгенограмма, МРТ при синдромах Марфана и Элерса-Данлоса
а) Определения:
• Синдром Марфана (МФ): семейное заболевание, обусловленное пороком развития соединительной ткани с поражением опорно-двигательного аппарата, глаз и сосудов, но с вариабельной фенотипической экспрессией
• Синдром Элерса-Данлоса (ЭД): наследственное заболевание соединительной ткани с различными фенотипическими проявлениями (множество синдромов)
б) Визуализация:
1. Непропорциональное удлинение конечностей (МФ, ЭД):
• Особенно кистей, стоп (арахнодактилия) в 89% случаев
2. Слабость связочного аппарата (МФ, ЭД):
• Патологическое искривление возможно в нескольких областях:
о Чаще возникает сгибательная деформация 5-го пальца (90°)
о Рекурвация коленного сустава, высокое стояние надколенника
• Реже нестабильность запястья
• Плоская стопа, вальгусная деформация большого пальца, молоткообразная деформация пальцев стопы
• Нестабильность суставов, вероятно обусловливающая хронические состояния:
о Повторяющаяся субклиническая травма
о Выпоты, гемартроз (ЭД>МФ)
о Ранний остеоартрит (ЭД>МФ)
• Вывихи суставов (наколенник, тазобедренный сустав, нижняя челюсть, ключица, пальцы) ЭД>МФ
• Протрузия вертлужной впадины

(Слева) Рентгенография кистей в ЗП проекции: определяется арахнодактилия при отсутствии других изменений. Наблюдается аномальный метакарпальный индекс.
(Справа) Рентгенография в боковой проекции, этот же пациент: определяется неровность задней поверхности тел позвонков. Плотность кости нормальная. На уровне позвонков L5-S1 был выявлен двусторонний спондилолизис с IV степенью спондилолистеза (изображение не представлено). Аномалии позвоночника в сочетании с арахнодактилией могут наблюдаться как при синдроме Марфана, так и при синдроме Элерса-Данлоса: в этом случае диагностирован синдром Марфана.
3. Мягкие ткани: различные проявления при МФ, ДМ:
• МФ: худощавость, атрофия мышц, скудная жировая клетчатка
• ЭД: подкожные кальцификации (некроз жировой ткани) в сочетании с повышенной частой гетеротопической оссификации
• При МРТ определяется слабость связочного аппарата, разрывы сухожилий, тендинопатия
4. Позвоночник (МФ, ЭД):
• Сколиоз (40-60%): картина схожа с идиопатическим сколиозом
• Неровность задней поверхности тел позвонков с эктазией твердой мозговой оболочки (63%):
о Также могут наблюдаться расширение отверстий, нарушение морфологии крестца
• Спондилолизис со спондилолистезом
• Подвывих атланто-аксиального сочленения (редко)
5. Грудная клетка (МФ, ЭД):
• Воронкообразная или килевидная деформация грудной клетки
6. Другие признаки:
• Плотность кости (МФ, ЭД): нормальная
• Эпифизиолиз головки бедренной кости (МФ, ЭД): ↑ частота встречаемости
в) Дифференциальная диагностика синдромов Марфана и Элерса-Данлоса:
1. Гомоцистинурия:
• Схожие признаки: непропорциональность длины конечностей, арахнодактилия и гиперподвижность суставов
• Клиническим признаком для дифференциального диагноза является задержка умственного развития
• Диффузная остеопения наблюдается при гомоцистеинурии, но не при других состояниях
• Большее число контрактур суставов
• Различный характер поражения глаз: двусторонний нижний вывих хрусталиков, возникающий в раннем детском возрасте
• Иной характер поражения сосудов: тромбоэмболия

(Слева) Рентгенография в ПЗ проекции: плоская стопа, обусловленная болезнью Марфана. Наблюдается пронация переднего отдела стопы, определяемая по отклонению оснований плюсневых костей. Также имеется просвет между клиновидными костями, что говорит об ослаблении связок.
(Справа) МРТ Т2ВИ, режим подавления сигнала от жира, корональный срез: у этого же пациента определяется растяжение межклиновидных и межплюсневых связок В, что приводит к аномальному просвету между клиновидными и плюсневыми костями. На других изображениях (не представлены) определялись разрывы сухожилий, все это вносит вклад в формирование клинически плоской стопы, характерной для болезни Марфана.
г) Патология. Общая характеристика:
• Генетика:
о Синдром Марфана: обычно аутосомно-доминантный тип наследования; в 20-30% обусловлен спонтанными мутациями:
- Мутации в локусе (15q15-15q21) длинного плеча XV хромосомы (MFS1)
о ЭД: сложная классификационная система:
- Множество генетических дефектов, влияющих на синтез коллагена (не менее 19 фокусов минимум в 12 генах)
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Синдром Марфана:
- Высокий рост, худощавость (> 95-го перцентиля)
- Непропорциональная длина конечностей относительно туловища):
Кисти, стопы > нижние конечности > верхние конечности
- Поражение сосудов:
Кистозный медионекроз с расслоением и разрывом аорты
Расширение проксимального отдела восходящей аорты → недостаточность аортального клапана и расширение венечных пазух
Медионекроз основной легочной артерии (менее часто)
Недостаточность аортального и митрального клапанов
- Поражение глаз:
Патологическое изменение подвешивающих связок → двусторонний вывих хрусталиков (в верхнем направлении) в 57% случаев
Также наблюдаются страбизм и отслоение сетчатки
о Диагностика синдрома Элерса-Данлоса основана на наличии клинической триады:
- Хрупкость кожных покровов:
Кожу можно приподнять с формированием высокой складки; со временем складки становятся постоянными; кожа легко рубцуется
- Гипермобильность суставов
- Хрупкость сосудов:
Желудочно-кишечные, кожные и бронхолегочные кровотечения
Спонтанное расслоение аорты или крупных сосудов, смерть от потери крови
- Встречается поражение глаз, но двусторонний вывих хрусталиков встречается менее часто, чем при МФ
2. Демография:
• Возраст:
о Симптомы часто не проявляются до детского возраста
• Эпидемиология:
о Синдром Марфана: 4-6 на 100000 новорожденных
3. Течение и прогноз:
• Средний возраст смерти при синдроме Марфана 28 лет; смерть вызвана сердечно-сосудистыми заболеваниями
4. Лечение:
• Устранение проблем, связанных с сердечно-сосудистой системой и органами зрения
• Реконструкция нестабильных слабых связок
е) Список использованной литературы:
1. Hammarstedt JE et al: Arthroscopic ligamentum teres reconstruction of the hip in Ehlers-Danlos syndrome: a case study. Hip Int. 0, 2015
ОГК. Тромбоэмболия легочной артерии: алгоритмы диагностики и лечения. +
Тромбоэмболия легочной артерии (ТЭЛА) — окклюзия ствола или основных ветвей легочной артерии частичками тромба, сформировавшимися в венах большого круга кровообращения или правых камерах сердца и занесенными в легочную артерию с током крови. ТЭЛА является одной из основных причин госпитализации, смертности и потери трудоспособности. ТЭЛА занимает третье место в ряду наиболее частых причин смерти, второе — в ряду причин внезапной смерти и является наиболее частой причиной госпитальной летальности. Ежегодно от ТЭЛА умирает 0,1 % населения.
Истинная распространенность ТЭЛА неизвестна, так как диагностика заболевания затруднена и часто ТЭЛА выявляется при вскрытии, предположительно составляет 1–2 случая на 1000 человек в год, при возрасте старше 75 лет — до 10 случаев на 1000 человек в год. Согласно имеющимся статистическим данным, частота выявления новых случаев ТЭЛА среди госпитализированных пациентов в США превышает 600 000 случаев в год, а распространенность по Англии и Шотландии — 65 000 случаев, во Франции регистрируется 100 000 случаев ТЭЛА в год. В Украине отсутствует достоверная статистика по ТЭЛА, однако гипотетически должно наблюдаться до 50 000–100 000 случаев в год. Большинство случаев ТЭЛА возникает в стационарах, при этом 70–80 % приходится на долю терапевтических пациентов. Смертность от ТЭЛА составляет около 15 % в реальной клинической практике, а при несвоевременной диагностике и отсутствии терапии превышает 30 %.
В то же время от 27 до 68 % этих смертей потенциально предотвратимы, и адекватная антикоагулянтная терапия позволяет достичь значительного снижения показателя летальности (до 2–8 %). ТЭЛА не является самостоятельным заболеванием — зачастую она представляет собой осложнение различных болезней, травм и оперативных вмешательств.
Иногда очень сложно различить тромбоэмболию и локальный тромбоз в системе легочной артерии, поэтому их рассматривают как единый симптомокомплекс.
Клиническая картина заболевания неспецифична и характеризуется полиморфизмом признаков — от выраженных гемодинамических нарушений и развития острой правожелудочковой недостаточности до бессимптомного течения. При жизни заболевание диагностируется в 50–70 % наблюдений, гипердиагностика имеет место в 65 % случаев.Огромное значение в своевременной диагностике ТЭЛА имеет настороженность врача, основанная на оценке факторов риска и клинических симптомов заболевания.
Основным в подозрении на ТЭЛА является знание факторов риска ее развития. В настоящее время принято рассматривать ТЭЛА и тромбоз глубоких вен (ТГВ) как проявления одного заболевания. Еще в 1856 году Рудольф Вирхов описал триаду факторов, которые приводят к внутрисосудистому тромбообразованию: 1) повреждение сосудистой стенки; 2) повышенная свертываемость крови; 3) замедление кровотока. Говоря о возможных факторах риска развития ТЭЛА, сразу необходимо провести деление на первичные (генетически заложенные) и вторичные (приобретенные при определенной патологии или ее осложнениях) факторы риска.
Наиболее известными первичными факторами риска являются фактор V Лейдена и мутация протромбина 20210. Замена аргинина на глутамин в положении 506 (Arg506 ® Gln) — фактор V Лейдена — наиболее распространенная генетическая коагулопатия, в США встречается у 5 % европеоидной популяции. Фактор V Лейдена повышает риск венозного тромбоза в 3–8 раз. Протромбин G ® A 20210 мутация. Мутация протромбина 20210 — второе наиболее распространенное генетическое нарушение. Около 2 % всего населения являются гетерозиготами с этой мутацией.
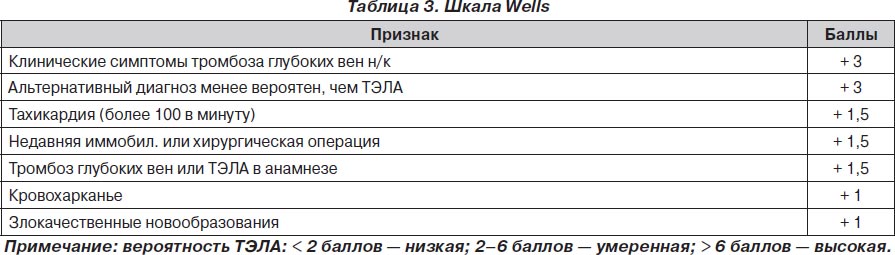
Наличие вторичных факторов риска развития ТЭЛА соответствует риску развития тромбоза глубоких вен (ТГВ), который напрямую связан с развитием ТЭЛА. Риск развития ТГВ и ТЭЛА в большей степени связан с обездвижением больного — как при хирургической патологии (травмы и переломы, наличие катетера в центральной вене, хроническая венозная недостаточность, хирургические вмешательства, иммобилизация, злокачественные новообразования), так и при сердечной недостаточности, развитии инсульта, ожирении и просто пожилом возрасте. С целью более адекватной диагностики ТЭЛА были предложены различные шкалы для подтверждения вероятности ее развития. Одной из наиболее используемых из этих шкал был Женевский счет клинической вероятности ТЭЛА. В данной шкале все факторы риска развития ТЭЛА распределялись по баллам, а суммарное количество баллов говорило о величине вероятности развития ТЭЛА у конкретного пациента.


Наиболее показательным было сравнение Женевского счета и счета Wells, так как они оказались самыми прогностически точными подсчетами в диагностике ТЭЛА. Сравнение этих двух таблиц показало, что при низкой (6 против 9 %) и средней (23 против 26 %) вероятности развития ТЭЛА данные шкалы риска не различались. При диагностике с высокой вероятностью развития ТЭЛА Женевский счет превосходил счет Wells почти в два раза — 49 против 76 %.
Патогенез ТЭЛА
Начальным этапом тромбогенеза в большинстве случаев является повреждение эндотелия стенки сосудов. Известно, что эндотелий имеет мощное влияние на состояние коагуляционного гемостаза. В норме клетки эндотелия синтезируют эндотелин, простациклин, оксид азота — вещества, предупреждающие спазм сосудов, тормозящие адгезию и агрегацию тромбоцитов и предупреждающие тромбообразование. Кроме того, эндотелиальные клетки выделяют тканевый активатор плазминогена, который инициирует фибринолиз в ответ на тромбообразование. При повреждении, наряду с угнетением защитного влияния эндотелия на свертывающие свойства крови, происходит высвобождение в кровоток прокоагулянтных веществ, в частности фактора Виллебрандта, который образует мостик между тромбоцитами и коллагеном, а также микрофибриллами субэндотелия. Кроме того, обнаженный субэндотелиальный слой сосудов сам становится мощным стимулятором адгезии и агрегации тромбоцитов, из которых высвобождается ряд биологически активных веществ (АДФ, серотонин, фактор 3, тромбопластин и другие). Активация тромбоцитов стимулирует запуск коагуляционного каскада с участием всех факторов свертывания крови с образованием тромбина, превращением фибриногена в фибрин и приводит к формированию фибрин-тромбоцитарного тромба.
В генезе респираторных и гемодинамических расстройств, выраженности клинических проявлений и степени тяжести заболевания при ТЭЛА ведущее значение имеют механическая обструкция артериального русла легких и нейрогуморальная реакция. Тромб от места возникновения переносится с током крови в правый желудочек (ПЖ), где частично разрушается и в виде отдельных фрагментов попадает в малый круг кровообращения. Поэтому в большинстве случаев имеют место множественные окклюзии нескольких ветвей легочной артерии (ЛА) различного калибра, часто двусторонняя — немассивная ТЭЛА. В более редких случаях происходит массивная тромбоэмболия главных ветвей или ствола ЛА, которая сопровождается острым развитием тяжелой клинической картины тромбоэмболии, в частности быстро наступающей внезапной сердечной смертью. При субмассивной ТЭЛА эмболизируются долевые и сегментарные ветви ЛА. Действие гуморальных факторов не зависит от размеров тромба, поэтому эмболия даже мелкой ветви ЛА может привести к значительным нарушениям гемодинамики. Это объясняет частое несоответствие между объемом эмболической окклюзии легочных сосудов и тяжестью клинической картины ТЭЛА.
Гемодинамические расстройства

Вследствие частичной или полной механической обструкции легочно-артериального русла тромбоэмболом происходит резко выраженный генерализованный спазм артериол малого круга (прекапиллярная гипертензия) за счет барорефлекса и высвобождение вазоконстрикторных субстанций (тромбоксана А2, серотонина, гистамина и других) из тромбоцитов, которые оседают на поверхности тромбоэмболов. В результате легочное сосудистое сопротивление значительно возрастает, развивается легочная гипертензия. У больных без сопутствующих заболеваний сердца и легких острая гипертензия малого круга кровообращения возникает при обструкции 40–50 % легочного артериального русла. Окклюзия 60–75 % легочной циркуляции является критической и приводит к острой правожелудочковой недостаточности и резкому снижению объема циркулирующей крови. Необходимо отметить, что при ТЭЛА степень окклюзии просвета сосуда со временем может увеличиваться за счет присоединения вторичного местного тромбоза, который увеличивает размеры тромбоэмбола, распространяясь против тока крови. Нередко это приводит к трансформации немассивной ТЭЛА в массивную. При первом эпизоде субмассивная и даже массивная ТЭЛА не приводит к внезапной смерти, систолическое давление в ЛА часто относительно невысокое (40–50 мм рт.ст.). Негипертрофированный ПЖ не может обеспечить систолическое давление более 70 мм рт.ст. Высокие значения систолического давления в ПЖ свидетельствуют о постепенном формировании легочной гипертензии в результате нескольких эпизодов ТЭЛА или о наличии хронической легочной гипертензии другого генеза. Рост легочного сосудистого сопротивления сопровождается увеличением напряжения в стенке ПЖ и его дилатацией, в результате чего межжелудочковая перегородка выпячивается в левый желудочек и сужает его просвет, а сжатие правой коронарной артерии вызывает ишемию, а иногда и инфаркт миокарда ПЖ.
Повышение легочного сосудистого сопротивления и чрезмерная нагрузка на ПЖ (увеличение постнагрузки) на фоне значительного уменьшения емкости артериального русла (уменьшение преднагрузки) приводит к значительному ограничению венозного возврата крови в левые отделы сердца и развитию синдрома малого сердечного выброса. Происходит уменьшение минутного объема, сердечного индекса, уровня АД, нарушение кровоснабжения жизненно важных органов (головного мозга, сердца, почек). Нарушения центральной гемодинамики при ТЭЛА могут быть разной степени выраженности: от умеренной дилатации ПЖ с компенсаторной гиперфункцией и без существенного уменьшения сердечного выброса в состоянии покоя до обструктивного кардиогенного шока с высоким центральным венозным давлением и пониженным АД вследствие нарушения наполнения ЛЖ в диастолу. Это может привести к уменьшению коронарного кровотока и ухудшить перфузию миокарда, преимущественно ПЖ.

В некоторых случаях возможно возникновение острого отека легких, имеющего сложный патофизиологический механизм. Одной из причин может быть резкая дилатация ПЖ, приводящая к сдавливанию левого желудочка и повышению давления в левом предсердии, что углубляет легочную гипертензию. Кроме того, имеет значение увеличение легочного кровотока по неокклюзированным ветвям ЛА.
Респираторные расстройства
Полное или частичное прекращение легочного кровотока в результате ТЭЛА приводит к выраженному нарушению вентиляционно-перфузионного соотношения, в результате чего развиваются дыхательная недостаточность и артериальная гипоксемия. В результате прекращения кровотока в хорошо вентилируемых альвеолах происходит увеличение внутрилегочного «мертвого пространства» и ухудшение газообмена. Нарушение вентиляционно-перфузионных отношений усиливается выраженным бронхоспазмом, связанным с действием на гладкую мускулатуру мелких бронхов биологически активных веществ, выделяемых из тромбоцитов (тромбоксан А2, серотонин и другие). Кроме того, в результате ишемии альвеол, обусловленной их недостаточной перфузией, нарушается не только их вентиляция, но и выработка сурфактанта, что уже через 1–2 суток после тромбоэмболии может привести к развитию ателектазов. Вследствие недостаточности кровоснабжения альвеол может развиться инфаркт легкого. Кроме того, снижение вентиляции альвеол с сохраненной перфузией еще больше нарушает газообмен в легких и приводит к усилению артериальной гипоксемии. Наконец, в результате повышения давления проксимальнее места окклюзии открываются артериоло-венозные анастомозы и происходит шунтирование крови из артериол в вены, что также увеличивает артериальную гипоксемию.
При альвеолярно-интерстициальном отеке легких происходит стимуляция юкстакапиллярных рецепторов в альвеолярно-капиллярной мембране. Это приводит к повышению вагусной афферентной активности с последующей стимуляцией респираторных нейронов продолговатого мозга, в результате чего возникает гипервентиляция и гиперкапния. Следует подчеркнуть, что далеко не всегда при ТЭЛА присутствуют все описанные нарушения гемодинамики и альвеолярной вентиляции. Это зависит прежде всего от массивности тромбоэмболии, локализации тромбоэмболий и исходящего кардиопульмонального статуса больного. Рецидивирующая окклюзия крупных легочных артерий вызывает развитие тяжелой гипертензии малого круга кровообращения и развитие хронического легочного сердца. Степень выраженности хронической легочной гипертензии зависит от многих факторов: полноты спонтанного или медикаментозного лизиса тромба, рецидивирования ТЭЛА, образования тромбов вокруг участка первичной тромбоэмболии, процессов организации и внутрисосудистого ремоделирования тромбов, перестройки микроциркуляторного русла легких.
Классификация ТЭЛА
Международная классификация, разработанная Европейским кардиологическим обществом в 2000 году, предусматривает выделение 2 основных групп ТЭЛА — массивной и немассивной.
ТЭЛА расценивается как массивная, если у пациентов развиваются явления кардиогенного шока и/или гипотензия (снижение систолического АД ниже 90 мм рт.ст. или снижение на 40 мм рт.ст. и более от исходного уровня, которое длится более 15 минут и не связано с гиповолемией, сепсисом, аритмией). Массивная ТЭЛА развивается при обструкции сосудистого русла легких более 50 %.
Немассивная ТЭЛА диагностируется у пациентов со стабильной гемодинамикой без выраженных признаков правожелудочковой недостаточности. Немассивная ТЭЛА развивается при обструкции сосудистого русла легких менее 50 %.
Среди пациентов с немассивной ТЭЛА при условии выявления признаков гипокинезии правого желудочка (при проведении эхокардиографии) и стабильной гемодинамики выделяется подгруппа — субмассивная ТЭЛА. Субмассивная ТЭЛА развивается при обструкции сосудистого русла легких не менее 30 %.
По остроте развития выделяют следующие формы ТЭЛА:
— острая — внезапное начало, боль за грудиной, одышка, снижение артериального давления, признаки острого легочного сердца, возможно развитие обструктивного шока;
— подострая — прогрессирование дыхательной и правожелудочковой недостаточности, признаки тромбинфарктной пневмонии;
— хроническая, рецидивирующая — повторные эпизоды одышки, признаки тромбинфарктной пневмонии, появление и прогрессирование хронической сердечной недостаточности с периодами обострений, появление и прогрессирование признаков хронического легочного сердца.
Метастазы в кости
Метастазы в костях могут развиться абсолютно при любом злокачественном процессе, для некоторых раков это практически обязательная локализация, при других заболеваниях — редкость. В метастатическом рейтинге первое место по частоте встречаемости достанется метастазам в лёгкие, второе — печеночным очагам и третье — скелетным метастазам.

Метастазы в костях трудно лечатся и обещают боли, тем не менее, скелетные очаги менее прочих локализаций опухоли сокращают жизнь, но способны испортить её переломом или сдавлением спинного мозга.
Какими могут быть метастазы в костях?
По клинико-рентгенологическим признакам все костные очаги подразделяют на три группы:
- остеобластические — с преобладанием уплотнения сверх физиологической меры, но дополнительно наросшая опухолевая ткань не придаёт кости прочности и может сдавливать проходящие по соседству нервы;
- остеолитические — превалирует разрушение структуры и вероятность перелома увеличивается по мере разрастания рака;
- смешанные — сочетание двух видов и это ситуация встречается чаще всего.
Практически не случает такого, чтобы у пациента были исключительно остеолитические или только остебластические очаги, как правило, диагностируется сочетание с превалированием либо разреженной литической, либо избыточной бластической структуры.
При каких раках развиваются?
Лидер среди всех злокачественных процессов, протекающих с метастатическим поражением скелета, миеломная болезнь — разрушение кости начинается в самом начале заболевания и в 100% клинических случаев отмечается множественная деструкция костной ткани.
При раке молочной и предстательной желёз у двух третей больных диагностируются скелетные метастазы, а патологоанатомические наблюдения выявляют вовлечение костей в злокачественный процесс практически у 90% пациентов. При раке молочной железы (РМЖ) превалируют смешанные и остеолитические варианты, при раке простаты — остеобластические.
Высокая частота метастазирования в кости отмечается при раке легкого, но при мелкоклеточном варианте — вдвое чаще и множественные костные дефекты, тогда как при немелкоклеточном — у 40% больных с тяготением к очагам единичным или солитарным, то есть единственному.
Каждый четвёртый, страдающий раком почки, имеет скелетные метастазы, при карциноме мочевого пузыря костные новообразования встречаются много реже.
При раке толстой кишки костное метастазирование выявляется у каждого восьмого больного, при раке желудка — не часто, поскольку раньше и обильнее рак поражает печень и брюшную полость. Рак кишечника тяготеет к мелкоочаговым и множественным вторичным образованиям.
Когда появляются скелетные метастазы?
При злокачественных процессах время появления метастазов в кости различается, тогда как скорость роста очага зависит исключительно от индивидуальных биологических характеристик опухолевой ткани, меняющихся под воздействием лечения и по мере раковой диссеминации.
При первичном обращении костные очаги при отсутствии других проявлений ракового процесса имеются едва ли у 20% пациентов, в подавляющем большинстве случаев опухолевое поражение костей признак диссеминации рака — распространения по системам или генерализации. При РМЖ, немелкоклеточной карциноме легких и раке толстой кишки именно так и происходит.
При раке предстательной железы нередко скелетная патология обнаруживается одновременно с опухолью простаты или в ближайшие сроки после диагностики неблагополучия в половой железе.
При карциноме почки часто сначала находят метастазы в костях и легочной ткани, а после обнаруживается первичная опухоль.
Какие отделы скелета поражаются чаще всего?
Локализация метастаза в кости определяется не нозологической принадлежностью первичной злокачественной опухоли, а функциональной нагрузкой и связанной с нею развитостью кровоснабжения. Множественные очаги в скелете более характерны для высоко агрессивного рака, единичные и тем более один метастаз свидетельствует в пользу благоприятного прогноза заболевания.

- Чаще всего вторичные отсевы рака возникают в обильно питаемых кровью губчатых костях — позвонках, причём преимущественно в испытывающих высокую нагрузку поясничных и грудных отделах позвоночника.
- Далее по частоте следуют метастазы в костях таза — почти половина всех случаев, типичные локализации — подвздошная и лонные кости.
- Вполовину реже отмечается метастазирование в костях черепа и нижней конечности, где превалирует поражение бедренной кости.
- Грудная клетка, преимущественно ребра и грудина, вовлекаются в злокачественный процесс практически в 30% случаев.
Клинические проявления костного метастазирования
Вопреки сложившимся мифам, скелетное метастазирование часто протекает без выраженной боли и даже вовсе без симптомов. Остеобластические очаги реже сопровождаются болевыми ощущениями, нежели остеолитические.
Опасные проявления метастатического костного поражения:
- гиперкальциемия — значительное повышение концентрации кальция из-за разрушения костного матрикса приводит к тяжелейшему состоянию, требующему коррекции метаболизма фактически реанимационными мерами;
- перелом — для возникновения достаточно разрушения половины поперечника кости или позвонка, каждому одиннадцатому пациенту с патологическим переломом необходима срочная хирургическая помощь;
- синдром сдавления или компрессии спинного мозга осколками сломанного грудного или поясничного позвонка осложняется тяжелыми неврологическими нарушениями ниже зоны повреждения;
- нарушение двигательной активности вплоть до паралича возможно при сдавлении спинного мозга в шейном отделе остеобластическим очагом или повреждении отломками при литическом разрушении.
Осложнения метастазирования в кости фатально отражаются на состоянии пациента и активно мешают проведению адекватного лечения, что может сократить срок жизни при безусловном отсутствии качества.
Почему возникает боль?
Боль обусловлена тремя причинами:
- разрушением раковым конгломератом обильно иннервированной надкостницы;
- раздражением в надкостнице болевых рецепторов биологически активными продуктами жизнедеятельности раковых клеток;
- вовлечением в метастатический узел нервных окончаний мышц.
Невыносимая боль далеко не всегда связана со скелетным метастазированием, как правило, это следствие высокой агрессивности опухолевых клеток в терминальной стадии процесса, когда в крови огромна концентрация биологически активных веществ — цитокинов, которые буквально «жгут» нервные окончания даже не поражённых опухолью тканей.
При высокой степени злокачественности первичной опухоли болевой синдром отмечается чаще и более интенсивный. Наиболее наглядный пример, распространенные и постоянные боли в абсолютно целых костях при аденокарциноме легкого, операция с удалением пораженного легкого полностью излечивает боль.
Как обнаруживают метастазы в кости?
Диагностика скелетных повреждений не сложная, но высокотехнологичная, начинают с изотопного обследования — остеосцинтиграфии, выявляющей минимальные раковые новообразования. Затем засвеченные изотопом «горячие очаги» подвергают рентгенографии или, что лучше, компьютерной томографии (КТ). ПЭТ — «королева» доказательств, к сожалению, дорогое исследование, поэтому для контроля эффективности терапии не очень подходит.

Для выявления очагов в скелете маркеры костной резорбции не подходят, в практической онкологии активного применения не нашли.
Анализы крови позволяют заподозрить опухолевое поражение костного мозга, что часто сопровождает метастазирование в грудину.
Лечение скелетных поражений
Можно ли вылечить метастазы в костях? Однозначно лечением можно продлить жизнь при хорошем самочувствии. С одной стороны, скелетные поражения — манифестация распространения рака по организму, с другой — признак относительно благоприятного прогноза заболевания при отсутствии опухоли в других тканях и висцеральных (внутренних) органах, что даёт годы жизни при стабилизации процесса.
На этапе костного метастазирования вопрос о радикальном лечении уже не стоит, но операция не исключается при благоприятной гистологической структуре и солитарном — единственном костном поражении. Так при раке легкого или почки с метастазом в плечевую кость или бедро можно выполнить одномоментное вмешательство с удалением больного органа и резекцией кости с протезированием, но после нескольких месяцев химиотерапии.
Химиотерапия — главный метод лечения костных поражений, лекарственная схема определяется первичной опухолью. При раке молочной и предстательной железы хорошие результаты демонстрирует гормональная терапия.
Дополнение химиотерапии локальным облучением позволяет повысить общий результат терапии, снять боль и уменьшить вероятность перелома. Так при поражении шейных позвонков лучевая терапия обязательна уже на первом этапе.
Операция необходима при угрозе сдавления (компрессии) спинного мозга поломанным позвонком, как правило, удаляется поражённая часть позвонка — ламинэктомия. При длительной — более полугода стабилизации в результате химиотерапии можно поставить вопрос об удалении поражённой кости конечности с заменой на протез, если больше нет других проявлений рака.
Зачем нужны бисфосфонаты?
Использование бисфосфонатов при метастатическом поражении скелета стало стандартом адекватной терапии.

Человеческие кости постоянно обновляются: остекласты разрушают, а остеобласты наращивают ткани, в норме процессы уравновешены, в присутствии злокачественной опухоли остеокласты приобретают избыточную активность. Бисфосфонаты по своему строению схожи с костным матриксом, поэтому после введения в организм направляются в кости, где губительно действуют на активизированные раковыми продуктами остеокласты, параллельно снимая боль и оберегая от переломов.
Бисфосфонатами можно лечиться около двух лет, при утрате чувствительности к ним аналогичную роль выполняет моноклональное тело деносумаб. Демосумаб и бисфосфонаты относят к остеомодифицирующим агентам (ОМА).
Для назначения ОМА недостаточно выявления «горячих» очагов при остеосцинтиграфии, их применяют при доказанном рентгенологическими методами опухолевом поражении.
Химиотерапия и ОМА — основные методы лечения скелетных поражений, но не единственные. Лечение костных метастазов должно быть комплексным, только комбинацией облучения и лекарств, с коррекцией метаболизма и присоединением паллиативной хирургии можно избавить от боли и вернуть пациенту активную жизнь.
Когда и что нужно и возможно в каждом конкретном клиническом случае онкологического заболевания знают специалисты нашей клиники. Узнайте больше, звоните:
Эмболия в артерию

Артериальная эмболия -это перенос тромба (эмбола) из центральных участков кровеносного русла по артерии, который застревает в каком то ее разветвлении и может блокировать или ограничивать приток крови. Эмболы, как правило, блокируют кровоток в руке или ноге. Эмболия - это очень опасное заболевание, так как внезапное прекращение кровотока ниже места его застревания вызывает острую недостаточность кровообращения и приводит к гибели органа или части тела.
Один тромб может вызвать более одной эмболии, если он разделяется на кусочки и разносится кровотоком дальше по артерии. Эмболия требует незамедлительного лечения, так как за короткое время могут развиться необратимые повреждения пораженного органа или конечности.
Причины артериальной эмболии
Ряд заболеваний может привести к артериальной эмболии. Самая частая причина эмболии это мерцательная аритмия, когда не сокращаются предсердия, там возникает застой крови и образование тромбов. В какой-то момент фрагмент этого тромба отрывается и переносится с током крови в какой-либо орган, блокируя в нем кровоток и вызывая острую ишемию.
Другими менее распространенными причинами образования тромбов и эмболии являются:
- Аневризмы артерий (патологическое расширение диаметра сосуда)
- Травма артерии
- Гипертонический криз, с расслоением участка артерии и образованием тромба
Симптомы артериальной эмболии
Симптомы эмболии зависят от места остановки тромба в артерии. Заподозрить тромбоэмболию можно при наличии следующих признаков:
- Резкое похолодание конечности
- Отсутствие пульса
- Затруднение движений
- Покалывание или онемение
- Снижение чувствительности
- Боль или спазмы в мышцах пораженной конечности
- Резкая бледность кожных покровов пораженной конечности
Если кровоток своевременно не восстановлен, то присоединяются следующие симптомы:
- Синюшный или мраморный цвет кожи
- Образование пузырей наполненных кровянистым содержимым
- Отсутствие или резкое уменьшение объема движений
- Отсутствие чувствительности пораженной конечности
- Невозможность даже пассивного движения в суставах (контрактура)
- Признаки ишемической гангрены - распад тканей
Факторы риска тромбоэмболии
Основные факторы риска связаны с наличием заболеваний, способствующих образованию тромбов в артериях и сердце:
- Мерцательная аритмия
- Острый инфаркт миокарда
- Дилатационная кардиомиопатия
- Ожирение
- Аневризмы аорты и крупных артерий
- Сидячий образ жизни
- Пожилой возраст
Исходы тромбоэмболии артерий
Лечение артериальной эмболии должно быть только хирургическое и неотложное. Если операция произведена своевременно, до полной гибели конечности, с использованием современных хирургических и реанимационных технологий, то исходы лечения хорошие. Пораженную конечность удается сохранить у большинства больных. Однако необходимо помнить, что причина эмболии должна быть выяснена и приняты меры для профилактики повтора этого тяжелого осложнения.
Читайте также:
