Трансляция мРНК. Особенности трансляции мРНК при синтезе антител
Обновлено: 18.05.2024
Трансляция - это процесс, в результате которого рибосомы считывают генетическую информацию матричных РНК и создают белковый продукт в соответствии с этой информацией.
Специфические молекулы транспортрых РНК (тРНК) служат посредниками между кодом мРНК и конечной белковой последовательностью. В их состав входит последовательность, узнающая код мРНК и соответствующая этому коду аминокислота.
События трансляции разделяют на последующие события: инициацию, элонгацию и терминацию. На стадии инициации рибосома связывает мРНК и первая аминокислота присоединяется к рибосоме. Во время элонгации происходит рост полипептидной цепи. На стадии терминации рибосома отделяется от мРНК и процес трансляции заканчивается. У прокариот и эукариот процессы трансляции схожи, но имеются и существенные различия.
Трансляция происходит в цитоплазме, где находятся рибосомы. В зависимости от дальнейшего преднозначения синтезируемых белков, они могут образовываться либо в цитозоле, либо на поверхности шероховатого эндоплазматического ретикулума.
Полипептидные цепи синтезируются однонаправленно: с амино-конца к карбокси-концу.
При инициации первая и вторая молекулы аминоацил-тРНК спариваются с первыми двумя кодонами мРНК. Далее трансляция продолжается в направлении 5'->3' кодон за кодоном до тех пор, пока не достигнет стоп-сигнала, расположенного сразу же за кодоном, детерминирующим С-концевую аминокислоту.
К сожалению, список литературы отсутствует.
Генетический код
Трансляция у эукариот
Вместо комплементарного РНК-РНК узнавания, в которое вовлечена прединициирующая последовательность Шайна-Дальгарно прокариотических мРНК, эукариотические мРНК узнаются эукариотическими рибосомами по кэпированному 5'-концу с обязательным участием белка, например, eIF-4F инициаторного фактора ( Rhoads, 1988 ). Предполагается, что этот белок участвует в расплавлении вторичных структур 5'- областей мРНК, облегчая их связывание с малыми субчастицами рибосом. В отличие от прокариот, эукариотическая мРНК образует комплексы с белками ( мРНП , или мессенджер-рибонуклеопротеиды, или информосомы ), что обусловливает ее метаболическую стабильность. Вследствие этого у эукариот отсутствует постоянная интенсивная деградация и интенсивный ресинтез мРНК, которые, как правило, моноцистронны и имеют специфически модифицированный (кэпированный) 5'-конец. Все это обусловливает целый ряд особенностей инициации трансляции и ее регуляции у эукариотических организмов. Естественно, что метаболическая стабильность эукариотической мРНК делает регуляцию на уровне трансляции особенно важной в общей картине регуляции биосинтеза белка ( Спирин, 1986 ).
Трансляция у прокариот
Трансляция бактерии E.coli наиболее изучена
Синтез белка происходит на рибонуклеопротеиновом комплексе - рибосоме, в процессе трансляции mRNA. Рибосома состоит из большой и малой субъединиц, которые соединены в области инициации трансляции (translation initiation region -TIR) mRNA во время стадии инициации трансляции. Во время элонгации рибосома скользит вдоль mRNA и синтезирует полипептидную цепь. Элонгация продолжается до тех пор, пока рибосома не достигает стоп-кодона на mRNA - терминация трансляции. После терминации рибосома отделяется от синтезированного полипептида и способна снова повторить цикл трансляции mRNA.
Каждая стадия трансляции имеет свои регуляторные факторы, но у эукариот этих факторов гораздо больше, чем у прокариот.
Инициация
Инициация

Последовательность инициации трансляции у бактерии. 30S и 50S рибосомные субъединицы показаны светлым и темным серым цветом. [Laursen, et al. 2005]
Рибосомы прокариот инициируют трансляцию на мРНК уже во время транскрипции. Время необходимое для посадки рибосом порядка секунд, хотя это зависит от каждой мРНК. Рибосомы транслируют мРНК со скоростью приблизительно 12 аминокислот в секунду.
В инициации трансляции участвуют: рибосома, аминоацилированная и формилированная тРНК (fMet-tRNAf Met ), мРНК и три белковых инициирующих фактора IF1, IF2 и IF3.
Бактериальная 70S рибосома состоит из большой 50S и малой 30S субъединицы. Имеется три tRNA связывающих сайта аминоацил - aminoacyl (A), пептидил - peptidyl (P), и сайт выхода - exit (E). Присоединение фактора IF3 к 30S рибосомной субъединице обеспечивает распад рибосомы на субъединицы. Фактор инициации IF1 связывается с A-сайтом 30S рибосомной субъединицы и служит инициатором присоединения tRNA к рибосомному P-сайту блокируя A-сайт. IF1 стимулирует активность IF3 и также распад рибосомных субъединиц.
После распада субъединиц, IF2, mRNA и fMet-tRNAfMet соединяются с 30S рибосомной субъединицей. Последовательность Шайно-Дальгарно (Shine-Dalgamo -SD) mRNA взаимодействует с anti-SD последовательностью 16S rRNA и инициирующий кодон присоединяется в Р-сайте рибосомы. Инициирующие факторы, особенно IF3, способствуют этому присоединению.
Инициаторная tRNA устанавливается в P-сайте 30S рибосомной субъединицы в три шага не зависимо от кодона, зависимо от кодона и fMet-tRNAfMet присоединение.
Все три шага обеспечиваются фактором IF2, который взаимодействует с fMet-tRNAf Met на рибосоме. IF3 стабилизирует присоединение fMet-tRNAfMet к рибосомному P-сайту и стабилизирует кодон-антикодон взаимодействие.
30S преинициаторный комплекс состояций из 30S рибосомной субъединицы, трех инициаторных факторов, mRNA в стартовой позиции, где fMet-tRNAf Met связана кодон независимо. Такой относительно нестабильный комплекс подвергается конформационному изменению, что обеспечивает кодон-антикодон взаимодействие и формирует более стабильный 30S инициаторный комплекс. Инициаторные факторы IF1 и IF3 отсоединяются, тогда как IF2 фактор стимулирует взаимодействие с 50S рибосомной субъединицей. После сборки рибосомы IF2 покидает комплекс. Во время этого процесса GTP связанный с IF2 гидролизуется до GDP и Pi. Вновь образованный 70S инициаторный комплекс, содержащий fMet-tRNAf Met как субстрат для пептидилтрансферазного центра 50S рибосомной субъединицы готов к вступлению в фазу элонгации трансляции.
Факторы инициации: IF-1, IF-2, IF-3 - белки временно связывающиеся с рибосомой, необходимые для инициации.
Этапы инициации трансляции
1. Факторы инициации IF-1 и IF-3 связываются с 30S-субчастицей, что обеспечивает ее взаимодействие с IF-2, инициаторной формилметиониновой-тРНК (Fmet-тРНКF Met ) и GTP.
2. При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы на две субъединицы.
3. Комплекс 30S-субъединицы со всеми факторами инициации и Fmet-тРНКF Met связывается с 5'-концом мРНК вблизи кодона AUG и узнает. AUG-кодон мРНК.
Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно
за 10 нуклеотидов до 5'-конца инициаторного кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами по следовательности из 5-8н, называемой последовательностью Шайна-Дальгарно, с полипиримидиновым участком, находящимся вблизи 3'-конца 16S-pPHK.
4. Формирование полноценного функционального комплекса инициации завершается ассоциацией 50S-субчастицы с преинициаторным комплексом. При ассоциации 70S-рибосомы образуются два активных центра: Р- и А-участки. Fmet-TPHKF Met занимает Р-участок.
5. С образованием функциональной 70S-субчастицы отделяются все три белка инициации.
Элонгация
Факторы элонгации: EF-Tu и EF-Ts - белки связывающиеся с рибосомой, необходимые для элонгации трансляции.
В процессе инициации образуется 70S-рибосома связанная с мРНК, в Р-центре которой находится Fmet-тPHKF Met
Для образования первой пептидной связи необходимо, чтобы
аминоацил-тРНК, соответствующая следующему кодону, заняла А-центр.
Этапы элонгации трансляции:
1. EF-Tu-GTP связывает все аминоацил-тРНК, кроме Fmet-тPHKF Met , и доставляет их к А-центру комплекса 70S-рибосома-мРНКАминоацил-тРНК связывает EF-Tu и GTP. Образовавшийся комплекс (аминоацил-тРНК-[ЕF-Тu-GТР]) доставляет аминоацил-тРНК к А-участку. GTP гидролизуется, и комплекс (EF-Tu-GDP) отделяется от рибосомы. EF-Ts восстанавливает EF-Tu-GDP.
2. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящейся в А-участке. В результате в А-участке оказывается дипептидил-тРНК, а в Р - свободная тРНК.
3. тРНК освобождает Р-участок, образовавшаяся дипептидил-тРНК переместиться на него, а новый кодон должен быть готов к тому, чтобы занять освободившийся А-участок. Все эти процессы
осуществляются с помощью EF-G при GTP-зависимой транслокации рибосомы.
4. Теперь новый кодон, занявший А-сайт, готов к спариванию с родственной аминоацил-тРНК. Сразу после связывания аминоацил-тРНК с А-
участком высвобождается комплекс EF-Tu-GDP и происходит регенерация функционально активного EF-Tu-GTP. При этом EF-Tu-GDP взаи- модействует с белком EF-Ts, что приводит к отделению GDP и образованию комплекса EF-Tu•EF-Ts. Далее EF-Tu•EF-Ts взаимодействует с GTP, происходит регенерация EF-Tu-GTP и отделение EF-Ts, и оба соединения оказываются готовыми к следую- щему циклу.
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться.
При образовании каждой пептидной связи расходуется энергия, равная четырем энергетическим эквивалентам (если за один эквивалент принять энергию образования фосфатной связи): два эквивалента АТР потребляются при аминоацилировании тРНК и два эквивалента GTP-
в каждом цикле элонгации.
2. При инициации трансляции IF-2 узнает Fmet-тРНКFMet среди всех других аминоацил-тРНК, a EF-Tu отличает met-тРНКF Met от
Fmet-тРНКM Met при внедрении в А-участок.
3. Факторы элонгации EF-Tu и EF-G то присоединяются, то отделяются от рибосомы в зависимости от того, связаны ли они с GTP или с GDP соответственно.
4. Растущая полипептидная цепь всегда соединена своим карбоксильным концом с тРНК, которая соответствует С-концевой аминокислоте в растущей полипептидной цепи.
5. Пептидилтрансфераза катализирует формирование пептидных связей между карбоксильным концом растущей цепи и аминогруппой аминоацил-тРНК.
Терминация
Факторы терминации:
RF-1 вызывает отделение полипептидной цепи при считывании кодонов UAA и UAG;
RF-2 действует аналогичным образом при считывании UAA и UGA,
EF-3 может облегчить работу двух других факторов.
Этапы терминации трансляции:
1. В А-участке оказывается один из трех терминирующих кодонов - UAG, UAA или UGA. Из-за отсутствия тРНК, отвечающих этим кодонам,полипептидил-тРНК остается связанной с Р-участком.
2. RF-1 и RF-2 катализируют отсоединение полипептидной цепи от тРНК, отделение их обоих от рибосомы, а 70S-рибосомы - от мРНК.
RF-1 узнает в А-участке кодон UAA или UAG; RF-2 включается в том случае, когда в А-участке оказы-вается UAA или UGA;
RF-3 облегчает работу двух других факторов. Если терминирующим кодономявляется UAA, то эффективность процесса терминации оказывается наибольшей, поскольку этот кодон узнают оба фактора - RF-1 и RF-2. Однако, каким бы из стоп-кодонов ни обеспечивалась терминация,ее эффективность зависит от фланкирующих эти кодоны последовательностей в мРНК.
Когда расстояние от рибосомы до сайта инициации достигнет величины 100-200 нуклеотидов, в этом сайте может произойти новая инициация трансляции. Таким образом на одной мРНК
может находится несколько транслирующих рибосом - полирибосомы (рис)
Этапы трансляции
Трансляция - процесс перевода генетической информации с последовательности нуклеотидов мРНК в последовательность аминокислот в молекуле полипептида. Трансляция осуществляется согласно правилам генетического кода, который имеет следующие особенности:
1. Код - триплетный, т. е. одну аминокислоту определяет три нуклеотида.
2. Код - однозначный (специфичный): каждый кодон обозначает только одну аминокислоту.
3. Код - непрерывный, т. е. отсутствуют сигналы, показывающие конец одного кодона и начало следующего.
4. Код - вырожденный, т. е. одной аминокислоте может соответствовать более одного кодона. Только две аминокислоты - метионин и триптофан - имеют по одному кодону. Лейцину и серину соответствует 6 кодонов, глицину и аланину - по 4 и т. д. Если аминокислота кодируется несколькими кодонами, то в большинстве случаев они различаются по третьей букве, т. е. по нуклеотиду на 3′-конце. Таким образом, специфичность каждого кодона определяется главным образом его первыми двумя нуклеотидами.
5. Код не перекрывается, т. е. один нуклеотид не может одновременно входить в два соседних триплета.
6. Генетический код содержит триплеты, обозначающие начало и окончание синтеза белка. АУГ - инициирующий кодон (кодирует метионин). УАА, УАГ, УГА - терминирующие кодоны, которые не кодируют ни одну из известных аминокислот и сигнализируют об окончании синтеза белка.
7. Генетический код универсален, т. е. одинаков у животных, растений, многих бактерий.
Подготовительные стадии трансляции включают:
- присоединение аминокислот к тРНК.

Обе стадии осуществляются с помощью фермента - аминоацил-тРНК-синтетазы (АРС-азы, кодазы). Существует 20 видов таких ферментов - по числу аминокислот. В каждом случае фермент имеет два центра узнавания - для аминокислоты и тРНК (рис. 35).
Рис. 35. Связывание аминокислоты (фенилаланина - Phe) с тРНК
В активном центре фермента аминокислота связывается с АТФ, лишь затем переносится на тРНК. Образование макроэргической связи между аминокислотой и тРНК называется аминоацилированием, а образовавшийся комплекс - аминоацил-тРНК (аа-тРНК). Каждая тРНК может переносить к месту синтеза белка только одну из аминокислот. Для большей части аминокислот имеется несколько тРНК, которые называются изоакцепторными и обозначаются соответственно тРНК1 Phe , тРНК2 Phe и т. д.
Собственно процесс трансляции включает три фазы:
Инициация трансляции - начало синтеза полипептидной цепи, заключается в сборке белоксинтезирующей системы (активной рибосомы).
Функциональные центры рибосом.
Каждая рибосома состоит из двух субчастиц: большой и малой. Форма субчастиц, их контактирующих поверхностей, достаточно сложная (рис. 36). На контактирующих поверхностях большой и малой субчастиц в небольших углублениях находятся центры связывания всех компонентов белоксинтезирующей системы (мРНК, пептидил-тРНК, очередная аминоацил-тРНК), а также центры, катализирующие образование пептидной связи и постепенное перемещение рибосомы относительно мРНК.
Рис. 36. Модель рибосомы Escherichia coli (Васильев В.Д., Институт белка РАН):
слева - перекрывающаяся проекция: малая (30S) субчастица обращена к зрителю
и закрывает собой часть большой (50S) субчастицы; справа - боковая проекция:
к зрителю обращен боковой палочкообразный выступ большой (50S) субчастицы,
а малая (30S) субчастица расположена вверху
Функциональные центры рибосом (рис. 37):
1. Центр связывания мРНК (М-центр). Образован участком 18S-рРНК, который комплементарен на протяжении 5-9 нуклеотидов 5′-нетранслируемому фрагменту мРНК. Расположен на малой субчастице рибосомы.
2. Пептидильный центр (П-центр). В начале процесса трансляции с пептидильным центром связывается инициирующая аа-тРНК. На последующих стадиях трансляции в пептидильном центре находится пептидил-тРНК, содержащая уже синтезированную часть пептидной цепи.
3. Аминоацильный центр (А-центр) - место связывания очередной аа-тРНК. Аминоацильный и пептидильный центры расположены как на большой, так и на малой субчастицах рибосомы.
4. Каталитический (пептидилтрансферазный) центр (К-центр). Катализирует перенос пептидила из состава пептидил-тРНК на поступившую в амино-ацильный центр очередную аа-тРНК. Расположен на большой субчастице рибосомы.
Инициация трансляции у прокариот начинается со связывания мРНК в области 5 - нетранслируемого участка с малой субъединицей рибосомы. Инициирующий кодон (АУГ) оказывается на уровне пептидильного центра будущей рибосомы. Далее за счет комплементарного взаимодействия с этим кодоном происходит связывание инициирующей аа-тРНК. У прокариот инициирующей аа-тРНК является формилметиониновая аа-тРНК - fМet-тРНКi fMet
(рис. 38). Блокирование аминогруппы метионина формильным остатком препятствует включению такой аминокислоты во внутренние участки цепи, но в то же время позволяет fМet-тРНКi fMet связываться с инициирующим кодоном мРНК (АУГ). Инициирующая аа-тРНК, взаимодействуя с пептидильным центром большой субъединицы, вызывает связывание последней.
У прокариот инициация осуществляется при участии трех специфических белков - факторов инициации (IF - Initiation Factors). IF-3, присоединяясь к малой субчастице рибосомы, препятствует преждевременному связыванию большой субчастицы и, с другой стороны, способствует связыванию мРНК. IF-2 участвует в связывании инициирующей аа-тРНК. Вероятно, этот фактор образует комплекс с аа-тРНК еще вне рибосомы, причем в состав комплекса входит ГТФ. В результате образуется так называемый инициаторный комплекс, состоящий из малой субчастицы рибосомы, мРНК, инициаторной аминоацил-тРНК и факторов инициации (рис. 39). Большая субчастица при ассоциации с малой субчастицей вызывает гидролиз ГТФ (до ГДФ и Фн) и одновременно вытесняет все факторы инициации, включая IF-3. В итоге инициации трансляции образуется полная 70S (у прокариот) рибосома с пептидильнымучастком, занятым инициаторной формилметионил-тРНК, и со свободным аминоацильнымучастком.

Рис. 39. Инициация трансляции у прокариот
Элонгация трансляции - основной и самый продолжительный этап белкового синтеза, в ходе которого происходит удлинение полипептидной цепи за счет последовательного присоединения аминокислот. Начинается с момента образования первой пептидной связи и заканчивается после включения в полипептидную цепь последней аминокислоты.
Элонгация у бактерий осуществляется при участии трех белковых факторов (EF-Tu, EF-Ts, EF-G) и имеет циклический характер.
Цикл элонгации включает 3 стадии:
1. Связывание аа-тРНК с аминоацильным центром рибосомы. На этой стадии со свободным А-центром рибосомы связывается очередная аа-тРНК - та, чей антикодон комплементарен кодону мРНК, находящемуся в А-центре. Поступив в А-центр, аа-тРНК закрепляется в нем в комплексе с белковым фактором EF-Tu (EF - Elongation Factor) и ГТФ. При участии фактора EF-Тu осуществляется гидролиз ГТФ до ГДФ и Фн, а выделяющаяся энергия расходуется на сближение двух аминокислотных остатков. Комплекс EF-Tu·ГДФ при этом покидает рибосому и регенерируется с участием фактора EF-Ts, так что фактор EF-Tu вновь оказывается связанным с молекулой ГТФ (рис. 40).
Рис. 40. Этап элонгации в синтезе белка у прокариот
2. Образование пептидной связи. В рибосоме после первой стадии цикла находятся пептидил-тРНК (в П-центре) и аа-тРНК (в А-центре). При этом их акцепторные петли и связанные с ними аминокислотные остатки располагаются в каталитическом (К-) центре. Последний и осуществляет пептидилтрансферазную реакцию: переносит пептидил (или инициирующую аминокислоту - формилметионин у прокариот) на аминокислоту поступившей аа-тРНК. Прежняя тРНК пептидила становится свободной (рис. 40).
В ходе пептидилтрасферазной реакции карбоксильная группа пептидила образует пептидную связь с аминогруппой очередной аминокислоты (рис. 41). Таким образом, рост пептидной цепи при трансляции происходит в направлении от N- к С-концу.
Рис. 41. Пептидилтрансферазная реакция
3. Транслокация - перемещение пептидил-тРНК из А-центра в П-центр в результате передвижения рибосомы по мРНК на один кодон. Свободная тРНК вытесняется из рибосомы, и одновременно освобождается А-центр, необходимый для связывания следующей аа-тРНК. Транслокация идет с участием белкового фактора EF-G (у бактерий) и сопровождается гидролизом одной молекулы ГТФ.
Таким образом, удлинение пептидной цепи на один аминокислотный остаток требует расхода двух молекул ГТФ (одна идет на связывание аа-тРНК, вторая - на траслокацию). Многократное повторение циклов элонгации приводит к включению в строящуюся пептидную цепь аминокислотных остатков в соответствии с последовательностью кодонов в мРНК.
Терминация трансляции . Сигналом об окончании трансляции служит появление в рибосоме одного из терминирующих кодонов мРНК: УАА, УАГ или УГА. С терминирующим кодоном, находящимся в А-центре, взаимодействуют особые белки - факторы терминации, или рилизинг-факторы (от англ. relеase - освобождать). У бактерий в терминации трансляции участвуют три белковых фактора: RF-1, RF-2 и RF-3. Фактор RF-1 узнает кодоны УАА и УАГ, а фактор RF-2 - кодоны УАА и УГА. Фактор RF-3 выполняет вспомогательную роль, стимулируя работу RF-1 и RF-2. При поступлении в рибосому одного из терминирующих кодонов с ним немедленно связывается соответствующий RF-фактор и тем самым блокирует присоединение аа-тРНК. Присоединение факторов терминации стимулирует гидролизную активность пептидилтрасферазного (каталитического) центра, в результате чего связь полипептида с тРНК гидролизуется. Синтезированный белок отделяется от рибосомы, одновременно отделяются тРНК и мРНК, а рибосома диссоцирует на субчастицы (рис. 42).
В терминации трансляции принимает участие молекула ГТФ, которая, вероятно, служит аллостерическим регулятором активности белковых факторов терминации.
МАТРИЧНАЯ РНК, ЕЕ СТРУКТУРА И ФУНКЦИОНАЛЬНЫЕ УЧАСТКИ
Матричной (мРНК) считают РНК, которая в последовательности нуклеотидов в молекуле несет информацию, обеспечивающую синтез специфического белка непосредственно на ней самой, а также информацию о времени, количестве, месте и условиях синтеза этого белка.
Строение мРНК эукариот специфично: в их составе есть информативные, т.е. работающие как матрицы в процессе биосинтеза белка зоны и неинформативные участки. Неинформативные участки содержат кэп, 5'-нетранслируемую область (5'-НТО или 5'-UTR), 3'-нетранслируемую область (3'-НТО или 3'-UTR), полиадениловый фрагмент.
В эукариотических мРНК сразу за кэпом располагается 5'-нетранслирующая область (5'-UTR), с которой связываются белки, играющие важнейшую роль в регуляции инициации трансляции. К их числу относятся собственно белковые факторы инициации
(elF), а также белки-репрессоры трансляции. В инициации трансляции принимают участие также З'-нетранслируемая область (3'-UTR) и поли(А)-хвосты мРНК. В З'-UTR имеются и особые последовательности: сигналы полиаденилирования и сигнал внутриклеточной локализации. С З'-UTR способны связываться маскирующие белки (они делают мРНК недоступной для трансляции рибосомами) и дестабилизирующие белки, контролирующие доступность мРНК для атаки нуклеаз и таким образом определяющие время жизни мРНК в клетке.
В кодирующем участке (транслируемая область) с мРНК связываются факторы элонгации (eEF), АРСазы (аминоацил-тРНК-синтетазы), рибосомы, а также определенные ферменты, необходимые для процесса трансляции. В кодирующей области мРНК расположены также сигналы перекодирования (репрограммирования) трансляции, благодаря которым с одной и той же мРНК могут транслироваться разные белки.
З'-UTR играет, важную роль в активации и деградации мРНК,. Эта область отвечает за маскирование мРНК и усиление трансляции. Маскирование осуществляется белками, которые делают мРНК недоступной ни рибосомам, ни ферментам деградации (нуклеазам). Такая мРНК приобретает стабильную и неактивную в смысле трансляции форму и называется запасной мРНК. Эта РНК свойственна ооцитам и сперматозоидам, а в отдельных случаях и соматическим клеткам.
Рис. 162. (Коничев, с.323)Схема расположения функциональных участков в молекуле мРНК эукариот (по А.С.Спирину, 1996, с дополнениями).
Сплошные стрелки - области присоединения белков, участвующих в регуляции
трансляции, пунктирные стрелки - расположение тех или иных регуляторных
последовательностей (сигналов) в различных участках мРНК
Весьма существенную роль в регуляции трансляции играет и поли(А) последовательность на З'-конце мРНК. Часть мРНК эукариот полиаденилируется в ходе процессинга в ядре клеток (см. гл. 10), а сигналом для ядерного полиаденилирования служит последовательность AAUAAA, расположенная вблизи З'-конца молекулы.
Транспортные РНК: первичная, вторичная и третичная структура, роль модифицированных нуклеотидов (см. лк. Синтез РНК).слайд 5.
АКТИВАЦИЯ АМИНОКИСЛОТ.
Перед началом трансляции аминокислоты должны пройти стадию активации и присоединиться к тРНК, осуществляющими их доставку к рибосомам. тРНК, по сути, служат адаптерами при переводе нуклеотидных последовательностей мРНК в аминокислотные последовательности белков. В структуре тРНК содержится несколько функционально важных участков (петель), главными из которых для адаптерной функции являются антикодон и акцептирующий конец (см. рис. 55).
Антикодон служит для взаимодействия с соответствующим кодоном мРНК, а акцептирующий конец (ЦЦА-последовательность, расположенная на 3'-конце тРНК) - для присоединения аминокислоты.
Каждая тРНК может переносить только одну из аминокислот, вов-лекаемых в биосинтез белка. Для большей части аминокислот име-ется несколько тРНК, которые называются изоакцепторными и обозначаются соответственно тPHK Gly и т.д. Существование изоак-цепторных тРНК связано с вырожденностью генетического кода.
В результате присоединения аминокислот к З'-концу молекулы тРНК аминокислоты активируются — между карбоксильным концом молекулы аминокислоты и концевым аденозином акцептирующего конца тРНК возникает макроэргическая связь, энергия которой используется далее для синтеза пептидной связи в ходе биосинтеза белка на рибосомах (см. рис. 157,Коничев).
В результате специфического взаимодействия тРНК и соответствующей аминокислоты возникает аминоацил-тРНК — молекула, содержащая активированный аминокислотный остаток и соответствующий антикодон.
Активация аминокислот и их последующее присоединение к тРНК катализируются специфическими ферментами аминоацил-тРНК-синтетазами.
Суммарная реакция превращений, приводящих к образованию аминоацил-тРНК, может быть записана следующим образом:
Аминокислота + АТР + тРНК + Н2О →Амимоацил-тРНК + АМР + 2Рi.
Из этой реакции следует, что на синтез аминоацил-тРНК затрачиваются две богатые энергией фосфатные связи. Одна из них расходуется на образование эфирной связи между аминокислотой и тРНК, а другая (при гидролизе пирофосфата) сдвигает равновесие всей реакции в сторону образования продукта.
Ключевой особенностью реакции, приводящей к аминоацилированию тРНК, является специфичность участвующих вней ферментов. Присоединение к тРНК каждой из 20 аминокислот, катализируется определенной аминоацил-тРНК-синтетазой. Фермент должен отличать одну аминокислоту от 19 других и переносить ее на одну или несколько (изоакцепторных) тРНК. Специфичность фермента определяется его прочным связыванием не менее чем с тремя участками тРНК . К этим участкам относятся акцепторный конец, D участок (D петля)и вариабельнаяпетля.
Кроме того, многие аминоацил-тРНК-синтетазы содержат, помимо участков синтеза, гидролитические участки. Возможно, что эти два участка действуют как двойные фильтры. Участок синтеза отбрасывает аминокислоты, превышающие по размеру нужную аминокислоту, а гидролитический участок разрушает те активиро-анные промежуточные продукты, которые меньше по размеру, чем требуется.
Т.о., синтетазы используют механизм коррекции с целью предотвращения ошибок в аминоацилировании тРНК. Частота таких ошибок чрезвычайно низка.
Трансляция генетического кода
Трансляция—это процесс декодирования мРНК, в результате которого информация с языка последовательности нуклеотидов в мРНК переводится (транслируется) на язык последовательности аминокислот в полипептидной молекуле. Декодирование мРНК осуществляется в направлении 5’→3’. В процессе трансляции различают стадии:
1) активация аминокислот;
2) аминоацилирование тРНК;
3) собственно трансляция.
Активация аминокислот. Это процесс присоединения аминокислоты с помощью своей карбоксильной группы к a-фосфату АТР с помощью специфической аминоацил-тРНК-синтетазы (рис. 3.10). Реакция сопровождается высвобождением неорганического пирофосфата и образованием аминоациладенилата (АК-АМР). Аминоацил-аденилат обладает очень высокой реакционной способностью и стабилизируется благодаря прочному связыванию с ферментом. Данный процесс характеризуется высокой специфичностью: для каждой аминокислоты существует собственный фермент (ферменты).
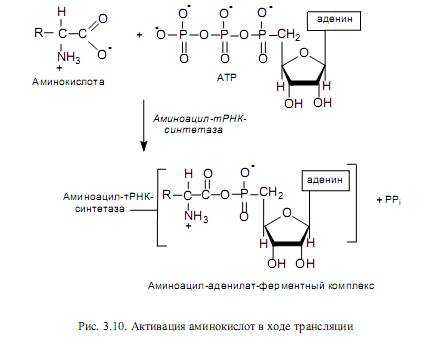
Аминоацилирование тРНК. Представляет собой перенос аминоацильной группы от связанного с ферментом аминоацил-аденилата на 2’- или 3’-ОН-группу концевой рибозы тРНК в акцепторной ветви (рис. 3.11).
Ключевой особенностью реакции, приводящей к аминоацилированию тРНК, является специфичность участвующих в ней ферментов. Присоединение к тРНК каждой из 20 аминокислот, встречающихся в белках, катализируется определенной аминоацил-тРНК-синтетазой. Фермент должен отличить одну аминокислоту от 19 других и перенести ее к одной или нескольким изоакцепторным тРНК из имеющихся примерно 75 других тРНК. При этом следует подчеркнуть высокое сходство в структуре многих аминокислот (лейцин, валин и изолейцин; валин и треонин; аспарагиновая и глутаминовая кислоты; и др.), а также удивительное сходство вторичной и третичной структур тРНК. Поэтому даже очень высокой специфичности, присущей данным ферментам, оказывается недостаточно, чтобы не допустить ошибок, и синтетазы могут исправлять ошибки, происходящие при присоединении. Это имеет место при гидролизе связи между аминокислотой и АМР в комплексе фермент—aминоацил—аденилат. В таком случае формирование ошибочно аминоацилированной тРНК предотвращается. Напротив, механизм, с помощью которого удалялось бы уже присоединенная к тРНК неправильная аминокислота, отсутствует. В таких случаях аминокислота занимает неправильную позицию в белке. Частота таких ошибок очень низка (например, в гемоглобине кролика 10-5).

Собственно трансляция. Процесс трансляции осуществляется на рибосомах — клеточных органеллах, представляющих собой сложный комплекс из белков и молекул РНК. В течение всего процесса синтеза белка растущая полипептидная цепь, мРНК и очередная аминоацил-тРНК остаются прикрепленными к рибосоме. У прокариот и эукариот рибосомы различаются по величине и составу (рис. 3.12). Коэффициент седиментации рибосом прокариот составляет 70S (S — Сведберг, единица измерения скорости, с которой частица оседает при центрифугировании; 1S=10 -13 с), а у эукариот для рибосом, обнаруживаемых в цитоплазме, он равен 80S.
Рибосомы при определенных условиях могут диссоциировать на большую и малую субчастицы, а каждая субчастица, в свою очередь, на составляющие молекулы белка и РНК (рис. 3.12). Все эти компоненты могут снова ассоциировать с образованием функционально активной рибосомы, если созданы соответствующие условия.
Электронно-микроскопические исследования 70S-рибосом показали, что малая и большая субчастицы соприкасаются в нескольких точках, причем между ними образуется бороздка, необходимая для размещения мРНК во время трансляции. Для понимания процесса трансляции важны два основных в функциональном отношении участка на 70S-рибосоме. Участок (сайт) А служит для присоединения аминоацил-тРНК, а с сайтом Р связывается растущая пептидная цепь.
В процессе трансляции, кроме аминоацил-тРНК и рибосом, принимает участие большое количество вспомогательных белков—факторов инициации, элонгации и терминации транскрипции.

Суть процесса трансляции состоит в последовательном декодировании мРНК в направлении 5’→3’ с помощью аминоацилированных тРНК, в ходе которого происходит последовательная конденсация аминокислотных остатков, начиная с амино-(N)-конца полипептидной цепи, в направлении к карбоксильному (С)-концу. Матричный принцип процесса соблюдается при узнавании комплементарных нуклеотидов в составе очередного кодона мРНК и антикодона тРНК. Наиболее полно трансляция изучена у прокариот, и механизм этого процесса будет рассмотрен на примере трансляции у E. coli.
Инициация трансляции. Считывание мРНК начинается с кодона AUG, который обозначает 5’-конец кодирующей последовательности и детерминирует N-концевую (первую) аминокислоту синтезируемого полипептида. Для инициации трансляции необходимо наличие 30S-субчастицы рибосомы, которая связывается в комплекс с белками — факторами инициации (IF1, IF2, IF3), GTP и Fmet-тРНК. Такой полный комплекс связывается с 5’-концом кодирующей последовательности мРНК вблизи кодона AUG. Очевидно, IF2 способен отличить Fmet-тРНК (формил-метионин-тРНК) от met-тРНК, которая связывается с кодонами AUG во внутренней части мРНК, но не может начать трансляцию со стартового кодона AUG. Эта специфичность обеспечивается N-формильной группой, отсутствующей у met-тРНК.
Распознавание стартового кодона осуществляется следующим образом. Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно за 10 нуклеотидов до 5’-конца стартового кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами последовательности с полипиримидиновым участком, находящимся в составе 16S-рРНК. Процесс инициации зависит от многих условностей в структуре взаимодействующих участков, в том числе от вторичной структуры того участка молекулы мРНК, в котором находится стартовый кодон AUG. Это имеет значение для процессов регуляции эффективности синтеза белка.
Итак, при инициации указанный комплекс связывается с Р-сайтом 30S-субчастицы рибосомы, и первой аминокислотой в составе пептида будет формил-метионин. Далее следует присоединение 50S-субчастицы рибосомы и формируется 70S-инициирующий комплекс (рис.3.13). Источником энергии для инициации синтеза белка служит расщепление GTP до GDP и Pi.
Элонгация трансляции. Для образования первой пептидной связи необходимо, чтобы аминоацил-тРНК, соответствующая следующему кодону, заняла А-участок рибосомы. Для этого аминоацил-тРНК должна сначала связать белок EF-Tu (один из факторов элонгации) и GTP. Образовавшийся тройной комплекс (аминоацил-тРНК- [EF-Tu-GTP]) и доставляет аминоацил-тРНК к А-участку. GTP в это время гидролизуется, и комплекс (EF-Tu-GDP) отделяется от рибосомы. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящуюся в А-участке (рис .3.14). В результате в А-участке оказывается дипептидил-тРНК, а в Р —свободная тРНК (рис. 3.13).
Пептидилтрансферазная активность рибосом связана, по-видимому, не с белковой частью 50S-субъединицы, а с одним из РНК-компонентов — рибозимов.

Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться. Однако прежде чем это произойдет, свободная тРНК освобождает Р-участок, образовавшаяся дипептидил-тРНК перемещается на него с А-участка (при этом не происходит взаимодействия кодона с антикодоном), а рибосома продвигается скачкообразно (на 3 нуклеотида) в сторону 3’-конца мРНК. Все эти процессы осуществляются с помощью фактора элонгации EF-G при GTР-зависимой транслокации рибосомы. В результате этих трех актов освобождается участок А и экспонируется следующий кодон, что позволяет начаться следующему циклу элонгации (рис. 3.13). Следует отметить, что при образовании каждой пептидной связи расходуется энергия, равная четырем энергетическим эквивалентам (если за один эквивалент принять энергию образования фосфатной связи): два эквивалента АТР потребляются при аминоацилировании тРНК и два эквивалента GTР — в каждом цикле элонгации.

Терминация трансляции. Процесс последовательной трансляции кодонов, в конце концов, доходит до того момента, когда в А-участке оказывается один из трех терминирующих кодонов — UAG, UAA или UGA. В природе не существует таких тРНК, антикодоны которых соответствовали бы этим кодонам. Здесь вступают в действие факторы терминации — RF-1 и RF-2, которые катализируют отсоединение полипептидной цепи от тРНК, тРНК — от рибосомы, а 70S-рибосому — от мРНК.
После инициации трансляции 70S-рибосома удаляется от сайта инициации по мере считывания каждого последующего кодона. Когда расстояние от рибосомы до сайта инициации достигнет величины 100—200 нуклеотидов, в этом сайте может произойти новая инициация. Более того, как только вторая рибосома пройдет такое же расстояние, может произойти третья инициация, и т. д. Итак, одну и ту же белок-кодирующую последовательность мРНК могут одновременно транслировать несколько рибосом. Подобные мультирибосомные трансляционные комплексы называются полирибосомами или полисомами.
Матричные РНК, состоящие из нескольких белок-кодирующих участков, часто транслируются последовательно: когда рибосома доходит до термини рующего кодона в первой последовательности, она отделяется от мРНК и со следующим инициирующим участком связывается новый комплекс. Иногда этого не происходит, и транслирующая первую кодирующую последовательность рибосома, не отделяясь, перемещается вдоль мРНК, инициируя трансляцию в других сайтах.
В некоторых случаях трансляция первой кодирующей последовательности может начаться и даже завершиться еще до окончания транскрипции остальных последовательностей, как, например, в случае lac- или trp-оперонов E.coli.
Особенности трансляции у эукариот. Процесс трансляции эукариотической мРНК в основном аналогичен таковому для прокариот. Однако имеется ряд отличий. Во-первых, аппараты транскрипции и трансляции у эукариот разобщены во времени и в пространстве, поскольку транскрипция осуществляется в ядре, а трансляция — в цитоплазме. Во-вторых, инициирующей аминоацил-тРНК у эукариот служит не Fmet-тРНК, а специальная инициирующая met-тРНК. В-третьих, на 5ў- и 3ў-концах эукариотичеких мРНК имеются особые структуры — «кэпы» и «шлейфы», принимающие участие в трансляции. Известно, что отдельные факторы инициации трансляции узнают кэпированные области для связывания с мРНК и начала процесса трансляции.
Трансляция
Под трансляцией в биологии понимают синтез из аминокислот полипептидов, который протекает в цитоплазме на рибосомах при участии 1) мРНК в качестве матрицы, 2) тРНК в качестве переносчика аминокислот, а также 3) ряда белковых факторов, выполняющих каталитическую функцию на разных этапах процесса. Трансляция протекает в клетках всех живых организмов, это фундаментальный процесс живой природы.
С информационной точки зрения трансляцию можно определить как механизм перевода последовательности триплетов мРНК в последовательность аминокислот белка.
Функция рибосом состоит в удерживании в нужном положении мРНК, тРНК и белковых факторов до тех пор, пока не произойдет определенная химическая реакция. Чаще всего это образование пептидной связи между соседними аминокислотами.
Трансляция и биосинтез белка обычно означают одно и то же. Однако, когда говорят о биосинтезе белка, то нередко в него включают посттрансляционные модификации полипептидов (приобретение ими вторичной, третичной и четверичной структур), а также иногда могут включать процесс транскрипции. С этой точки зрения трансляция рассматривается как важный этап в биосинтезе белков.
Процесс трансляции у эукариот и прокариот имеет ряд отличий, в основном связанный с разнообразием и активностью белковых факторов.
На одной цепочке мРНК может находится несколько рибосом, образуя полисому. При этом сразу происходит синтез нескольких идентичных полипептидов (но каждый находится на своей стадии синтеза).
Синтез одного белка обычно длится несколько секунд.
Аминокислоты, из которых синтезируется полипептид, обязательно проходят стадию активации. Сам же процесс трансляции включает три стадии: инициацию, элонгацию и терминацию.
Процесс трансляции обладает свойством специфичности. Во-первых, определенным кодонам мРНК соответствуют свои тРНК. Во вторых, аминокислоты присоединяются только к «своим» тРНК.
Активация аминокислот
Активация аминокислот необходима, так как только в таком состоянии они способны соединяться с тРНК и позже образовывать между собой пептидные связи.
В цитоплазме клеток всегда находятся свободные (не соединенные с другими веществами) аминокислоты. Специфичные ферменты в присутствии АТФ преобразуют аминокислоту в аминоациладенилат, который уже способен соединяться с тРНК.
Существует класс ферментов - аминоацил-тРНК-синтетазы, - которые активируют аминокислоты, используя при этом энергию АТФ. Каждая аминокислота активируется своим ферментом, после чего присоединяется только к своей тРНК. Образуется комплекс аминокислоты с тРНК - аминоацил-тРНК (аа-тРНК).
Инициация трансляции
Инициация трансляции включает следующие последовательно протекающие при участии факторов инициации этапы:
Присоединение 5'-конца мРНК к малой субъединице рибосомы. При этом стартовый кодон (AUG) размещается в недостроенном (из-за отсутствия большой субъединицы) P-сайте рибосомы.
Комплекс аа-тРНК с соответствующим антикодоном присоединяется к стартовому кодону мРНК. У эукариот кодон AUG кодирует аминокислоту метионин, у прокариот — формил-метионин. Позже эти стартовые аминокислоты вырезаются из готового полипептида.
Происходит объединение субъединиц рибосом, в результате чего достраиваются их P- и A-сайты.
Таким образом, на этапе инициации происходит распознавание рибосомой стартового кодона и подготовка к началу синтеза.
Образующаяся связь между рибосомой и мРНК обратима, мРНК после синтеза полипептида может быть отсоединена от рибосомы. В последствии мРНК используется еще раз или разрушается специальными ферментами.
Стартовый кодон AUG отличается от других таких же кодонов в середине мРНК тем, что перед ним находится кэп и определенные нуклеотидные последовательности. Именно благодаря им AUG распознается как стартовый. (Это касается в основном эукариот.)
Элонгация трансляции
На этом этапе происходит непосредственный синтез полипептидной цепочки. Процесс элонгации состоит из множества циклов. Один цикл элонгации — это присоединение одной аминокислоты к растущей полипептидной цепочке.
Уже на этапе инициации P-сайт рибосомы оказывается занятым первой тРНК, несущей аминокислоту метионин. В первом цикле элонгации в A-сайт рибосомы заходит второй комплекс aa-тРНК. Это будет та тРНК, чей антикодон комплементарен следующему (за стартовым AUG) кодону.
A(аминоацил)- и P(пептидил)-сайты располагают комплексы аа-тРНК так, что между аминокислотами протекает химическая реакция, и образуется пептидная связь.
После этого первая (находящаяся в P-сайте) тРНК освобождается от своей аминокислоты. В результате последняя оказывается связанной только со второй аминокислотой пептидной связью. Вторая аминокислота связана со второй тРНК, находящейся в A-сайте.
Рибосома перемещается по нити мРНК на один триплет. При этом первая т-РНК оказывается в E-сайте (exit) рибосомы, после чего покидает ее. Вторая т-РНК, связанная с двумя аминокислотами, переходит в P-сайт. A-сайт освобождается для поступления третьего комплекса аа-тРНК.
Следующие циклы элонгации протекают аналогично первому. Когда A-сайт освобождается, в него может зайти аа-тРНК, чей антикодон комплементарен кодону мРНК, находящемся в этот момент в A-сайте.
Терминация трансляции
Терминация — это завершения синтеза полипептидной цепочки и ее отделение. Терминация наступает, когда рибосома встречает один из терминирующих кодонов (UAA, UAG, UGA), для которых не существует своих тРНК. Эти участки мРНК распознаются специальными белками — факторами терминации.
Читайте также:
