Сердечная недостаточность после инфаркта миокарда. Терапевтическая ценность инфаркта миокарда
Обновлено: 18.05.2024
В. М. Женило 1 , А. 3. Авсарагова 2 , 3. Т. Астахова 2
1 ГБОУ ВПО “Ростовский государственный медицинский университет” М3 РФ, Россия, 344022, Ростов-на Дону, пер. Нахичеванский, 2.
2 ГБОУ ВПО “Северо-Осетинская государственная медицинская академия” М3 РФ, Россия, Республика Северная Осетия 362019, Владикавказ, ул. Пушкинская, 40.
Целью настоящего исследования явилось изучение эффективности включения препарата ремаксол в схему терапии больных инфарктом миокарда на фоне острой сердечной недостаточности II - III стадии. Проведен анализ клинико-лабораторных данных 126 пациентов с впервые установленным диагнозом острого инфаркта миокарда с подъемом сегмента SТ на фоне острой сердечной недостаточности II - III стадии. В зависимости от схем терапии пациенты были разделены на 2 группы: первая (контрольная) - 60 пациентов, получивших традиционную терапию, вторая (основная) — 66 пациентов, в схему лечения которых после тромболитической терапии вводился ремаксол внутривенно однократно, 400 мл со скоростью 3-4 мл/мин под контролем центрального венозного давления, артериального давления и диуреза. Курс составлял 3-5 дней в зависимости от тяжести состояния. Выявлена высокая эффективность схемы лечения пациентов с острым инфарктом миокарда и острой сердечной недостаточностью II - III стадии, включающей ремаксол. Схема характеризовалась более быстрой, по сравнению с традиционной терапией, стабилизацией нарушенной системной гемодинамики и восстановлением ослабленной сократительной способности миокарда, уменьшением риска развития нарушений ритма работы сердца и купированием гипергомоцистеинемии, что, в свою очередь, снижает риск развития осложнений в виде тромбозов и тромбоэмболии.
Ключевые слова: острый инфаркт миокарда; тромболитическая терапия; метаболическое лечение; ремаксол.
Improving the efficacy of therapy for patients with myocardial infarction complicated by circulatory failure
V. M. Zhenilo 1 , A. Z. Avsaragova 2 , and Z. T. Astakhova 2
1 Rostov State Medical University, Nakhichevanskii per. 29, Rostov-on-Don, 344022 Russia.
2 North Ossetian State Medical Academy, ul. Pushkinskaya 40 Vladikavkaz, Republic North Ossetia - Alania, 362019 Russia.
The effectiveness of drug remaxol inclusion in the scheme of treatment of patients with myocardial infarction on the background of degree II — III acute cardiac insufficiency was evaluated by the analysis of clinical and laboratory data of 126 patients with newly diagnosed acute myocardial infarction including ST-segment elevation on the background of acute cardiac insufficiency. Depending on the regimen, patients were divided into two groups. The first (control) group included 60 patients who received conventional thrombolytic therapy; the second (main) group included 66 patients which, after thrombolytic therapy, received remaxol (single daily intravenous administration, 400 mL at 3 - 4 mL/min rate) with controlled central venous pressure, arterial pressure, and diuresis. The course lasted for 3 - 5 days, depending on the severity of condition. A high efficiency of the treatment regimen including remaxol was established as characterized by more rapid (in comparison to conventional therapy) stabilization of disturbed systemic hemodynamics and recovery of weakened myocardial contractility, decreased risk of cardiac arrhythmias, and relieved hyperhomocysteinemia that, in turn, reduced the risk of complications such as thrombosis and thromboembolism.
Keywords: acute myocardial infarction; thrombolytic therapy; metabolic treatment; remaxol.
Введение
Проблема инфаркта миокарда как проявления ишемической болезни сердца остается одной из приоритетных в медицине, так как развивающиеся нарушения кровообращения играют решающее значение в течении заболевания, в ближайшем и отдаленном прогнозе для жизни пациента [4, 5].
В патогенезе острого инфаркта миокарда важную роль играет полное или частичное прекращение кровоснабжения в результате острой окклюзии коронарной артерии, после чего, спустя 30 - 50 мин развиваются грубые изменения кардиомиоцитов, проявляющиеся набуханием митохондрий, деструкцией саркоплазматического ретикулума и уменьшением депо гликогена. На этом фоне отмечается резкое уменьшение окислительного фосфорилирования и одновременное накопление в мышце продуктов аэробного гликолиза - лактата, что и определяет необходимость поиска способов быстрого и эффективного восстановления кровотока в коронарной артерии с целью прекращения коагуляционного некротического процесса и миолиза в сердечной мышце [6 — 8].
При этом на фоне проводимой тромболитической терапии может происходить микроэмболизация периферического сосудистого русла фрагментами разрушенного тромба и содержимым бляшки, что, вместе с локальными спастическими реакциями мелких сосудов, создает предпосылки к нарушению микроциркуляции вплоть до образования множественных мелких некрозов миокарда [1, 9- 11]. Медикаментозная терапия при остром инфаркте миокарда с подъемом сегмента SТ призвана решить главную задачу - уменьшение потребности миокарда в кислороде или увеличение его доставки посредством вазодилатации.
В настоящее время все большее внимание уделяется роли гомоцистеина (аминокислоты, образующейся внутриклеточно из метионина в результате ферментативного переноса сульфатной группы или реметилирования в присутствии витаминов группы В6, В9 и В12) в увеличении риска развития сердечно-сосудистых заболеваний, так как гипергомоцистеинемия встречается более чем у 60 % больных ишемической болезнью сердца [3, 12, 13]. Повышение содержания гомоцистеина в крови, обусловленное различными факторами, в том числе и врожденной ферментативной недостаточностью, вызывает повреждение и дисфункцию эндотелия сосудов, увеличение пролиферации и активности гладкомышечных клеток с последующей вазоконстрикцией, а стимулирование тромбообразования, вследствие активации свертывающей системы крови и агрегации тромбоцитов, ухудшает проходимость сосудов. Способность гомоцистеинемии усиливать окислительный стресс дополняет негативную картину повреждения сосудов.
Цель исследования - изучение эффективности включения ремаксола в схемы терапии больных инфарктом миокарда на фоне острой сердечной недостаточности II — III стадии.
Методы исследования
Проведен анализ лечения 126 пациентов в возрасте 50 — 70 лет с впервые установленным диагнозом острого инфаркта миокарда с подъемом сегмента SТ, осложненным острой сердечной недостаточностью II — III стадии (по классификации Кilliр, 1967), находившихся на лечении в кардиологическом отделении РКБ г. Владикавказа. Все пациенты поступали в первые 24 ч от начала развития заболевания, а спустя 2 — 3 ч после поступления, в течение которых они проходили лабораторные и электрокардиографические исследования, им начинали проводить тромболитическую терапию.
В зависимости от схем терапии пациенты были разделены на 2 группы: первая (контрольная) - 60 пациентов, получивших стандартный вариант лечения, согласно методическим рекомендациям М3 РФ (2013) [2], вторая (основная) - 66 пациентов, получившие после тромболитической терапии (тенектеплаза внутривенно в дозе 0,5 - 0,7 мг/кг в течение 5 — 10 с) - ремаксол внутривенно однократно, 400 мл со скоростью 3 — 4 мл/мин под контролем центрального венозного давления, артериального давления и диуреза. Курс - 3 - 5 дней в зависимости от тяжести состояния.
Пациенты в группах были сопоставимы по полу, возрасту и диагнозу. Из сопутствующих заболеваний был выявлены: сахарный диабет - у 52 (41,2 %) пациентов, гипертоническая болезнь - у 45 (35,7 %) пациентов, ожирение II - III стадии - у 42 (33,3 %) больных, хронические заболевания легких — у 22 (17,4 %) больных и печени - у 20 (15,8 %) пациентов и хронический алкоголизм - у 12 (9,5 %) больных.
Исследование гемодинамики проводили на аппарате “Диамант-М” (Россия), позволяющем регистрировать импедансную кардиограмму в динамике: перед проведением тромболитической и метаболической интенсивной терапии; через 30 и 60 мин, и через 3 ч после проведения тромболитической и цитопротекторной интенсивной терапии. Изучение показателей сократимости левого желудочка - конечно-диастолический объем (КДО), конечно-систолический объем (КСО) и фракция выброса оценивались методом эхокардиоскопии в М-режиме (Aloca 1700, Япония) в первые сутки заболевания, на 7 — 10 сут и накануне выписки из стационара.
Суммарное содержание гомоцистеина в сыворотке крови определяли у 58 пациентов со II (29 пациентов) и III (29 пациентов) стадией острой сердечной недостаточности. Из них пациенты контрольной группы (27 больных) получили традиционную схему терапии, а основной группы (31 больной) - получили в схеме лечения ремаксол.
Концентрацию гомоцистеина определяли высокочувствительным (до 1 мкмоль/л) методом хемилюминесцентного иммуноанализа на микрочастицах (ХИАМ) до лечения, через 1 ч после интенсивной терапии, через 24 ч и на 7 сут. Для количественной оценки концентрации гомоцистеина мы использовали критерии, разработанные в работах [14, 15], согласно которым уровень гомоцистеина в плазме крови от 5 до 15 мкмоль/л считается нормой, 15 - 30 мкмоль/л -умеренной гомоцистеинемией, 30 - 100 мкмоль/л -средней, а больше 100 мкмоль/л классифицируется как выраженная гипергомоцистеинемия. Исходя из того, что референсные значения содержания гомоцистеина в плазме крови составляют для мужчин 5,46 -16,20 мкмоль/л и для женщин 4,44 - 13,56 мкмоль/л, то есть гендерные отличия не столь выражены, результаты группы сравнения, в которую входили здоровые лица примерно такого же возраста, как и больные, мы объединили, получив среднестатистическое значение (9,43 ± 1,25) мкмоль/л.
Полученные данные исследований обработаны методом вариационной статистики с использованием пакета прикладных программ Microsoft Excel и Statistica 6.0. Степень достоверности отличий оценивали по t-критерию Стьюдента.
Результаты и их обсуждение
Анализ данных в динамике наблюдения (табл. 1) у пациентов с острым инфарктом миокарда выявил более частое (22 случая — 36,6 %) нарушение ритма сердца при проведении лечения по классической схеме, чем у пациентов, получавших ремаксол - 10 случаев (15,5 %). Большинство (20 случаев) аритмий было выявлено через 60 мин от начала интенсивной терапии, причем в основной группе у 8 (12,2 %) больных, в то время как в контрольной - у 12 (20 %) пациентов.
Таблица 1.
Варианты нарушений ритма сердца у пациентов в зависимости от схемы терапии
Наиболее часто (12 случаев) регистрировалась желудочковая экстрасистолия, из них 9 (15 %) — у пациентов контрольной группы и 3 (4,5 %) - у пациентов основной группы. Вторым по частоте выявления (9 случаев) было ускорение идиовентрикулярного ритма: в 6 (10 %) и 3 (4,5 %) случаях, соответственно, на третьем месте по частоте регистрации была синусовая брадикардия (8 случаев) — в 5 (8,3 %) и 3 (4,5 %) случаях, соответственно.
Таблица 2.
Динамика деятельности сердечно-сосудистой системы у пациентов (М ± m)
Достоверные (р ≤ 0,05) различия по сравнению с нормой (*) и при выписке (**)
Анализ динамики изменений уровня гомоцистеина (табл. 3) у больных острым инфарктом миокарда с острой сердечной недостаточностью (ОСН) выявил его существенное повышение до начала терапии у всех пациентов, более выраженное - у больных III стадией ОСН: на 66,9 %, (28,52 ± 1,34) мкмоль/л против (9,43 ± 1,25) мкмоль/л, - в контрольной группе и на 65,8 %, (27,64 ±1,24) мкмоль/л против (9,43 ±1,25) мкмоль/л, — в основной группе (р < 0,001), в то время как у пациентов со II стадией ОСН эти показатели составили 26 % до (12,75 ± 1,24) мкмоль/л - в контрольной и 27,8 % до (13,07 ± 1,45) мкмоль/л - в основной группе, соответственно (р < 0,001).
Таблица 3.
Динамика уровня гомоцистеина (мкмоль/л) в крови пациентов в зависимости от схемы терапии (М±m)
* р< 0,001, ** р < 0,05.
В динамике наблюдения отмечено нарастание уровня гомоцистеина, более выраженное у пациентов с III стадией острой сердечной недостаточности и с максимальными значениями через 1 ч после проведения тромболитической терапии при обеих схемах лечения, однако дальнейшая динамика носила более положительный характер у пациентов, получавших ремаксол.
У пациентов с острым инфарктом миокарда и ОСН II стадии динамика уровня гомоцистеина носила сходный характер, хотя повышение показателя было менее выражено: в контрольной группе через 1 ч после терапии составил (17,49 ± 1,08) мкмоль/л (на 46,1 %), через 24 ч снизился на 14,1 % до (15,01 ± 1,12) мкмоль/л, через неделю - еще на 9,9 % до (13,51 ± 1,16) мкмоль/л, - что на 30,2 % выше референсного значения. У пациентов основной группы динамика была более выражена: через 1 ч повышение на 20,8 % до (16,51 ± 1,13) мкмоль/л, через 24 ч - снижение на 19,9 % до (13,21 ± 1,26) мкмоль/л и через неделю после проведенного лечения - еще на 19,4 % до (10,64± 1,13) мкмоль/л, что, в свою очередь, было на 11,4 % выше референсного значения (р < 0,05).
Таким образом, выявленная динамика уровня гомоцистеина свидетельствует о большей эффективности схемы лечения, включающей ремаксол, что проявляется в более быстром купировании гипергомоцистеинемии и, как следствие, - уменьшении риска развития тромбоэмболии и других осложнений.
Заключение
Выявлена высокая эффективность схемы лечения пациентов с острым инфарктом миокарда и острой сердечной недостаточностью II - III стадии, включающей ремаксол. Она характеризовалась более быстрой, по сравнению с традиционной терапией, стабилизацией нарушенной системной гемодинамики и восстановлением ослабленной сократительной способности миокарда, уменьшением риска развития нарушений ритма сердца и купированием гипергомоцистеинемии, что, в свою очередь, снижает риск развития осложнений в виде тромбозов и тромбоэмболии.
Литература
Сердечная недостаточность после инфаркта миокарда. Терапевтическая ценность инфаркта миокарда
ММА имени И.М. Сеченова
З а многолетний период наблюдений в структуре смертности от острого инфаркта миокарда (ОИМ) ведущую роль сохраняет острая сердечная недостаточность, составляя 52% от общего числа летальных осложнений [1]. Острая сердечная недостаточность является следствием некроза миокарда и приводит к снижению насосной функции сердца и развитию гипоксии - раннему и постоянному признаку недостаточности кровообращения при остром инфаркте миокарда.
Механизм циркуляторного элемента гипоксии заключается в том, что вследствие снижения сердечного выброса происходит увеличение артерио-венозной экстракции кислорода (замедление кровотока при постоянстве отдачи O2 от гемоглобина к митохондриям). Кроме этого, возможен механизм так называемой шунтовой тканевой гипоксии - следствие увеличенного артерио-венозного шунтирования, когда может иметь место нормальное или повышенное рO2 в смешанной венозной крови, несмотря на низкое конечно-капиллярное рO2. Низкое парциальное давление O2 в капиллярной крови приводит к уменьшению среднего диффузионного градиента для O2 из эритроцита в митохондрию. Артерио-венозный шунт в коже может быть более 10% сердечного выброса [2]. Чрезвычайно важными в патогенезе гипоксемии и последующей тканевой гипоксии представляются механизмы кардиогенной дыхательной недостаточности. Кардиогенная дыхательная недостаточность является результатом вовлечения в патологический процесс легких при несостоятельности насосной функции миокарда. Физиологически значимое увеличение конечно-диастолического давления левого желудочка или давления в левом предсердии неизменно приводит к ретроградному увеличению давления в сосудах легких и формирует посткапиллярную, пассивную легочную гипертензию. В соответствии с уравнением Старлинга при повышении гидростатического давления в малом круге кровообращения происходит увеличение скорости фильтрации жидкости через микрососудистый эндотелий в интерстиций. Когда жидкость фильтруется быстрее, чем удаляется лимфатической системой, происходит развитие периваскулярного, интерстициального, а затем и альвеолярного отека легких. С механической точки зрения поражение легких можно охарактеризовать, как рестриктивные расстройства, проявляющиеся изменением легочных объемов. При сердечной недостаточности характерно снижение жизненной ёмкости легких, остаточный объем и функциональная остаточная емкость легких не изменены или почти не изменены, общая ёмкость легких меньше должной 4. Снижение общей ёмкости легких обусловлено уменьшением эластических свойств паренхимы легких: в результате отека интерстиция и стенок альвеол происходит увеличение жесткости легких и снижение их растяжимости. По мере нарастания этого процесса может развиваться феномен раннего экспираторного закрытия дыхательных путей со значительным увеличением остаточного объема и уменьшением общей ёмкости легких [6]. Прогрессивное уменьшение ёмкости легких и их растяжимости приводит к увеличению плеврального давления, необходимого для осуществления вдоха, а, следовательно, и к увеличению работы дыхания [7].
С другой стороны, при чрезмерно большом колебании инспираторного (отрицательного) давления в плевральных полостях при обструкции верхних дыхательных путей или при низкой растяжимости легких сердечный выброс может быть снижен в связи со значительным увеличением постнагрузки левого желудочка. Кроме того, такое низкое плевральное, а, следовательно, и легочное интерстициальное давление могут повысить содержание экстраваскулярной воды в лёгких и усугубить тем самым рестриктивные и диффузионные расстройства [8]. Пациент компенсирует увеличение работы дыхания уменьшением дыхательного объема и увеличением частоты дыхания.
Показано, что застой в легких влияет на сопротивление в дистальных дыхательных путях [9]. Таким образом, механический фактор приводит к нарушению вентиляции вследствие развития обструкции дыхательных путей и снижения растяжимости легочной ткани. При левожелудочковой недостаточности межрегионарная и внутрирегионарная негомогенность лёгких приводит к развитию региональной альвеолярной гипоксии [10]. Увеличение давления заклинивания лёгочной артерии приводит к патологическому распределению перфузии с реверсией апикально-базального градиента 13. Наличие дыхательной недостаточности обструктивного и рестриктивного типа, неравномерность перфузионно-вентиляционных отношений, увеличение работы дыхания обусловливают возможность применения методов респираторной поддержки у больных с острым инфарктом миокарда, осложнённым левожелудочковой недостаточностью и, следовательно, кардиогенной дыхательной недостаточностью.
Наиболее простым и логичным методом коррекции гипоксемии в данной ситуации представляется ингаляция чистого кислорода или газовой смеси с повышенным его содержанием, но было показано их отрицательное влияние на давление в малом круге кровообращения, системное сосудистое сопротивление и сердечный выброс у больных с застойной сердечной недостаточностью [14], что ограничивает возможности применения метода и заставляет рассматривать возможность механической поддержки дыхания.
Материалы и методы
Обследовано 23 больных острым инфарктом миокарда, осложненным сердечной недостаточностью. Из них: мужчин - 17, женщин - 6, пациентов с первичным инфарктом миокарда-3, с повторным инфарктом миокарда - 20. Средний возраст больных 62,4±2,4. По локализации поражения миокарда больные распределялись следующим образом: передний инфаркт микарда - 18, задний инфаркт миокарда - 3, инфаркт миокарда нижней стенки левого желудочка - 2. Диагноз инфаркта миокарда подтверждался по совокупности клинической картины, изменений электрокардиограммы, динамики кардиоспецифических ферментов. Диагноз сердечной недостаточности основывался на клинической картине: одышка в покое, наличие влажных незвонких хрипов в легких, снижения оксигенации артериальной крови по данным пульсоксиметрии. Всем больным проводилась стандартная терапия острого инфаркта миокарда и максимальная медикаментозная терапия левожелудочковой недостаточности (внутривенное введение морфина, нитратов под контролем уровня артериального давления, мочегонные препараты, при необходимости допамин или добутамин в дозах от 1 до 10 мкг/кг/мин, сердечные гликозиды). Всем больным проводилось измерение параметров центральной гемодинамики и определение сердечного выброса методом термодилюции на аппарате AS 3 фирмы DATEX с расчетом производных гемодинамических величин, определение газового состава артериальной и смешанной венозной крови с последующим расчетом показателей кислородного транспорта. Кроме того, проводился стандартный мониторинг, включающий оценку ЭКГ, частоты дыхания и пульсоксиметрию. После проведения первичного обследования больным проводилась респираторная поддержка аппаратом «Puritan Bennett 7200» в режиме СРАР с установкой СРАР (постоянное положительное давление в дыхательных путях) 4,2±2,7 см Н2О либо PS (поддержка давлением) 17,6±5,7 см Н2О, после которой вновь проводилось подобное обследование.
Результаты исследования обработаны в стандартной статистической программе Excel (двухвыборочный т-тест с различными дисперсиями). Хорошая и удовлетворительная переносимость неинвазивной вентиляции легких с положительным давлением (NIPPV) наблюдалась у 92% пациентов. Из осложнений отметим следующие: давление маски на лицо, затрудненный выдох (при ПДКВ более 8 см вод. ст.), снижение АД (при исходном ДЗЛА 5 мм Нg), пролежни от давления маски на лицо (при продолжительности вентиляции 7 сут).
Клиническое улучшение зафиксировано у 87% пациентов в течение первых 20-30 мин. проведения NIPPV и выражалось в снижении ЧДД и ЧСС, улучшении психоэмоционального состояния, уменьшении цианоза и акроцианоза, значительном снижении количества влажных застойных хрипов в легких.
Нами получены следующие данные об изменении показателей центральной гемодинамики и газового состава крови (табл. 1).
Как видно из данных, представленных в таблице, под влиянием NIPPV происходило достоверное снижение частоты дыхания, частоты сердечных сокращений (ЧСС), снижение среднего давления в легочной артерии (Ср.ДЛА), давления заклинивания легочной артерии (ДЗЛА), возрастал индекс ударной работы левого желудочка (ИУРЛЖ) без достоверного снижения индекса ударной работы правого желудочка (ИУРПЖ). Происходило возрастание парциального давления кислорода в артериальной (рО2А) и смешанной венозной крови (рО2ЛА). Уменьшался шунт крови (Qs/Qt).
Таким образом, метод поддержки давлением и постоянно повышенного давления в дыхательных путях, не оказывая отрицательного влияния на центральную гемодинамику, позволяет корригировать гипоксемию, транспорт и потребление кислорода у пациентов с кардиогенной дыхательной недостаточностью, обусловленной острым инфарктом миокарда.
Неинвазивность, хорошая переносимость, эффективность, отсутствие необходимости в седации делают методы неинвазивной респираторной поддержки у больных с явлениями острой сердечной недостаточности, осложнившей острый инфаркт миокарда, важным компонентом в лечении.
- Неинвазивная вентиляция легких хорошо переносится пациентами с ОИМ, осложненным острой левожелудочковой недостаточностью.
- Под влиянием NIPPV у этих пациентов происходило достоверное снижение гидростатического легочного капиллярного давления без угнетения насосной функции сердца.
- Неинвазивная вентиляция легких позволяла достоверно уменьшить степень гипоксемии, снизить процент шунтирования крови в легких без увеличения фракции вдыхаемого кислорода.
- На фоне неинвазивной вентиляции происходило быстрое клиническое улучшение состояния пациентов за счет купирования или уменьшения степени отека легких.
1. Голиков А.П. Достижения и перспективы научных исследований в области неотложной кардиологии. Кардиология. Том 41. 09. 2001. стр. 47-50.
2. Ole Siggaard-Andersen, Niels Fogh-Andersen, Ivar H.Gothen, Vagn Hojkjaer Larsen //Oxygen status of arterial and mixed venous blood.-Critical Care Medicine.-1995.vol.25.№7.
3. Frank. N. R.. Lyons, H. A.. Siebens. A. A., and Nealon. T. F.: Pulmonary compliance in patients with cardiac disease. Am. J. Med. 22:516, 1957;
4. Wood, T. E., McLeod, P., Anthonisen, N. R., and Macklem. P. T.: Mechanics of breathing in mitral stenosis. Am. Rev. Resp. Dis. 104:52, 1971.
5. Saxton,G.A., Jr., Rabinowitz, M., Dexter, L., and Haynes, F.: The relationship of pulmonary compliance to pulmonary vascular pressures in patients with heart disease. J. Clin. Invest. 35:611, 1965.
6. Collins J. V., Clark. T. J. H., and Brown D. J. Airway function in healthy subjects and in patients with left heart disease. Clin. Sci. Molec. Med. 49:217, 1975.
7. Marshall R., Mclroy M. B., and Christie R. V.: The work of breathing in mitral stenosis. Clin. Sci. 13:137, 1954.
9. Collins J. V., Clark. T. J. H., and Brown D. J. Airway function in healthy subjects and in patients with left heart disease. Clin. Sci. Molec. Med. 49:217, 1975.
10. Raine, J., and Bishop, J. M.: The distribution of alveolar ventilation in mitral stenosis at rest and after exercise. Clin. Sci. 24:63, 1963.
11. James, A. E., Jr., Cooper, M., White, R. I.,and Wagner, H. N., Jr.: Perfusion changes on lungs in patients with congestive heart taillires. Radiology 100:99, 1971.
12. Giuntini, C., Mariani, M., Barsotti, A., Fazio, F., and Santolicandro. A. Factors affecting regional pulmonary blood flow in left heart valvular disease. Am. J. Med. 57:421, 1974.
13. Pain, M. C. F., Bucens, D., Cade, J. F., and Sloman, .J. G.: Regional lung function in patients with mitral stenosis. Aust. N.Z. J. Med. :228, 1972.
14. Wasim A.Haque, M.D., Joohn Boehmer, Barry S. Clemson, Urs A. Hemodinamic Effects of Supplemental Oxygen Administration in Congestive Heart Failure. JACC Vol.27, №2 February 1996,353-357.
В обзорной статье рассматривается роль антагонистов минералокортикоидных рецепторов (АМР) в лечении сердечной недостаточности (СН) у больных, перенесших острый инфаркт миокарда (ОИМ). Рассматриваются патогенетические основы воздействия АМР на ремоделирование миокарда после ОИМ. Описаны фармакологические характеристики препаратов данного класса: спиронолактона и эплеренона. Освещены результаты основных исследований, доказывающих протективную роль эплеренона у больных, перенесших ОИМ с СН различной степени тяжести (EPHESUS, EMPHASIS-HF, ALBATROSS, REMINDER). Проанализирована эффективность эплеренона в зависимости от сроков его назначения. Рассмотрена безопасность препарата в сравнении со спиронолактоном. В заключение сделан вывод о целесообразности использования этих препаратов в рутинной терапии в острый, подострый и отдаленный периоды ОИМ с подъемом сегмента ST и с фракцией выброса левого желудочка ≤40%, СН или сахарным диабетом, когда пациенты уже получают ингибиторы ангиотензинпревращающего фермента и бета-блокаторы и при условии отсутствия почечной недостаточности или гиперкалиемии. При этом предпочтение стоит отдать эплеренону как препарату, имеющему наиболее убедительную доказательную базу и обладающему благоприятным профилем переносимости. Внедрение в лечебную практику эффективных доступных дженериков эплеренона позволяет расширить его использование в реальной клинической практике.
Ключевые слова: инфаркт миокарда, осложнения, сердечная недостаточность, ремоделирование сердца, эплеренон, Иплерон.
M.D. Smirnova, F.T. Ageev
National Medical Research Center of Cardiology, Moscow
The review article examines the role of mineralocorticoid receptor antagonists (MCRA) in the heart failure (HF) treatment in patients after acute myocardial infarction (AMI). The pathogenetic basis of the MCRA effects on cardiac remodelling after AMI is considered. The pharmacological characteristics of this medicinal product class — spironolactone and eplerenone — are also described. The main study results proving the eplerenone protective role in patients after AMI with HF of varying severity (EPHESUS, EMPHASIS-HF, ALBATROSS, REMINDER) are highlighted. The article presents an analysis of the eplerenone effectiveness depending on the timing of its appointment, as well as the drug safety in comparison with spironolactone. To sum up, it is advisable to use these medicinal products in routine therapy in the acute, subacute and long-term periods of AMI with an increase in the ST-segment of MCRA prescription fo r patients with left ventricular ejection fraction ≤40%, HF or diabetes mellitus, who are already receiving angiotensin-converting enzyme and beta-blockers in the absence of renal failure or hyperpotassemia. Moreover, preference should be given to eplerenone, as a drug that has the most convincing evidence base and has a favorable tolerance profile. The effective generic eplerenone introduction into medical practice makes it possible to expand its use in real clinical practice
Keywords: myocardial infarction, complications, heart failure, cardiac remodelling, eplerenone, Ipleron.
For citation: Smirnova M.D., Ageev F.T. Chronic heart failure as a myocardial infarction complication: therapy features. RMJ. Medical Review. 2019;10(I):40-44.
Для цитирования: Хроническая сердечная недостаточность как осложнение инфаркта миокарда: особенности терапии. РМЖ. Медицинское обозрение. 2019;3(10(I)):40-44.
В обзорной статье рассматривается роль антагонистов минералокортикоидных рецепторов в лечении сердечной недостаточности у больных, перенесших острый инфаркт миокарда
Введение
Ремоделирование сердца после ОИМ: особенности и механизмы
Процесс постинфарктного ремоделирования сердца, включающий дилатацию его полостей, изменение геометрии и нарушение сократимости ЛЖ, начинается с первых часов ОИМ и завершается к 2-6-му мес. заболевания. Ремоделирование сердца определяется как общий процесс адаптации, который позволяет кардиомиоцитам и коллагеновой сети приспосабливаться к работе в изменившихся условиях. Ремоделирование вследствие ОИМ имеет ряд особенностей. Например, оно асимметрично и связано с локализацией зоны некроза [6]. В литературе подробно освещены механизмы ремоделирования ЛЖ после ОИМ без восстановления реперфузии [7]. Однако ремоделирование происходит и у больных с ОИМ и успешной реперфузией миокарда. Раннее возобновление перфузии участка миокарда, подвергшегося острой ишемии, ограничивает размеры зоны гибели кардиомиоцитов, снижая тем самым вероятность как летального исхода, так и развития ОСН [8]. Но все же в силу изначальной потери кардиомиоцитов и, как следствие, снижения сократительной функции сердца все основные этапы ремоделирования сохраняются. Патофизиологической основой данного процесса, по современным представлениям, является активация нейрогуморальных механизмов. В ответ на развитие острой ишемии растут уровни норадреналина, цитокинов, эндотелина, вазопрессина, ангиотензина II (AT II) и альдостерона. Увеличение синтеза альдостерона реализуется посредством активации рецепторов к AT II 1 типа, роста кардиального уровня АТ II и активности альдостерон-синтазы мРНК [9]. Высокие уровни альдостерона в плазме и моче у больных ОИМ определяются уже в первые часы и достигают максимума к 3-му дню заболевания. У 58% пациентов уровень альдостерона остается высоким и в отдаленные сроки [10]. Как любой адаптационный процесс, первоначально активация симпатоадреналовой системы и ренин-ангиотензин-альдостероновой системы (РААС) служит защитным механизмом, действие которого направлено на компенсацию развивающихся гемодинамических нарушений (снижение сердечного выброса, уменьшение объема циркулирующей крови). Однако при хроническом течении заболевания происходит гиперактивация этих, изначально физиологических, процессов, в результате чего они приобретают патологический характер. Так, было установлено, что альдостерон играет основную роль в развитии ряда отрицательных клинических проявлений: задержки натрия и жидкости, эндотелиальной дисфункции, гипертрофии ЛЖ и фибротических изменений миокарда [11, 12]. Доказано, что повышение уровня альдостерона и АТ II сопряжено с более высокой смертностью пациентов с ХСН [13]. Высокий уровень альдостерона показал себя как отрицательный предиктор выживаемости больных после ОИМ. Так, у больных
с высокой (≥141 пг/мл) концентрацией альдостерона в крови риск смерти в течение 5 лет после ОИМ в 2 раза выше, чем с низкой (
Основным результатом воздействия ишемии и вазоактивных пептидов становится повышение синтеза и концентрации коллагена [15, 16], преобладающих над его распадом и, как следствие, прогрессирование фиброза миокарда. Причиной развития ХСН выступает, таким образом, не только потеря мышечной ткани в результате некроза, но и развитие фиброза, который и является решающим фактором в данном процессе. Эти механизмы тесно взаимосвязаны. Через несколько месяцев после ОИМ в миокарде по-прежнему сохраняются зоны гибернации и апоптоза в комбинации с участками фиброза, с потерей вещества миокарда и частичной неспособностью к процессам адаптации и регенерации. Именно фиброз — главный маркер ХСН и решающий показатель миокардиальной гетерогенности, увеличивающей диастолическую жесткость и склонность к аритмиям. На сегодняшний день альдостерон как главный участник фиброзного процесса рассматривается в качестве важнейшего нейрогуморального фактора развития так называемого электрического ремоделирования миокарда при ХСН и после ОИМ. В частности, доказано, что альдостерон участвует в изменении функции ионных каналов мембраны кардиомиоцитов и нарушении реполяризации. При ОИМ этот процесс развивается уже на ранних этапах, предшествуя нарушениям структуры и функции ЛЖ. Он служит предиктором возникновения жизнеугрожающих желудочковых аритмий и внезапной сердечной смерти (ВСС). Исследования последних десятилетий доказали, что негативная роль гиперальдостеронизма при ХСН также связана с развитием периваскулярного воспаления, дисфункцией эндотелия и васкулопатией, индуцированием окислительного стресса в кардиомиоцитах [9, 17, 18]. Важная роль альдостерона в патогенезе ремоделирования сердца после ОИМ определяет ведущую роль блокады РААС (и альдостерона) в лечении и профилактике СН у этих больных.
Роль антагонистов минералокортикоидных рецепторов в профилактике и лечении СН после ОИМ
Ранее считалось, что применение ингибиторов ангиотензинпревращающего фермента (ИАПФ) и блокаторов рецепторов к АТ II (БРА II) обеспечивает достаточное подавление активности альдостерона. Однако показано, что у 38% пациентов, длительно принимающих ИАПФ, напротив, отмечается повышение уровня альдостерона [19, 20].
В одном из исследований у пациентов, получавших одновременно ИАПФ и БРА II, наблюдался достоверно более низкий уровень альдостерона на 17-й нед. терапии, однако на 43-й нед. лечения этот эффект нивелировался [21]. Такой феномен получил название «эффект ускользания альдостерона». В его основе лежат несколько патофизиологических механизмов, и ведущим из них является реактивация АТ II (стимулятор высвобождения альдостерона) в ходе длительной терапии ИАПФ [19]. Причем «эффект ускользания альдостерона» развивается у пациентов независимо от дозы ИАПФ [22]. Кроме того, существуют данные, что некоторое количество альдостерона синтезируется непосредственно клетками эндотелия, кардиомиоцитами и гладкомышечными клетками кровеносных сосудов, тогда как ИАПФ и БРА II воздействуют только на синтез альдостерона надпочечниками [23]. При этом существует мнение, что именно локальный синтез альдостерона в сердце играет ведущую роль в постинфарктном ремоделировании [9].
Независимо от механизма «эффект ускользания альдостерона» может снижать эффективность ИАПФ и БРА II, что влечет за собой ухудшение прогноза пациентов с ХСН. Это служит дополнительным доводом в пользу назначения препаратов с «антиальдостероновым» действием, антагонистов минералокортикоидных рецепторов (АМР) альдостерона, этой категории пациентов.
К сожалению, именно эти препараты часто остаются невостребованными в реальной клинической практике. Причем низкая приверженность лечению ими касается как больных («зачем мне мочегонные, если нет отеков»), так и врачей. Согласно статистике в США эти препараты назначаются только 32% тех больных, которым они показаны [24, 25]. В европейских странах этот показатель в 2012 г. составлял 33-36% [26]. В РФ доля больных, принимающих спиронолактон, по данным исследования ЭПОХА (2014) [2], составляет всего 11%. Именно эти препараты наиболее часто «теряются» при длительной терапии ХСН. Прекращение приема АМР больными ХСН было отмечено в 54,7% случаев [2].
Клиническая эффективность антагонистов минералокортикоидных рецепторов
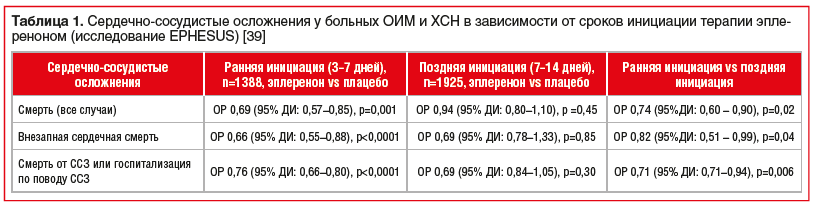
Ниже мы приведем данные основных исследований, доказавших эффективность АМР при ХСН, в т. ч. развившейся вследствие перенесенного ОИМ. Первые данные о положительном влиянии спиронолактона на течение тяжелой ХСН были получены в ходе многоцентрового плацебо-контролируемого исследования RALES (Randomized Aldactone Evaluation Study) в 1999 г. [27]. Прием спиронолактона в дополнение к стандартной терапии ХСН у больных с тяжелой ХСН (III-IV функционального класса (ФК) по NYHA) со сниженной фракцией выброса (ФВ) ЛЖ ишемической и неишемической этиологии приводил к снижению риска серьезных осложнений и увеличению выживаемости пациентов. Применение спиронолактона уменьшало число случаев ВСС и смерти от прогрессирующей недостаточности кровообращения, а также число госпитализаций из-за декомпенсации ХСН [27]. Больные с ПИКС в отдельную группу в этом исследовании не выделялись. Однако в ряде работ показана перспективность использования этого препарата после ОИМ. Доказано, что прием спиронолактона позволяет предотвратить ремоделирование миокарда ЛЖ после ОИМ даже у пациентов, принимающих ИАПФ. Спиронолактон подавляет избыточный синтез N-концевого фрагмента проколлагена III после ОИМ [28]. Схожие результаты — подавление фиброза и ремоделирования миокарда — были получены в исследовании, в котором эплеренон назначался в комбинации с БРА II [29]. В ряде исследований показано, что блокада рецепторов альдостерона в ранние сроки — в течение 7 дней [30] или 4 нед. [31] после ОИМ — уменьшала фиброз в жизнеспособном миокарде. При этом добавление к терапии ИАПФ спиронолактона у крыс с СН после ОИМ значительно увеличивало биодоступность оксида азота [32]. Эплеренон в эксперименте снижал окислительный стресс [33]. Исследования на животных и людях показали и другие кардиальные и периферические эффекты АМР, в т. ч. эплеренона: торможение развития воспалительных поражений коронарных артерий, ремоделирования миокарда и предсердий [34], улучшение вазомоторной реактивности [35] и противовоспалительное нефропротективное действие [36].
![Таблица 1. Сердечно-сосудистые осложнения у больных ОИМ и ХСН в зависимости от сроков инициации терапии эплереноном (исследование EPHESUS) [39]](https://www.rmj.ru/upload/medialibrary/286/40-1.png)
Эплеренон или спиронолактон: что выбрать?
На сегодняшний день эффективность и профиль безопасности спиронолактона и эплеренона напрямую не сравнивались. В рекомендациях по лечению ХСН при ОИМ [48, 49] упоминаются АМР без указания конкретного препарата. Большинство врачей предпочитают более привычный препарат — спиронолактон [9]. Однако следует помнить, что, во‑первых, у эплеренона более широкая доказательная база. Именно для него доказана эффективность ранней инициации при ОИМ, а также у больных ХСН II ФК с низкой ФВ. Во-вторых, эплеренон имеет более благоприятный профиль переносимости, следовательно, больные, принимающие этот препарат, демонстрируют более высокую приверженность терапии [50]. При выборе АМР нередко определяющим фактором является цена. Именно высокая стоимость препятствует широкому применению эплеренона. Эту проблему призвано решить внедрение в лечебную практику более доступных и не менее эффективных дженериков эплеренона [9]. Один из них, Иплерон («Синтон Испания, С.Л.»), производится в Испании по стандартам GMP. Проведенное сравнительное исследование биоэквивалентности оригинального эплеренона (таблетки, покрытые пленочной оболочкой, 50 мг) и Иплерона (таблетки, покрытые пленочной оболочкой, 50 мг) дало положительные результаты (рис. 1).

Заключение
Таким образом, в рутинной терапии в острый, подострый и отдаленный периоды ОИМ с пST АМР рекомендованы пациентам с ФВ ЛЖ ≤ 40%, СН или СД, которые уже получают ИАПФ и бета-адреноблокаторы при условии отсутствия почечной недостаточности или гиперкалиемии [49]. Причем, строго говоря, эти рекомендации относятся именно к эплеренону как препарату, имеющему наиболее убедительную доказательную базу. Внедрение эффективных доступных дженериков эплеренона, таких как Иплерон, помогает расширить его использование в реальной клинической практике.
Список литературы Свернуть Развернуть
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Повторный инфаркт миокарда
Повторный инфаркт миокарда - это некроз сердечной мышцы, возникающий после полного завершения предыдущего инфаркта миокарда. Провоцирующими факторами выступают несоблюдение пациентом схемы поддерживающей терапии, физические и умственные перегрузки, тяжелые формы дислипидемии и другие сопутствующие болезни. Патология проявляется некупируемыми сжимающими болями в области сердца, одышкой, предобморочным состоянием, неконтролируемым чувством страха. Для диагностики назначают ЭКГ, ЭхоКГ, коронарографию и комплекс лабораторных исследований. Основу лечения составляет экстренная реперфузия с помощью фибринолитиков, стентирования, баллонной ангиопластики.
МКБ-10


Общие сведения
Повторные коронарные атаки наблюдаются как минимум у 26,5% пациентов, перенесших инфаркт миокарда (ИМ). Около трети случаев происходит в течение первого года после первичного эпизода нарушения кровотока в сердечной мышце. При постановке диагноза стоит учитывать различия в терминологии: в российской кардиологии повторными называют инфаркты, развивающиеся спустя 8 и более недель от первого сердечного приступа, тогда как в зарубежной практике к этой категории относят второй, третий и все последующие случаи ИМ без привязки к временным интервалам.

Причины
Пациенты, которые сталкивались с критическими кардиоваскулярными событиями, имеют повышенный риск повторного развития инфаркта. Это связано с наличием рубца на миокарде и другими структурно-функциональными патологиями сердечной мышцы, которые нарушают гемодинамику, ухудшают адаптацию сердечно-сосудистой системы к изменяющимся параметрам кровотока. Предрасполагающими факторами формирования повторного инфаркта миокарда (ПИМ) выступают:
- Низкая приверженность терапии. По прошествии 6 месяцев после острого инфаркта только 82% больных продолжают принимать назначенную врачом антитромботическую терапию, к концу первого года лечения комплаенс больных понижается до 38%. Это способствует прогрессирующим нарушениям гемодинамики и повышенному риску тромбозов.
- Стрессовые факторы. В периоде реабилитации после ИМ больные проявляют повышенную чувствительность к эмоциональным и физическим нагрузкам, поэтому несоблюдение щадящего режима чревато острым коронарным синдромом (ОКС). Осложнение возникает вследствие неполного восстановления функции кардиоваскулярной системы.
- Рефрактерная дислипидемия. Нарушения липидного обмена, которые не удается корректировать комбинацией гиполипидемических препаратов, в разы повышают вероятность повторных инфарктов. Для заболевания характерна нестабильность атеросклеротических бляшек, вследствие чего они могут спонтанно отрываться и закупоривать коронарные сосуды.
- Немодифицируемые факторы. К ним относят отягощенную наследственность, мужской пол и пожилой возраст. Эти причины аналогичны таковым при первичном инфаркте, у больных с ишемическими атаками в анамнезе они также имеют большую значимость.
Факторы риска
В группе риска возникновения повторных инфарктов миокарда находятся пациенты с сопутствующими заболеваниями. Вероятность патологии резко повышается при аутоиммунных болезнях: узелковом периартериите, ревматоидном артрите, системной красной волчанке. Предрасполагающим фактором инфаркта являются заболевания крови (тромбоцитопеническая пурпура, истинная полицитемия, тромбоцитозы), метаболические нарушения (амилоидоз, мукополисахаридоз, гомоцистинурия). Острые коронарные атаки чаще возникают у пациентов с установленным искусственным клапаном сердца.
Патогенез
Гибель участка сердечной мышцы при повторном инфаркте происходит по тем же законам, что и первичный случай ОКС. У большинства больных пусковым фактором выступает закупорка сосуда атеросклеротической бляшкой в результате разрыва ее фиброзной капсулы, эрозии стенки, протрузии кальцинированных участков в артериальный просвет. Изредка ПИМ наблюдается при быстром накоплении атеросклеротических отложений в сосудах или кровоизлияниях в эту зону.
Вторым этапом патогенеза является ограничение кровотока в одной из зон сердечной мышцы, которое усугубляется остаточными нарушениями перфузии после предыдущего сердечного приступа. Обратимая ишемия продолжается в течение 2-4 часов, после чего наблюдается гибель миокарда. Далее происходит ферментативное расплавление мышечной ткани, развиваются процессы воспаления и инфильтрации миокарда лейкоцитами, после чего начинается организация рубца.

Классификация
Систематизация повторного инфаркта миокарда не отличается от общепринятой в практической кардиологии. По клиническому течению выделяют развивающийся ИМ — в первые 6 часов, острый - от 6 часов до 7 дней, рубцующийся— 7-28 дней, заживший — с 29 дня болезни. При постановке окончательного диагноза используются разные виды классификаций ПИМ:
- По степени тяжести. Согласно Killip, выделяют 4 класса ИМ - от отсутствия сердечной недостаточности (I) до кардиогенного шока (IV).
- По особенностям патогенеза. Различают повторный инфаркт миокарда с подъемом сегмента ST, который возникает при трансмуральном повреждении и полной окклюзии магистральной венечной артерии, и без подъема ST, развивающийся при ограничении кровотока на небольшом участке.
- По локализации. В зависимости от локализации повреждения сердечной мышцы левого желудочка выделяют переднебоковой, передневерхушечный, нижнебоковой, заднебазальный и другие варианты ПИМ. В особую категорию относят правожелудочковый инфаркт.
- По глубине повреждения. Наиболее опасным является трансмуральный ИМ, который захватывает все слои миокарда. Также выделяют интрамуральный, субэпикардиальный и субэндокардиальный варианты заболевания.
Симптомы повторного инфаркта миокарда
По клиническому течению ПИМ практически не отличается от впервые возникшего коронарного синдрома. Однако у пациентов с предшествующими ишемическими событиями в анамнезе чаще развиваются атипичные, в том числе безболевые формы инфаркта миокарда. У трети больных наблюдается продромальный период в виде сжимающих болей в груди, перебоев в работе сердца. Далее инфаркт проходит типичные периоды: острейший, острый, подострый и постинфарктный.
При классической форме ИМ основной жалобой пациентов являются резкие боли в левой половине грудной клетки. Они возникают внезапно, могут быть связаны с сильным стрессом или физической активностью. Болевой синдром длится дольше 20 минут, не поддается купированию нитроглицерином, как обычный приступ стенокардии. Боли отдают в руку, лопатку, нижнюю челюсть. Пациент ощущает сильное беспокойство и страх смерти, его кожа покрывается холодным потом и резко бледнеет.
Для астматического варианта характерна сильная одышка и приступ удушья, возникающий без видимой причины. Для облегчения состояния человек занимает положение сидя с упором руками на колени (ортопноэ). Боли в грудной клетке имеют невысокую интенсивность, многие пациенты их не замечают, поскольку внимание сфокусировано на расстройствах дыхания. Тяжелые формы ПИМ сопровождаются хрипами, выделением розовой пены изо рта.
Повторный инфаркт миокарда может протекать в абдоминальной форме, особенно если очаг некроза расположен в нижних отделах сердца. В этом случае интенсивные боли возникают в эпигастральной области. Они напоминают приступ острого панкреатита, гастрита, обострения язвенной болезни. Иррадиация болевого синдрома происходит в межлопаточную область. Больные страдают от тошноты, отрыжки, длительной икоты.
Реже наблюдается аритмическая форма, которая проявляется сильным сердцебиением, приступом головокружения, слабостью. Нарушения центрального кровотока вызывают кратковременные обмороки. Похоже симптомы имеет цереброваскулярный вариант повторного инфаркта, который проявляется симптомами ишемии головного мозга. Изредка наблюдается малосимптомный (стертый) вариант течения ПИМ.
Осложнения
К острым последствиям относят левожелудочковую недостаточность - отек легких и кардиогенный шок. До 90% пациентов имеют нарушения ритма и проводимости, которые иногда переходят в фибрилляцию желудочков и чреваты летальным исходом. Около 15% больных рискуют столкнуться с аневризмой левого желудочка, развивающейся при обширных трансмуральных инфарктах. К поздним осложнениям относят синдром Дресслера, тромбоэндокардит, постинфарктную стенокардию.
Диагностика
Пациенты с признаками сердечного приступа требуют экстренной помощи кардиолога или врача реанимационного отделения. При обследовании определяют неспецифические симптомы острой сердечной недостаточности, по возможности узнают медицинскую историю пациента и наличие у него инфаркта миокарда в прошлом. Обследование проводится в первые 2 часа от поступления больного в стационар, включает следующие методы диагностики:
- ЭКГ. Острая ишемия миокарда определяется при подъеме сегмента ST. К специфическим признакам ИМ относят глубокий зубец Q в стандартных или грудных отведениях, слишком широкий зубец R в сочетании с конкордантным позитивным зубцом Т. При подозрении на поражение задней стенке сердца показана регистрация кардиограммы в дополнительных отведениях V7-V9.
- УЗИ сердца. Эхокардиография назначается при критических проявлениях сердечной недостаточности, в том числе при кардиогенном шоке. Исследование информативно для выявления функциональных нарушений сердечной деятельности, которые возникают в первые минуты от развития инфаркта еще до грубых изменений на электрокардиограмме.
- Коронарография. Рентгенконтрастное исследование венечных сосудов, питающих миокард, признано «золотым стандартом» для подтверждения ПИМ. По результатам диагностики определяют наличие, степень и локализацию тромбоза сосудов, выбирают оптимальный метод консервативного или хирургического устранения препятствий кровотоку.
- Лабораторный комплекс. В кратчайшие сроки после поступления выполняют анализы на тропонин, КФК и прочие миокардиальные маркеры. Полная диагностическая программа включает клинический анализ крови, липидограмму, исследования на глюкозу и гликированный гемоглобин. Ценное прогностическое значение имеет оценка электролитного спектра крови, уровня Д-димера и натрийуретического пептида.
Дифференциальная диагностика
При остром болевом синдроме в груди слева исключают расслоение аорты, тромбоэмболию легочной артерии, перикардит. Сопутствующие нарушения дыхания требуют дифференциальной диагностики со спонтанным пневмотораксом. Атипичные формы повторного инфаркта дифференцируют с острым панкреатитом, пневмонией, межреберной невралгией. При отсутствии четких электрокардиографических и лабораторных критерий ИМ важно исключить нестабильную стенокардию.

Лечение повторного инфаркта миокарда
Экстренная медикаментозная терапия
Первичные терапевтические мероприятия включают введение опиоидных анальгетиков для ликвидации болевого синдрома и оксигенотерапию при снижении сатурации менее 90%. При повторном инфаркте миокарда сразу назначают нагрузочные дозы ацетилсалициловой кислоты в комбинации со вторым антиагрегантом по выбору врача. Терапия дополняется внутривенным введением антикоагулянтов, применением транквилизаторов при выраженной тревожности и беспокойстве больного.
При наличии противопоказаний или технической невозможности проведения хирургического вмешательства стратегией выбора признана фибринолитическая терапия. Она проводится в первые 12 часов от поступления больного и направлена на растворение тромба в венечном сосуде. Вовремя выполненный фибринолиз восстанавливает кровообращение и создает условия для нормализации функций участка миокарда, который находился в состоянии обратимой ишемии.
Хирургическое лечение
Чрескожное коронарное вмешательство (ЧВК) является стандартом реперфузионной терапии у пациентов с повторными инфарктами миокарда. ЧВК рекомендовано всем больным при подъеме ST на кардиограмме, пациентам без элевации ST, которые имеют признаки гемодинамической нестабильности, длительные боли в груди, жизнеугрожающую аритмию. Предпочтительным вариантом является установка стентов с лекарственными покрытиями, альтернативное лечение — баллонная ангиопластика.
Поддерживающая терапия
После стабилизации состояния и выписки пациента назначается продолжительная или даже пожизненная фармакотерапия, направленная на предупреждение повторных случаев инфаркта миокарда. Стандартом лечения называют двойную антитромботическую терапию (ДАТТ), которая включает комбинацию 2-х антиагрегантов. По показаниям проводится тройная терапия, включающая ДАТТ и один антикоагулянт, двойная терапия — антиагрегант и пероральный антикоагулянт.
Прогноз и профилактика
Исход повторного инфаркта зависит от объема повреждения сердечной мышцы, своевременности диагностики заболевания и полноты назначенного лечения. Хотя такие пациенты имеют более высокие риски осложненного течения ИМ, при ранней и комплексной терапии удается восстановить показатели гемодинамики и работу сердечной мышцы. Основными методами профилактики ПИМ являются диспансерное наблюдение у кардиолога и соблюдение схемы ДАТТ после первичного инфаркта.
2. Повторный инфаркт миокарда: оценка, риски, профилактика/ И.В. Самородская, С.А. Бойцов// Российский кардиологический журнал. - 2017. - №6.
3. Основные факторы, определяющие риск развития повторного инфаркта миокарда/ О.Л. Барбараш, Д.Ю. Седых, Е.В. Горбунова// Сердце: журнал для практикующих врачей. - 2017. - №1.
4. Прогнозирование повторного инфаркта миокарда у больных с постинфарктным кардиосклерозом/ А.Н. Шопин// Практическая медицина. - 2011. - №1.
Читайте также:
- Техника транспедикулярного доступа и костотрансверзэктомии при опухоли грудного позвонка
- Нижние пары черепных нервов: подъязычный нерв, добавочный нерв, языкоглоточный нерв, блуждающий нерв
- Глазные причины аномалия положения головы (тортиколлиса)
- Этапы развития абсцессов мозга. Морфология отогенных абсцессов мозга
- Ассиметрия полушарий мозга у правшей и левшей: преобладание одной из рук, рукость
