Профилирование экспрессии генов для прогноза рака молочной железы
Обновлено: 17.05.2024
Согласно данным крупного проспективного исследования 70% женщин с ранней стадией гормоночувствительного, Her2/neu негативного рака молочной железы не получают никакой пользы от добавления химиотерапии к гормонотерапии в адъювантном (послеоперационном) режиме.
Данные британского мета-анализа показали, что адъювантная (после хирургического лечения) химиотерапия снижает риск рецидива рака молочной железы. Однако не всем пациентам она полезна в равной степени.
Исследования показывают, что при гормоночувствительном раке молочной железы без поражения лимфоузлов, добавление к гормонотерапии химиотерапии снижает риск рецидива не более чем на 5%.
Возможно, химиотерапия в таких случаях приносит больше вреда, чем пользы, поскольку всегда связана с побочными эффектами.
Помочь врачу принять решение о рациональности назначения химиотерапии могут геномные тесты.
На данный момент есть только два теста, пользу которых изучали в проспективных рандомизированных исследованиях - Oncotype DX RS и MammaPrint.
Oncotype DX RS и MammaPrint - геномные панели, которые позволяют оценить риск рецидива рака молочной железы, а также определить необходимость добавления химиотерапии к гормонотерапии в адъювантном режиме, у пациенток с ранним гормончуствтиельным, Her2/neu негативным раком молочной железы.
NCCN (National Comprehensive Cancer Network) рекомендует использование Oncotype DX и MammaPrint для оценки пользы добавления химиотерапии, поскольку остальные тесты могут давать противоречивые результаты, что было показано в исследовании OPTIMA Prelim Trial.
Что такое Oncotype DX?
Oncotype DX - метод геномного тестирования, с помощью которого определяется экспрессия 21 гена методом RT-ПЦР в ткани опухоли у больных раком молочной железы.
Это тестирование выполняется у женщин с раком молочной железы ранней стадии (I или II), у которых по результатам гистологического и иммуногистохимического исследования:
- гормоночувствительный рак молочной железы (люминальный);
- отсутствует гиперэкспрессия рецепторов HER2/neu (HER2/neu-);
- поражено от 1 до 3 лимфатических узлов (при постменопаузе);
- отсутствует поражение лимфоузлов (в пременопаузе).
Как выполняется исследование?
Блоки с тканью опухоли, полученной в ходе операции или биопсии, отправляются в специализированную лабораторию. Анализ 21 гена опухолевого материала, позволяет сделать прогноз, определить вероятность возвращения рака, и выяснить, снизит ли проведение химиотерапии эту вероятность.
В качестве результата рассчитывается показатель по шкале рецидива (RS или Recurrence Score), на бланке выставляется балл от 0 до 100, риск прогрессирования заболевания в течение 9 лет и пользы от добавления химиотерапии.

Пример заключения теста OncotypeDx
Как врач интерпретирует результаты?
Для пациентов со злокачественной опухолью молочной железы размером до 5 см (T1b/c - T2), гормонопозитивной, Her2/neu негативной и без поражения лимфатических узлов.
- Согласно рекомендациям NCCN пациентки в постменопаузе с результатом по шкале рецидива (RS) от 0 до 25 не получают преимуществ от добавления химиотерапии после операции. Химиотерапия снижала шанс отдаленных рецидивов через 9 лет на 1% в TAILORx trial.
- Однако женщинам в пременопаузе с результатом по шкале рецидива (RS) от 16 до 25 добавление химиотерапии было полезно, что также было показано в этом исследовании.
- Для пациенток с результатом по шкале рецидива (RS) от 26 до 30 нет проспективных данных об отсутствии пользы от химиотерапии. NCCN рекомендует оценить клинические и патоморфологические особенности опухоли для принятия решения.
- По данным исследования NSABP B20 у пациенток с результатом по шкале рецидива (RS) > 31 добавление химиотерапии снижает вероятность рецидива заболевания через 10 лет на 27,6%.
Для пациентов с гормонопозитивным, Her2/neu негативным раком молочной железы, с поражением от 1 до 3 лимфатических узлов.
- Согласно данным исследования RxPONDER пациентки в постменопаузе с результатом по шкале рецидива (RS) от 0 до 25 не получали преимуществ от химиотерапии в адъювантном режиме. Она увеличивала выживаемость без признаков инвазивного заболевания в течение 5 лет всего на 0,3%.
- У пациенток в пременопаузе с результатом по шкале рецидива (RS) от 0 до 25 добавление химиотерапии к гормонотерапии давало преимущество - увеличивало выживаемость без признаков инвазивного заболевания в течение 5 лет на 5,2%.
- Согласно данным повторного анализа исследования SWOG-8814 у пациентов с результатом по шкале рецидива (RS) от 25 до 31 высок риск прогрессирования заболевания. Для этой группы пациентов NCCN рекомендует рассмотреть добавление химиотерапии к гормонотерапии в адъювантном режиме.
Где провести и сколько стоит?
Исследование Oncotype Dx в Москве в 2021 году стоит около 250 тысяч рублей.
Что такое Mammaprint?
Mammaprint - метод геномного тестирования, анализирующий экспрессию 70 генов в опухолевой ткани.
Это тестирование выполняется у женщин с раком молочной железы ранней стадии (I,II или операбельная III), у которых:
- Размер первичной опухоли до 5 см;
- поражено от 0 до 3 лимфатических узлов;
- высокий клинический риск рецидива, оцененный в программе Adjuvant online.
По результатам теста пациенту выставляется низкий генетический риск рецидива или высокий генетический риск рецидива.
По результатам крупного проспективного исследования пациентки с подтвержденным по MammaPrint низким геномным риском и высоким клиническим риском не имели преимуществ от добавления химиотерапии - добавление химиотерапии снижало шанс рецидива заболевания через 5 лет на 1%.
В 2021 году исследование MammaPrint в Москве стоит около 210 тысяч рублей.
Какой метод лучше?
Пока нет достоверных данных, какой из этих методов лучше. Геномная панель Mammaprint отвечает на вопрос “нужно ли проведение химиотерапии для конкретной пациентки”, а Oncotype Dx “нужно ли проведение химиотерапии для пациентки, и, если нужно, то на сколько процентов химиотерапия снижает риск рецидива”.
Список сокращений:
Her2/neu - human epidermal growth factor receptor-2 - рецептор эпидермального фактора роста человека,
NCCN - National Comprehensive Cancer Network - Национальная комплексная онкологическая сеть, включает 31 онкологический центр США,
Профилирование экспрессии генов для прогноза рака молочной железы
ФГУП «Государственный НИИ особо чистых биопрепаратов» ФМБА России, Санкт-Петербург, Россия
ГБУ Ростовской области "Патологоанатомическое бюро", Ростов-на-Дону
ГБУЗ "Приморское краевое патологоанатомическое бюро", Владивосток
Амплификации и коамплификации генов при раке молочной железы: частота встречаемости и прогностическое значение
Журнал: Архив патологии. 2013;75(1): 54‑57
Петров А.В., Павленко И.А., Горелик М.З. Амплификации и коамплификации генов при раке молочной железы: частота встречаемости и прогностическое значение. Архив патологии. 2013;75(1):54‑57.
Petrov AV, Pavlenko IA, Gorelik MZ. Gene amplification and coamplification in breast cancer: Frequency and prognosis value. Arkhiv Patologii. 2013;75(1):54‑57. (In Russ.).
Одними из наиболее частых генетических мутаций, встречающихся при карциноме молочной железы, являются численные нарушения генов или отдельных участков генома - амплификации или делеции. Рассмотрены амплификации генов при раке молочной железы, их встречаемость, прогностическая значимость и возможная роль данных нарушений для выделения подтипов этого гетерогенного заболевания.
Рак молочной железы (РМЖ) — наиболее частое злокачественное новообразование у женщин [1]. Развитие карциномы молочной железы можно описать как сложный, многоступенчатый процесс, в котором каждый шаг сопровождается одним или несколькими нарушениями в генах, ответственных за регуляцию клеточного цикла, апоптоз, пролиферацию и дифференцировку. Модель многоступенчатого формирования РМЖ можно условно изобразить следующим образом: норма → гиперплазия → атипичная гиперплазия → карцинома in situ → инвазивная карцинома → метастатический рак [2]. Разумеется, это лишь упрощенная схема. Злокачественная трансформация — динамический процесс с последовательной многоступенчатой эволюцией. На каждом из перечисленных этапов происходит генетическое событие (мутация), придающее клетке-носителю дополнительные селективные преимущества. В результате происходит не только пролиферация клона измененных клеток, но и накопление в них генетических нарушений на каждом новом этапе. Таким образом, генез и прогрессирование опухоли возможны за счет аберрантной функции генов, регулирующих важные аспекты клеточной пролиферации, апоптоза, геномной стабильности, ангиогенеза и метастазирования.
В современной классификации опухолей молочной железы генетическим характеристикам РМЖ уделено большое внимание [3]. Исследования с помощью метода сравнительной геномной гибридизации показали, что на генетическом уровне РМЖ — крайне гетерогенное заболевание [4]. Выявлены корреляции между типом численных генетических нарушений, гистологической стадией и экспрессией эстрогеновых рецепторов как при протоковой карциноме in situ, так и при инвазивной карциноме молочной железы [4, 5]. Стандартное гистологическое исследование с окрашиванием среза опухолевой ткани гематоксилином и эозином является эффективным, экономически обоснованным и надежным способом поставить верный диагноз, а значит провести необходимое лечение [6]. В то же время развитие нашего понимания молекулярных механизмов, лежащих в основе инициации и прогрессирования опухолевого роста, открывает новые возможности для классификации и лечения РМЖ [7, 8]. Существующие сегодня технологии исследования генома позволяют определять нарушения в сотнях генов. Данные методы были недавно использованы для выявления подтипов и установления разных «профилей» РМЖ [9].
Генетические нарушения, приводящие к онкогенезу, затрагивают два основных типа генов: гены-супрессоры опухолей и онкогены. Гены-супрессоры опухолей (BRCA1, BRCA2, TP53, Rb1, PTEN, CHEK2, CDH1) — это гены, которые препятствуют развитию опухолей, обеспечивают целостность генома, регулируют клеточный цикл, апоптоз, рост и пролиферацию клеток. Нарушение их нормального функционирования в опухолевых клетках происходит вследствие точечных мутаций, метилирования ДНК или физической делеции. В случае онкогенов (HER2/neu, EGFR, CCND1, MDM2, MYC, EMS1), т.е. генов, способствующих развитию опухолей, преобладают другие типы генетических нарушений: транслокации, инверсии, амплификации или точечные мутации. Механизм активации онкогенов различен для лейкозов/лимфом, сарком и карцином. В случае онкогематологических заболеваний активация таких онкогенов, как CCND1 и MYC происходит преимущественно за счет транслокаций.
В опухолях эпителиальной природы эти же онкогены активируются с помощью другого механизма — амплификации, т.е. увеличения числа копий гена на клетку. В связи с тем, что амплификация генов — один из основных механизмов активации онкогенов при РМЖ, изучению именно этой проблемы и посвящена настоящая работа.
Амплификация гена — это многократное увеличение числа его копий в генетическом материале отдельных клеток. Выделяют два основных типа амплификаций: интрахромосомные — в виде гомогенно окрашивающихся регионов ДНК или экстрахромосомные — в виде double minutes [10]. В первом случае дополнительные копии гена расположены на хромосоме последовательно, друг за другом. Double minutes — это мелкие экстрахромосомные кольцевые ДНК, которые содержат дополнительные копии гена, не имеют центромер и теломер. Предполагают, что они способны к самостоятельной репликации. Иногда, например при нейробластомах, число double minutes может быть до нескольких сотен на одну клетку. Обычно (но не всегда) амплификация приводит к гиперэкспрессии гена. Показано, что в 44—62% случаев амплификации генов при РМЖ имеется гиперэкспрессия соответствующих белков [11]. Чаще всего увеличение экспрессии онкогенов приводит к более агрессивному поведению опухоли, ее метастазированию или резистентности к химиотерапии. Однако процесс амплификации обычно затрагивает не отдельный ген, а довольно большой участок генома — ампликон, который может содержать несколько генов, поэтому точное установление гена, придающего опухолевым клеткам дополнительные селективные преимущества, представляется зачастую сложной задачей. Возможно, что измененный характер экспрессии именно нескольких генов, вовлеченных в ампликон, и формирует уникальный фенотип опухоли. Далее приведены хорошо изученные регионы ДНК, содержащие известные онкогены, которые часто подвергаются амплификации при РМЖ [12]:
Рассмотрим наиболее частые из них — MYC, CCND1 и HER2.
Ген MYC локализован в регионе 8q24. Кодируемый им белок играет важную роль в репликации, метаболизме, дифференцировке и апоптозе [13]. Амплификацию MYC обнаруживают в 8—37% РМЖ [12]. Эта мутация в 3 раза чаще наблюдается при медуллярном типе опухоли по сравнению с протоковым и еще реже — при дольковом типе рака [12]. Показаны сложная корреляция между экспрессией и амплификацией MYC, а также связь амплификации MYC с отсутствием в опухоли прогестероновых рецепторов [14].
В работах с использованием методов Саузерн-блот гибридизации и полимерной цепной реакции обнаружена зависимость между амплификацией MYC и высокой гистологической степенью злокачественности, наличием метастазов в лимфатических узлах, отсутствием прогестероновых рецепторов и плохой выживаемостью [15]. При использовании FISH, метода «золотого стандарта» для анализа численных изменений генов, корреляции данного нарушения с клинико-патогистологическими характеристиками были недостоверны. И хотя амплификацию MYC связывают с плохим прогнозом, не ясно, насколько это независимый прогностический маркер при инвазивном РМЖ. При анализе 245 пациентов методом CISH не найдено взаимосвязи амплификации MYC с размером опухоли, гистологическим грейдом, а также экспрессией ER/PR, HER2 и EGFR [21]. Показана связь амплификации MYC с более короткой общей выживаемостью и выживаемостью без метастазов. Вероятно, амплификация MYC может играть важную роль на поздних стадиях опухолевой прогрессии, особенно при активации транскрипционной программы, способствующей развитию метастазов РМЖ [16, 17].
Ген циклина D1 (CCND1) локализован в регионе 11q13 и кодирует белок, контролирующий переход клеточного цикла через G1-фазу. Амплификация гена CCND1 наблюдается в 10—27% всех случаев РМЖ, чаще при дольковом гистологическом типе рака, ассоциирована с экспрессией эстрогеновых/прогестероновых рецепторов в клетках опухоли [12]. Исследования прогностической значимости этой генетической аберрации при РМЖ дают противоречивые результаты. Амплификация гена циклина D1 не обнаруживается у носителей BRCA1 мутаций [18]. Этот факт свидетельствует в пользу различных механизмов онкогенеза в наследственном и спорадическом типах РМЖ. У носителей амплификации CCND1, несмотря на ER(+)-статус, наблюдается резистентность к терапии тамоксифеном. В то же время тамоксифен прекрасно действует на опухоли с ER(+)-статусом, но без амплификации CCND1 [19]. Многие исследователи отмечают важную роль гиперэкспрессии циклина D1 на ранних этапах онкогенеза РМЖ [2, 20]. Амплификация гена CCND1 обычно приводит к гиперэкспрессии данного белка [20]. Однако гиперэкспрессия циклина D1 встречается намного чаще (около 50% РМЖ), чем амплификация этого гена, а значит, кроме амплификации есть и другие механизмы, приводящие к гиперэкспрессии циклина D1 в опухолевых клетках. Наиболее ценный маркер при оценке возможного ответа опухоли на терапию тамоксифеном — амплификация гена CCND1, а не гиперэкспрессия данного белка [19]. Появляются доказательства того, что, кроме регуляции клеточного цикла, циклин D1 способен образовывать прямые комплексы с эстрогеновыми рецепторами и, таким образом, регулировать транскрипционную активность эстрогензависимых генов без участия эстрогена [20]. Следует отметить, что ген CCND1 расположен в регионе 11q13, богатом другими генами. Внутри региона 11q13 находятся как минимум 4 независимо амплифицирующихся участка, и обычно амплификация 11q13 охватывает несколько из них [19]. Амплификация гена CCND1 составляет не менее 2 /3 всех амплификаций 11q13. Тем не менее, до конца не ясно, только ли с геном CCND1 связаны перечисленные клинико-патологические корреляции. Еще один вероятный претендент, находящийся в этом регионе, — онкоген EMS1. Возможно также влияние и других, уже открытых (INT2, FADD, PAK1, EMSY) или пока еще не идентифицированных генов региона 11q13 [21]. Явное вовлечение гена в патогенез опухоли не является гарантией его значимости в качестве прогностического маркера. Важнейшая роль гена CCND1 в патогенезе РМЖ в настоящий момент очевидна, однако его роль как клинико-прогностического маркера еще не вполне изучена [19].
Один из наиболее хорошо изученных генов, участвующих в патогенезе РМЖ, — HER2, расположен в регионе 17q12-21. Этот ген кодирует трансмембранный рецептор с тирозинкиназной активностью — белок из семейства рецепторов эпидермального фактора роста [22]. Амплификация HER2 при РМЖ наблюдается в 10—34% случаев, ассоциирована с высоким грейдом опухоли, отсутствием эстрогеновых и прогестероновых рецепторов, неблагоприятным прогнозом, короткой выживаемостью пациентов и преимущественно протоковым гистологическим типом опухоли [11, 22]. Амплификация этого гена широко изучена и описана в литературе ввиду его доказанной клинико-диагностической значимости. Его амплификация — это первичный механизм гиперэкспрессии соответствующего протеина на поверхности опухолевых клеток [23]. Белок, в свою очередь, служит мишенью для таргетного препарата — гуманизированного моноклонального антитела (трастузумаб) [24]. Таким образом, амплификация HER2 является прогностическим маркером ответа опухоли на данный препарат. Алгоритм тестирования и оценки HER2-статуса при РМЖ валидирован и стандартизован [23]. В ряде случаев HER2-статус может прогнозировать ответ опухоли и на другие виды системной терапии РМЖ. Положительный HER2-статус опухоли ассоциирован с относительной, но не абсолютной резистентностью к антигормональной терапии и химиотерапевтическим режимам без антрациклинов и таксанов [23]. Напротив, HER2(+)-опухоли хорошо отвечают на терапию антрациклинами, возможно в связи с высокой частотой коамплификации гена топоизомеразы-IIα (TOP2α) в опухолях с амплификацией HER2.
В одной из работ изучены частота и клиническая значимость амплификаций 11 генов (MED1, STARD3, HER2, GRB7, THRA, RARA, TOP2A, IGFBP4, CCR7, KRT20, KRT19 и GAS), расположенных в регионе 17q12-q21, т.е. в непосредственной близости к гену HER2 [25]. Оказалось, что амплификации этих генов наблюдались только при амплификации гена HER2. Причем частота встречаемости амплификации каждого из этих генов уменьшалась по мере увеличения дистанции от гена HER2. Амплификация HER2, по-видимому, способствует генетической нестабильности на участке 17q, что приводит к различному спектру амплификаций находящихся в этом регионе генов.
Кроме перечисленных, при РМЖ также описаны амплификации генов FGFR1, S6K, TOP2α, EMS1, FGF3, AKT2, PIP4K2, PRDM14, ADAMS, EMSY, IKBKB, AURKA, ESR1, CCNE [12, 26, 27]. Некоторые из этих нарушений имеют установленную клиническую значимость. Также при РМЖ амплификация может наблюдаться в следующих регионах ДНК — 1p, 1q, 3q, 4q, 6p, 6q, 8p, 10p, 14q, 15q, 16p и 19q. Однако конкретный ген, находящийся внутри этих ампликонов, пока не установлен. Таким образом, количественные нарушения ДНК при РМЖ встречаются часто и могут определять основные патогенетические события [28]. При этом число таких нарушений зависит от степени «продвинутости» онкогенеза. Их количество крайне мало при гиперплазии и резко увеличивается в карциноме in situ [29]. Стабилизация спектра генетических нарушений происходит на более поздних стадиях онкогенеза.
Кроме того, что амплификация приводит к изменению экспрессии генов, она также является индикатором геномной нестабильности. Геномная нестабильность — это нарушение функции генов, вовлеченных в регуляцию митоза и репарацию ДНК. В этих условиях целостность генома находится под угрозой, поскольку происходящие нарушения ДНК не устраняются системами репарации. Увеличение геномной нестабильности приводит к росту риска развития новых генетических изменений, которые, в свою очередь, могут дать опухоли дополнительные селективные преимущества, необходимые для прогрессирования, способности к метастазированию, экспрессии факторов роста и индукции ангиогенеза. В этом случае амплификация гена может иметь прогностическую значимость в качестве индикатора плохого прогноза [12]. Это особенно применимо к опухолям, несущим несколько амплификаций. Показано ступенчатое ухудшение выживаемости у пациентов с увеличением числа амплификаций на опухолевую клетку [12]. В этой же работе проведен анализ частот встречаемости амплификаций каждого из 5 исследованных генов (HER2/neu, MYC, CCND1, MDM2, EGFR). Далее была рассчитана вероятность развития соответствующих коамплификаций. Выяснилось, что фактические частоты выявленных коамплификаций были, как минимум, несколько выше расчетных, т.е. опухоли, достаточно генетически нестабильные для развития одной амплификации, имеют повышенный риск развития множественных амплификаций. Более 40% опухолей с амплификацией HER2 и более 50% опухолей с амплификацией MYC, CCND1, MDM2 или EGFR имеют в составе генома более одного амплифицированного гена [12].
Несколько работ посвящено исследованию роли амплификаций генов в возникновении, прогрессировании, инвазии и метастазировании РМЖ [1, 26, 30]. В частности, сравнивали число и спектр амплификаций генов в клетках карциномы in situ c клетками инвазивного компонента опухоли у того же пациента. Оказалось, что частота амплификаций генов HER2/neu, ESR1, MYC, CCND1 примерно одинакова для обоих компонентов [26]. Аналогичная ситуация имела место и при метастазах опухоли в лимфатических узлах по сравнению с первичной опухолью. Авторами сделан вывод о том, что амплификации данных генов — это ранние патогенетические события, которые играют важную роль в развитии опухоли, но не в инициации инвазивного роста. К таким выводам пришли и другие исследователи [30], проанализировавшие численные нарушения в 21 гене (ESR1, EGFR , FGFR1, ADAM9, IKBKB, PRDM14, MTDH, MYC, CCND1, EMSY, CDH1, TRAF4, CPD, MED1, HER2, CDC6, TOP2A, MAPT, BIRC5, CCNE1, AURKA) на материале, полученном при лазерной микродиссекции инвазивного и in situ компонентов РМЖ у одних и тех же пациентов. Генетический статус в обоих случаях отличался незначительно. В этой связи можно сделать вывод о том, что протоковая карцинома in situ с генетической точки зрения настолько же «развита», как и инвазивный компонент опухоли. Большинство генетических нарушений, обнаруживаемых при РМЖ, можно найти уже на стадии протоковой карциномы in situ [30]. Известно, что чем больше развита опухоль, тем значительнее перестроен ее геном. С помощью метода мультиплексной лигазозависимой амплификации зондов (MLPA) в одной опухоли находили до 5 амплификаций генов [27]. Как уже отмечалось, наличие нескольких амплификаций может являться индикатором плохого прогноза или худшей выживаемости. Однако не ясно, с чем именно это связано: собственно с числом амплифицированных генов или с тем, какие именно гены подверглись амплификации.
РМЖ — крайне гетерогенное заболевание, и эта гетерогенность может быть напрямую связана с вариабельностью на генетическом уровне. Ввиду этого изучение нарушений ДНК при РМЖ, их классификация и систематизация могут помочь распознавать отдельные подтипы данного заболевания. В свою очередь, это открывает новые возможности для понимания и прогнозирования поведения данных опухолей, а значит и путей их лечения. Несмотря на достигнутый успех в генетических исследованиях РМЖ, ни один из исследуемых генов изолированно не может дать прогноз поведения опухоли или ее ответа на терапию.
В этой связи необходимо исследование большой выборки пациентов с помощью метода, позволяющего одновременно анализировать многие гены. Это позволит составить более полный «генетический профиль» РМЖ, и, возможно, обнаружить новые корреляции между генетическими, гистологическими, клиническими и эпидемиологическими данными. С этой целью многообещающим представляется метод MLPA, который позволяет одновременно анализировать численные нарушения десятков генов [27, 31].
Тактика ведения больных РМЖ основана на классических клинико-патологических маркерах (размер опухоли, степень поражения лимфатических узлов, наличие отдаленных метастазов и рецепторов к стероидным гормонам).
До настоящего времени использование генетических нарушений в качестве прогностических маркеров не имело большого значения, в том числе ввиду отсутствия альтернативных способов лечения для различных подтипов заболевания. С появлением таргетных препаратов возрос интерес к выявлению отдельных подтипов опухолей. Наряду с размером, типом, распространенностью, стадией и другими клинико-патологическими признаками, генетические маркеры опухоли становятся ее неотъемлемыми характеристиками. ДНК намного стабильнее РНК и белков, что делает ее удобным и надежным объектом для диагностических исследований. Количество новых генов, в которых обнаруживаются различные нарушения при РМЖ, из года в год увеличивается.
В настоящее время необходимо проводить параллельный патогистологический и генетический анализ пациентов РМЖ, чтобы в будущем с помощью «генетического профиля» можно было прогнозировать поведение опухоли, а также выделять фенотипические подгруппы данного заболевания.
ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России, Москва, Россия
Российский научный центр рентгенорадиологии МЗ РФ, Москва
Прогностические возможности профиля экспрессии генов в определении риска рецидивирования рака молочной железы после органосохраняющего лечения
Журнал: Онкология. Журнал им. П.А. Герцена. 2016;5(3): 27‑32
Цель — исследовать профиль экспрессии генов в ткани рака молочной железы (РМЖ) для поиска прогностических факторов локального рецидивирования (ЛР) и разработки модели прогноза. Материал и методы. Исследован 91 образец опухолевой ткани РМЖ, полученный от пациенток после органосохраняющего лечения. Из них у 26 больных наблюдался ЛР, в группу сравнения вошли 65 пациенток в состоянии ремиссии более 5 лет. Результаты. Изучена экспрессия 21 гена методом ПЦР в реальном времени, определены уровни экспрессии в группах прогрессирования и ремиссии. Разработанный на основе дискриминантного анализа алгоритм позволяет в 71,4% случаях прогнозировать возникновение местного рецидива в исходной выборке и в 92,3% исключить его появление. Заключение. Анализ уровня экспрессии генов позволяет создать алгоритм, предсказывающий развитие локальных рецидивов после органосохраняющего лечения больных РМЖ.
По данным ВОЗ, рак молочной железы (РМЖ) занимает второе место в структуре заболеваемости среди всей онкопатологии, уступая первенство лишь раку легкого. С 2008 по 2012 г. в мире наблюдается стойкая тенденция к росту заболеваемости (на 20%) и смертности (на 14%) от РМЖ [1]. Широкое распространение заболевания обусловливает его огромную медико-социальную значимость. Хирургическое лечение РМЖ на ранних (I—II) стадиях возможно в двух вариантах: в виде радикальных мастэктомий и органосохраняющих операций (ОСО). В то же время существует группа клинико-морфологических факторов, значительно повышающих риск развития локальных рецидивов (ЛР) после ОСО. К ним относят размер опухоли более 5 см, мультицентрический рост, расположение опухоли в центральном квадранте, молодой возраст (до 35 лет), близкое расположение опухоли к краю резекции (менее 2 мм), степень дифференцировки (G2—3), наличие внутрипротоковой опухолевой инвазии [2—9]. При отсутствии этих неблагоприятных факторов органосохраняющие операции являются операциями выбора при ранних (I—II) стадиях РМЖ. Так, в Великобритании за период с 2005 по 2008 г. 58% первично выявленных опухолей молочной железы подвергалось органосохраняющему лечению (ОСЛ) [10]. Широкое внедрение ОСЛ в клиническую практику отражено в клинических рекомендациях по лечению РМЖ, таких как ESMO, NCCN и ряде национальных рекомендаций некоторых европейских стран. Проведение дистанционной лучевой терапии на ложе первичной опухоли и грудную стенку является обязательным условием при ОСО РМЖ, значительно снижающим риск развития Л.Р. Наиболее крупным исследованием по изучению влияния лучевой терапии на риск развития местных рецидивов при РМЖ является NSAPB B-6, в рамках которого показано снижение частоты ЛР с 39,2 до 14,3% при послеоперационном облучении грудной клетки и ложа опухоли [11]. Схожие закономерности выявляются и для рака in situ в рамках клинического протокола NSAPB B-17, где при добавлении к ОСО послеоперационной лучевой терапии достигается снижение частоты ЛР с 19,4 до 8,9% [12].
Размер опухоли является одним из главных критериев при решении целесообразности выполнения ОСО. При опухолях менее 1 см риск развития ЛР после ОСО не превышает 10% в течение 10 лет и 12% в течение 20 лет [13, 14]. При этом с увеличением размера опухоли повышается риск развития Л.Р. Так, в исследовании EORTC изучались пациентки с размером опухоли от 2 до 5 см, при этом 10-летний риск появления ЛР составил 19,7% [15].
Также описана связь частоты ЛР с иммуногистохимическими характеристиками опухоли, такими как наличие рецепторов эстрогена (РЭ), прогестерона (РП), экспрессия HER2/neu и Ki-67. В исследованиях K. Voduс, W.-J. Jia и N. Arvold и соавт. [16—18] показана высокая частота развития ЛР при HER2, экспрессирующем и «трижды негативном» подтипах РМЖ. Так, в исследовании K. Voduc и соавт. риски местного и регионарного рецидивов РМЖ после ОСО для люминального, А типа составили 8 и 3%, для HER2 экспрессирующего — 21 и 16%, для «трижды негативного» — 14% для каждого из видов рецидивирования соответственно. Интересным представляется исследование японских авторов [19], проведших сравнение иммуногистохимических факторов прогноза в первичной опухоли и рецидивах РМЖ. Авторы обнаружили, что высокий уровень Ki-67 в рецидивной опухоли имел корреляцию с уменьшением времени до возникновения отдаленных рецидивов.
Последние достижения медицины связаны с углублением знаний о молекулярно-генетических особенностях РМЖ; биологических процессах, протекающих в нормальных и опухолевых клетках, механизмах их регуляции; путях активации опухолевого роста, а также выявлением новых прогностических маркеров и разработкой таргетной терапии. Оценивая генетические особенности опухоли можно определить вероятность развития рецидивов и прогнозировать выживаемость пациенток [20]. Разработаны и активно внедряются в клиническую практику такие генетические тесты, как oncotype DX и mammaprint, оценивающие риски отдаленного метастазирования и необходимость назначения системной химиотерапии [21]. Данные тесты позволяют комплексно оценить опухолевый потенциал, способность опухоли к отдаленному и регионарному метастазированию. Также в литературе встречаются работы, пытающиеся оценить связь генетических свойств опухоли с вероятностью развития ЛР [22, 23]. В исследовании E. Mamounas и соавт. [24] использовалась 21-генная сигнатура, при этом удалось выделить 3 группы риска развития ЛР у пациенток с РМЖ, при этом соотношение составило 4,3, 7,2 и 15,8% для групп низкого, среднего и высокого риска. D. Nuyten и соавт. [22] изучали уровень экспрессии генов на основе 70-генной сигнатуры, при этом удалось выделить группы низкого (5%) и высокого (29%) риска развития локорегионарных рецидивов. Чувствительность данного метода составила 87,5%, специфичность — 75%. Полученные положительные результаты создают предпосылки для более глубокого изучения проблемы локального рецидивирования при РМЖ.
Мы исследовали профиль экспрессии из 21 гена в ткани операционного материала рака молочной железы для оценки возможности построения модели прогноза ЛР.
Материал и методы
В исследовании были изучены истории болезни и образцы опухолевой ткани 91 пациентки, перенесших комплексное органосохраняющее лечение по поводу РМЖ за период с 2003 по 2011 г. У 26 пациенток отмечено прогрессирование в виде ЛР, у 65 пациенток наблюдалась ремиссия более 5 лет. Средний возраст пациенток составил 47,7±9,5 года. При оценке размера опухоли pT1 (опухоли до 2 см) отмечены в 9 случаях возникновения ЛР и в 55 случаях ремиссии; pT2 (опухоли от 2 до 5 см) — в 17 случаях развития ЛР и в 10 случаях ремиссии. Мультицентрический опухолевый рост выявлен в 2 случаях при развитии ЛР и в 1 случае при ремиссии.
Анализировали уровень экспрессии мРНК генов Ki-67, STK-15, CCNB1, CCND1, MYC, MYBL2, P16INK4A, PTEN, BIRC5, BCL2, BAG1, TERT, NDRG1, ESR1, PGR, HER2, GRB7, MGB1, MMP11, CTSL2, CD68. Выделение РНК из материала опухоли выполняли согласно инструкции с помощью наборов реагентов для выделения РНК RNeasy Plus Mini Kit («Qiagen», США). Реакции обратной транскрипции и ПЦР в реальном времени проводили с использованием наборов НПО «ДНК Технология» согласно инструкции. Статистический анализ проводили при помощи программы StatSoft Statistica 10.
Результаты
В исследовании был выполнен ретроспективный сравнительный анализ экспрессии 21 гена в образцах опухолей больных, у которых наблюдался местный рецидив в различные сроки после лечения, с группой ремиссии. Медиана наблюдения в группе пациентов с прогрессированием составила 75,1 мес, в группе прогрессирования — 43,6 мес. Для оценки различия уровней экспрессии генов использовали дисперсионный анализ. В табл. 1 представлены средние значения и достоверность различия средних уровней экспрессии исследованных генов.

Таблица 1. Уровни экспрессии (отн.ед.) мРНК генов в ткани рака молочной железы в группах с локальным рецидивом и без локального рецидива
Обнаруженные статистически значимые различия позволили предположить существование биологических предпосылок, характеризующих высокий риск местного рецидивирования.
Используя клинические данные (размер опухоли, стадию заболевания) и 21-геннную сигнатуру произведен факторный анализ. Выделено 3 фактора, объясняющих 48% дисперсии общей выборки (табл. 2, рис. 1).

Таблица 2. Собственное значение факторов и процент объясняемой дисперсии

Рис. 1. Собственное значение факторов.
В представленной таблице и на графике видно, что первые 3 фактора объясняют 48% общей дисперсии выборки.
Цифровое значение используемых клинических признаков и данные экспрессии генов представлены в табл. 3.

Таблица 3. Значение факторов для исследуемых переменных
При сравнительной оценке основными компонентами 1-го фактора являются гены PGR, ESR1, BAG1, BCL2, HER2; 2-го фактора — Ki-67, MYBL2, STK15 и для 3-го фактора — показатели, оценивающие поражение регионарных лимфатических узлов (л/у) (количество, соотношение между нормальными и метастатически пораженными лимфатическими узлами, стадия заболевания). Остальные компоненты занимают промежуточное значение. Если сравнить полученные данные с уровнем экспрессии соответствующих генов при прогрессировании и ремиссии (см. табл. 1), становится ясно, что 1-й фактор объединил гены, уровень экспрессии которых снижается при прогрессировании (кроме HER2, значение этого гена одинаково для группы прогрессирования и ремиссии), тогда как 2-й фактор объясняет повышение экспрессии объединяемых генов. Выявляемая закономерность соответствует биологической функции исследуемых генов. Фактор 1 сгруппировал гены, ответственные за дифференцировку, поддержание клеточного гомеостаза и апоптоз. Фактор 2 объединил гены опухолевой агрессии. Фактор 3 описывает изменения клинических показателей, оценивающих лимфатический статус (рис. 2).

Рис. 2. Собственное значение факторов для всех переменных.
Мы использовали выявленные различия в уровне экспрессии генов для создания прогностической модели с целью определения вероятности возникновения ЛР после органосохраняющих операций на основе дискриминантного анализа. При этом применили те же критерии, что и при построении факторного анализа. Полученные дискриминантные функции позволяют распознать ЛР для 73% пациенток с ЛР (верно классифицировано 19 пациенток с прогрессированием из 26) и исключить развитие местного рецидива в 92,3% случаев (верно классифицировано 60 пациенток без прогрессирования из 65). Общая диагностическая ценность представленной модели составляет 86,8% (табл. 4).
Таблица 4. Прогностическая эффективность дискриминантной модели оценки риска развития ЛР при органосохраняющих операциях
Полученные нами данные позволяют предположить, что появление местного рецидива после ОСО РМЖ может быть связано с молекулярным фенотипом опухоли. При развитии ЛР мы получили статистически значимое повышение уровня экспрессии маркеров пролиферации и межклеточных взаимодействий. При этом отмечается снижение экспрессии маркеров дифференцировки и апоптоза. Выявленные закономерности в изменении уровня экспрессии генов при развитии ЛР указывают на биологическую активность данных опухолей. В то же время необходимо учитывать такие морфологические признаки, как размер опухоли, ее локализацию (в центральном квадранте), степень лимфогенной диссеминации, которые влияют на частоту развития местного рецидива после органосохраняющих операций [25]. Также известно, что размер опухоли коррелирует с уровнем пролиферативной активности опухолевых клеток, со степенью их дифференцировки, уровнем экспрессии иммуногистохимических маркеров (рецепторы эстрогена, прогестерона, маммаглобина и т. д.) [26]. Сопоставление особенностей экспрессионного профиля опухоли с ее морфологической картиной, а также с исходом заболевания дает возможность прогнозировать результаты лечения и более обоснованно оценивать риск развития рецидива заболевания в случае выбора той или иной тактики лечения.
Использование экспрессионных данных для решения разных задач прогноза широко исследуется в настоящее время в различных областях молекулярной диагностики и особенно в онкологии. Ряд генетических сигнатур используется в клинической практике и научных исследованиях [27—30]. Как правило, эти методы не учитывают характер проведенного хирургического лечения и нацелены на определение риска отдаленного метастазирования. Мы использовали анализ экспрессионных данных для решения конкретной задачи — прогноза ЛР при экономных резекциях молочной железы. Использование 21-генной сигнатуры при построении дискриминантного анализа позволило нам разработать математическую модель, распознающую ЛР в 73% случаев в исходной выборке пациенток и позволяющую исключить развитие местного рецидива в 92,3% случаев. Эти результаты позволяют высказать предположение о возможном практическом их применении после проведения валидации полученной модели на расширенной группе больных.
Заключение
Применение алгоритма позволит оптимизировать программы комплексного и комбинированного лечения пациенток с РМЖ, включающие органосохраняющий вариант хирургического этапа лечения.
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Кафедра акушерства и гинекологии Волгоградского государственного медицинского университета
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва, Россия
ГУЗ "Рязанский областной клинический онкологический диспансер"
ФГБОУ ВО «Рязанский государственный медицинский университет» Минздрава России, Рязань, Россия
ФГБОУ ВО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Рязань, Россия;
ГБУ РО «Областной клинический онкологический диспансер», Рязань, Россия
ГБУ Рязани «Областной клинический онкологический диспансер», Рязань
PD-L1-статус рака молочной железы
Журнал: Архив патологии. 2019;81(2): 3‑9
Цель исследования — исследовать экспрессию PD-L1 в тройной негативной и люминальной В, HER2-негативной карциноме молочной железы и оценка связи PD-L1-статуса опухоли с прогнозом течения заболевания. Материал и методы. У 72 больных раком молочной железы изучен PD-L1-статус первичной опухоли иммуногистохимическим методом. Результаты. Обнаружены различия в частоте встречаемости карцином с экспрессией PD-L1в опухолевых клетках в зависимости от молекулярно-генетического типа: в люминальных B, HER2-негативных опухолях положительный PD-L1-статус выявлен в 4 (14,81%) из 27 случаев и в тройных негативных опухолях в 17 (37,78%) из 45. При анализе опухолей после неоадъювантной терапии позитивный PD-L1-статус опухолевых клеток обнаружен у 1 из 18 пациенток с умеренной остаточной опухолевой нагрузкой и у 6 из 13 с высокой остаточной опухолевой нагрузкой (5,56 и 46,15% соответственно), оцененной по системе RCB. Заключение. Положительный PD-L1-статус в тройном негативном раке определялся более чем в 2 раза чаще, чем в люминальном B, HER2- негативном (37,78 и 14,81%). Выявлена значимая корреляция между высокой остаточной опухолевой нагрузкой и позитивным PD-L1-статусом опухоли.
Рак молочной железы (РМЖ) в настоящее время является самой распространенной злокачественной опухолью у женского населения (20,9%) и, несмотря на имеющийся прогресс в лечении этого заболевания, продолжает занимать лидирующие позиции среди причин женской смертности от злокачественных новообразований. Во всем мире ежегодно РМЖ диагностируется более чем у 1,7 млн женщин. При этом примерно 25% из них женщины в возрасте до 50 лет и 5% моложе 35 лет. Около 6% пациенток на момент постановки диагноза имеют метастазы, средняя продолжительность жизни таких больных составляет 24 мес, а 5-летняя выживаемость — 21% [1, 2].
В то же время на сегодняшний день возможности морфологической диагностики РМЖ значительно возросли и позволяют получить множество данных, характеризующих биологические свойства опухоли, которые врач-онколог может использовать при оценке прогноза заболевания и выборе лекарственной терапии. В клинической практике принципиальное значение имеет молекулярно-генетический подтип РМЖ, именно он определяет, будет ли опухоль положительно отвечать на ту или иную схему терапии.
В сегодняшней клинической практике широко используется определение молекулярно-генетического подтипа РМЖ с помощью суррогатных иммуногистохимических маркеров, позволяющее выделять следующие биологические подтипы [3, 4]:
— люминальный, А (ER +, HER2-neu-негативный, Ki-67 менее 20%, PgR 20% и более);
— люминальный B, подразделяющийся на HER2-негативный (ER +, HER2-neu-негативный, Ki-67 20% и более, PgR менее 20%) и HER2-позитивный (ER +, HER2-neu — гиперэкспрессия или амплификация, Ki-67 — любой, PgR — любой);
— HER2-neu-позитивный (ER - негативный, HER2-neu — гиперэкспрессия или мплификация, Ki-67 — любой, PgR — негативный);
— тройной негативный, подразделяющийся на небазальный (ER 0, HER2-neu-негативный, Ki-67 — любой, PgR0, CK5/6-негативный) и базальный (ER 0, HER2-neu-негативный, Ki-67 — любой, PgR0, CK5/6-позитивный).
Повышенное внимание к тройному негативному фенотипу обусловлено тем, что этот вариант РМЖ, встречающийся в основном у молодых пациенток, наиболее неблагоприятен по прогнозу в силу агрессивного поведения и ограниченных возможностей фармакотерапии, обусловленных отсутствием в данном фенотипе РМЖ возможных точек приложения для воздействия гормональными и таргетными лекарственными препаратами.
Это обстоятельство диктует необходимость дальнейшего изучения биологических свойств РМЖ, в частности тех, что позволяют опухоли избегать иммунный надзор со стороны организма и, как следствие, прогрессировать и метастазировать, и которые в дальнейшем можно будет использовать в качестве потенциальной мишени для борьбы с опухолью посредством иммунотерапии. Активно ведется поиск новых маркеров РМЖ, уровень экспрессии которых можно будет использовать для прогнозирования течения заболевания и оценки перспективности назначения новых иммунотерапевтических препаратов. Одним из таких маркеров может стать PD-L1, повышенная экспрессия которого является одним из механизмов «обмана» опухолевыми клетками иммунной системы.
Лиганд запрограммированной гибели клеток (PD-L1), он же CD274 и B7-H1 — трансмембранный белок массой 40 кД, кодирующийся геном CD274, располагается на 9-й хромосоме и связывается с клеточным рецептором PD1. Уровень экспрессии этого гена контролируется регуляторным фактором 1 интерферона (IRF1) и STAT1 [1]. Экспрессия PD-L1 выявляется как на опухолевых, так и на иммунных клетках. Коэкспрессия PD-L1 и его рецептора PD-1 является причиной ингибирования пролиферации лимфоцитов, регулируемой рецепторами T-клеток секреции цитокинов [2]. Путь ингибирования PD-1/PD-L1 является ключевым фактором регуляции работы T-лимфоцитов при иммунном ответе, одним из так называемых chekpoint-ингибиторов [5]. В норме он играет критическую роль в предотвращении аутоиммунных реакций и поддержании иммунного гомеостаза [6]. Некоторые опухоли могут экспрессировать белки, подавляющие иммунный ответ, в том числе и PD-L1 [7].
При интерпретации результатов иммуногистохимического исследования нужно учитывать, что экспрессия PD-L1 отмечается как в эпителии, так и в строме опухоли, может быть мембранной и цитоплазматической и выявляется только в определенных участках опухоли. Предполагается, это связано с тем, что зона экспрессии PD-L1 в атипичных клетках ограничена областью инвазивного фронта опухоли [1,10]. Также необходимо отметить, что PD-L1 может присутствовать не только в раковых, но и в иммунокомпетентных клетках, инфильтрирующих опухоль [1, 8, 9]. Считается, что в данном случае характер экспрессии PD-L1 обусловлен адаптивными процессами и является признаком противоопухолевой иммунной реакции. Учитывая данные обстоятельства, ряд авторов предполагают, что экспрессия PD-L1 в иммунных клетках, инфильтрирующих опухоль, может являться благоприятным прогностическим признаком, и для более полноценной оценки прогноза РМЖ и возможности принятия решения о назначении анти-PD-1/PD-L1-антител при лечении необходимо учитывать уровень экспрессии PD-L1 как в раковых, так и в иммунных клетках микроокружения опухоли [8—11].
Актуальность данного исследования подтверждается тем, что на конгрессе ESMO в 2018 г. доложены первые результаты применения анти-PD-L1-терапии иммуноонкологическим препаратом атезолизумаб при тройном негативном РМЖ [10]. Авторы исследования применили атезолизумаб в комбинации с наб-паклитакселом в первой линии лечения метастатического тройного негативного РМЖ. Их трехфазное исследование проведено на 902 пациентках с метастатическим РМЖ. Средний возраст больных составил 55—56 лет. В исследование включали пациенток с экспрессией PD-L1 более 1%, наличием метастаза в печени без предшествующей химиотерапии. Все пациентки были распределены на две группы в соотношении 1:1. 1-я группа получала 840 мг атезолизумаба в 1-й и 15-й день + 100 мг/м 2 наб-паклитаксела в 1, 8, 15-й день каждые 28 дней до начала прогрессирования. 2-я группа получала то же лечение, только вместо атезолизумаба — плацебо. Медиана наблюдения составила 12,9 мес. По результатам исследования назначение атезолизумаба в первой линии терапии снизило риск прогрессирования или смерти на 38% по сравнению с группой плацебо [12].
Исследование проведено на операционном материале 72 больных РМЖ, проходивших лечение в клинике РМАНПО и Рязанском областном клиническом онкологическом диспансере. Регресс опухоли молочной железы после проведенного неоадъювантного лечения оценивался по системе RCB. Критерием для отбора стал иммуногистохимический статус опухоли: целенаправленно были выбраны люминальные B, HER2-негативные и тройные негативные карциномы по суррогатной молекулярно-биологической классификации. Часть пациенток (n=31) получали неоадъювантную химиотерапию, согласно рекомендациям RUSSCO и NCCN Guidelines. При анализе данных учитывали следующие факторы: возраст, степень дифференцировки (градация), стадию T, выраженность ответа опухоли на неоадъювантную химиотерапию по системе RCB [13] и Г.А. Лавниковой [14].
Весь операционный материал фиксировали в забуференном нейтральном 10% формалине не более 24 ч. Обезвоживание и обезжиривание проводили при помощи автоматизированных процессоров с изопропиловым спиртом. Пропитку парафином проводили при 60 °C, чтобы не допустить перегревания. На изготовленных с полученных блоков срезах проведена иммуногистохимическая реакция с набором PD-L1 ICH 22C3 pharmDx, (SK006, DAKO) в стейнере Avtosteiner Link 48 («Dako») по стандартному протоколу для данного набора не позднее 24 ч после изготовления парафиновых срезов. Для контроля иммуногистохимических реакций параллельно поставлены реакции на контрольных тканях. С этой целью выбраны клеточные линии, прилагаемые к набору, ткани миндалины и плаценты (рис. 1).

Рис. 1. Окрашивание тканевых контролей. а — положительная клеточная линия, ×400; б — отрицательная клеточная линия, ×400; в — плацента, ×100; г — миндалина, ×100.
Учитывая объективную сложность оценки уровня экспрессии PD-L1 в опухолях, ее проводили с привлечением трех экспертов, которые независимо друг от друга оценивали процент окрашенных опухолевых клеток, а также пери- и интратуморальных иммунных клеток. В случае возникновения разногласий у экспертов к консенсусу приходили в процессе коллегиального обсуждения, анализируя не только гистологические препараты, но и отсканированные изображения.
Критерием для позитивного статуса опухоли выбрано полное или частичное мембранное окрашивание не менее 1% опухолевых или иммунных клеток, расположенных интратуморально или не далее 1 мм от границы опухоли. Расчеты проводили отдельно для экспрессии PD-L1 в опухолевых и иммунных клетках (рис. 2, 3).
Рис. 3. Позитивное окрашивание PD-L1 более 1% иммунных клеток, ×100. Рис. 2. Позитивное окрашивание PD-L1 более 1% опухолевых клеток, ×100.
Методика подсчета позитивных клеток
Ткань РМЖ, окрашенную с помощью набора PD-L1 ICH 22C3 pharmDx, (SK006, DAKO), оценивали поэтапно. На первом этапе исключали из подсчета поля некроза и очаги карциномы in situ (рис. 4).
Рис. 4. Рак молочной железы, окрашивание PD-L1, маркировка зон для подсчета. 1 — граница опухолевой ткани; 2 — зона некроза, исключенная из подсчета; 3 — очаги карциномы in situ, исключенные из подсчета; 4 — зона перитуморальной инфильтрации, расположенная не далее 1 мм от края опухоли. На втором этапе всю область опухоли и перитуморальной инфильтрации разделили на поля зрения (рис. 5). Рис. 5. Рак молочной железы, окрашивание PD-L1, разделение площади опухоли на поля зрения. Далее оценивали собственно клетки РМЖ, определяя долю окрашенных клеток относительно общего количества живых раковых клеток в области опухоли. Позитивно окрашенными считали опухолевые клетки, имеющие полное или частичное окрашивание мембраны любой интенсивности. Допускается окрашивание в виде зерен или гранул, формирующих цепочку по ходу мембраны клетки. Процент окрашенных клеток подсчитывали отдельно для каждого из полей зрения и выводили среднее значение для всего препарата.
Далее провели подсчет иммунных клеток. Позитивно окрашенный лимфоцит, расположенный не далее 1 мм от границы опухоли (рис. 6),

Рис. 6. Рак молочной железы, окрашивание PD-L1, ×50. 1 — опухолевые клетки; 2 — позитивно окрашенные лимфоциты, расположенные на расстоянии более 1 мм, при подсчете не учитываются. имеет те же критерии окрашивания, что и опухолевая клетка, однако здесь гранулярное окрашивание встречали чаще, чем линейное. Определяли соотношение окрашенных лимфоцитов относительно всех интратуморальных и перитуморальных лимфоцитов.
Стоит отметить особенности выделения оценочных зон в препаратах пациенток, прошедших неоадъювантное лечение. При оценке данного материала зона, занимаемая опухолью, не имеет отношения к первичному ложу опухоли. Подсчет клеток проводили только в той зоне, где остались живые опухолевые клетки (рис. 7).

Рис. 7. Рак молочной железы после проведенного неоадъювантного лечения, окрашивание гематоксилином и эозином. Маркировка площади области опухоли. 1 — оставшиеся после неоадъювантного лечения живые опухолевые клетки; 2 — зона ложа опухоли, инфильтрированная лимфоцитами, ксантомными клетками, не включается в площадь области опухоли.
Результаты и обсуждение
Положительная экспрессия PD-L1 в опухолевых клетках выявлена в 21 (29,17%) из 72 случаев. Обнаружены различия в частоте встречаемости карцином с экспрессией PD-L1 в опухолевых клетках в зависимости от молекулярно-генетического типа: в люминальных B HER2-негативных опухолях положительный PD-L1-статус имели 4 (14,81%) из 27, а в тройных негативных опухолях — 17 (37,78%) из 45. Позитивный статус иммунных клеток наблюдался в 37,04 и 64,44% случаев соответственно (рис. 8, 9).
Рис. 9. Диаграмма распределения позитивного PD-L1 иммунных клеток в зависимости от молекулярно-биологического типа опухоли. Рис. 8. Диаграмма распределения позитивного PD-L1 опухолевых клеток в зависимости от молекулярно-биологического типа опухоли.
При исследовании взаимосвязи PD-L1-статуса с возрастом и степенью дифференцировки корреляции не обнаружено. Ожидаемая зависимость статуса от стадии T оказалась статистически незначимой (p=0,635), однако была обнаружена слабая зависимость (критерий Спирмена 0,37) между стадией Т и количеством окрашенных лимфоцитов. Возможно, это стало результатом недостаточно широкой выборки (рис. 10).

Рис. 10. Диаграмма, отражающая корреляцию между стадией Т и процентом окрашенных иммунных клеток относительно всей перитуморальной инфильтрации.
При оценке значения PD-L1-статуса опухоли для прогноза течения заболевания пациентов, прошедших неоадъювантное лечение, корреляции при использовании системы Г.А. Лавниковой не получено, и пациенты были разделены на две группы по классу остаточной опухолевой нагрузки RCB: RCB-II и RCB-III (больных со значительной резорбцией опухоли и средней клеточностью менее 10% в исследование не включали). Позитивный статус опухолевых клеток выявлен у 1 из 18 пациенток 1-й группы и 6 из 13 пациенток 2-й группы (5,56 и 46,15% соответственно). Окрашивание не менее 1% иммунных клеток наблюдали в 38,89% случаев RCB-II и в 76,92% RCB-III. Таким образом выявлена значимая корреляция между высокой остаточной опухолевой нагрузкой и позитивным PD-L1-статусом опухоли (p=0,02) (см. таблицу).
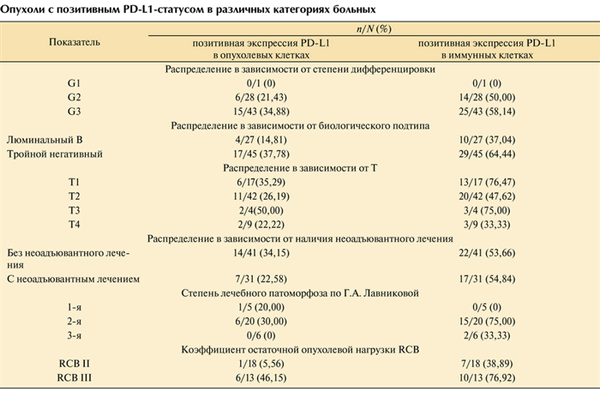
Опухоли с позитивным PD-L1-статусом в различных категориях больных
Положительный PD-L1-статус опухоли определяли в тройном негативном раке почти в 2,5 раза чаще, чем в люминальном B HER2-негативном. Учитывая более агрессивное течение гормонорезистентного РМЖ, можно предположить, что позитивный PD-L1-статус является признаком худшего прогноза течения заболевания. Об этом же свидетельствует факт, что опухоли, плохо отреагировавшие на классические химиотерапевтические схемы, чаще экспрессируют этот маркер. Стоит отметить и связь между стадией Т с позитивно окрашенными иммунными клетками: опухоли с лучшим прогнозом показывают более высокий уровень экспрессии PD-L1, что не противоречит мнению других исследователей [8—11]. Вместе с тем наличие позитивного PD-L1-статуса опухоли открывает возможности для иммунотерапевтических подходов к лечению этих опухолей.
Читайте также:
