Оральная регидратация при кишечной инфекции. Расчет объема инфузии
Обновлено: 02.05.2024
В статье изложены современные подходы к регидратационной терапии при острых кишечных инфекциях у детей, в том числе с использованием комплексных методов, направленных на коррекцию не только синдрома обезвоживания, но и микроэкологических нарушений, ассоци
The article covers modern approaches to fluid therapy in acute intestinal infections in children, including use of complex methods directed not only to correction of dehydration syndrome, but also micro-ecological disorders associated with infectious affection of the intestine.
Эпидемиологическая ситуация в мире по заболеваемости острыми кишечными инфекциями (ОКИ) остается на стабильно неблагоприятном уровне (Инфекционная заболеваемость в Российской Федерации за январь-декабрь 2015 года (по данным формы № 1 «Сведения об инфекционных и паразитарных заболеваниях»)) [1, 2]. По данным международных экспертов, 95% детей в возрасте до пяти лет хотя бы однократно переносят ОКИ 5. ОКИ представляют собой и значимую экономическую проблему, что было показано в Государственном докладе «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2014 году». Экономический ущерб от ОКИ, вызванных неустановленными инфекционными возбудителями, и от пищевых токсикоинфекций неустановленной этиологии составил 12 815 798,5 тысяч рублей в год, а для ОКИ установленной этиологии — 5 864 616,1 тысячи рублей в год [6].
Важным аспектом этиологической структуры ОКИ у детей в настоящее время является смена доминирующих возбудителей с бактериальных на вирусные, среди которых наиболее значимой является ротавирусная инфекция [7]. В постановлении Главного государственного санитарного врача Российской Федерации Г. Г. Онищенко от 19.03.2010 № 21 «О профилактике острых кишечных инфекций» сказано: «Рост в последние годы показателей заболеваемости ОКИ, вызванных установленными бактериальными и вирусными возбудителями в Российской Федерации, обусловлен в основном ротавирусной инфекцией, уровни заболеваемости которой за период 1999-2009 гг. выросли практически в 7 раз. Удельный вес указанной нозологии в структуре ОКИ увеличился с 1,4% до 7,0%. Наиболее поражаемым контингентом при ротавирусной инфекции являются дети до 14 лет, составляющие около 90% в структуре патологии» [8]. Данный факт обуславливает пересмотр основных терапевтических подходов при ОКИ у детей, в частности коррекции синдрома обезвоживания.
Дегидратационный синдром является ведущим патогенетическим фактором при ОКИ у детей, обуславливая тяжесть заболевания. Поэтому особую значимость для практического здравоохранения приобретает оперативность и правильность оценки степени дегидратации у ребенка, больного ОКИ [9]. Фундаментальные исследования Н. В. Воротынцевой, В. В. Малеева, В. И. Покровского по оценке выраженности обезвоживания на основе оценки острой потери массы тела пациента сохраняют свою актуальность до настоящего времени: эксикозу I степени соответствует потеря до 5% массы тела, что составляет до 50 мл/кг жидкости, эксикозу II степени — потеря 6-10% массы тела (60-100 мл/кг), эксикозу III степени — потеря более 10% массы тела (110-150 мл/кг). Обезвоживание с потерей массы тела более 20% не совместимо с жизнью [10]. Однако применительно к педиатрической практике определение дефицита массы тела ребенка на фоне болезни не всегда возможно ввиду интенсивного роста детей, поэтому оценка степени дегидратации проводится на основе клинических данных. В этой связи в настоящее время широкое распространение получили рекомендации Европейского общества педиатров, гастроэнтерологов и диетологов (European Society for Paediatric Gastroenterology Hepatology and Nutrition, ESPGHAN) от 2014 г. [11]. Однако в них предусмотрена клиническая оценка только внешнего вида, состояния глазных яблок и слизистых оболочек, а также наличие у ребенка слез. Более полная клиническая шкала M. H. Gorelick дополнительно включает определение времени капиллярной реперфузии (в норме не более 2 секунд), снижение диуреза, основные гемодинамические показатели (частота и наполнение пульса) и показатели нарушения дыхания [12]. Существуют и другие шкалы клинической оценки выраженности обезвоживания. Однако значимость каждого из симптомов обезвоживания в клинической практике может быть не всегда достаточно высокой, особенно при эксикозе I степени, что делает их наиболее применимыми при эксикозе II степени (табл. 1).
При ОКИ у детей преобладает изотонический тип обезвоживания, характеризующийся пропорциональной потерей жидкости и электролитов, в первую очередь натрия. При этом не отмечается изменения осмотического давления воды во внутриклеточном и внеклеточном пространствах, что затрудняет его определение лабораторными методами [15].
Объективизация диагностики степени выраженности обезвоживания у детей возможна с применением алгоритма, включающего клинические (увеличение времени капиллярной реперфузии, определяемая клинически сухость слизистых оболочек), анамнестические (выраженность диареи и рвоты), инструментальные (оценка влажности кожных покровов) и лабораторные (дефицит буферных оснований сыворотки крови) данные [16].
Также одним из важных аспектов патогенеза, являющегося закономерным для ОКИ любой этиологии, является развитие нарушений микрофлоры желудочно-кишечного тракта (ЖКТ). Ранее было показано, что при дизентерии Зонне у 67,8-85,1% пациентов, при сальмонеллезе — у 95,1%, иерсиниозе — у 94,9%, ротавирусной инфекции — у 37,2-62,8% нарушения со стороны микрофлоры ЖКТ носят выраженный характер 17.
Дестабилизация микробиоценоза ЖКТ на фоне течения инфекционного процесса приводит к снижению колонизационной резистентности микрофлоры, повышению выраженности воспалительных реакций со стороны слизистой оболочки кишки и снижению темпов репаративных процессов в кишечнике, что приводит к усугублению интоксикационного синдрома за счет высвобождения токсинов не только патогенных возбудителей, но и представителей условно-патогенной микрофлоры (УПФ), доля которых при ОКИ возрастает [20].
Основные патогенетические аспекты ОКИ обосновывают и терапевтические подходы — регидратационную и пробиотическую терапию, от своевременности и адекватности назначения которых зависят длительность заболевания и его исходы [10].
При развитии дегидратации основным принципом ведения таких больных является быстрое возмещение потерь жидкости и солей, а также увеличение буферной емкости крови. Общепризнано, что в педиатрической практике следует отдавать предпочтение оральной регидратации, как менее травматичной и более физиологичной для ребенка [21]. Международная практика применения оральной регидратации при ОКИ получила широкое применение с 70-х годов XX века, а ее включение в стандарты ведения больных позволило сократить число случаев госпитализации на 50-60% и значительно, на 40-50%, снизить летальность детей [22]. Однако первые рекомендации, которые можно отнести к регидратационной терапии и включающие в себя назначение рисового отвара, кокосового сока и морковного супа, относятся к периоду более 2500 лет назад и принадлежат древнеиндийскому врачу Sushruta [23]. В 1874 г. во Франции доктором Luton было обосновано назначение дополнительной воды для лечения детей, больных ОКИ. Впервые раствор, в состав которого вошли глюкоза, натрий и хлор, предложил использовать доктор Robert A. Phillips, после открытия механизма потенцирования глюкозой всасывания в кишечнике ионов натрия и калия [23]. В нашей стране в 30-50-х годах XX века проводилась разработка методов регидратационной терапии ОКИ М. С. Масловым (1928, 1945, 1955), В. И. Моревым (1937), В. Е. Балабан (1937). Основные принципы оральной регидратации, состав растворов и методы организации помощи больным ОКИ в нашей стране были разработаны Центральным научно-исследовательским институтом эпидемиологии под руководством В. И. Покровского [10].
Общий терапевтический подход к оральной регидратации предусматривает раннее назначение регидратационных растворов и проводится в два этапа:
- 1-й этап — восполнение потерь, произошедших до момента обращения за медицинской помощью. Назначается суммарное количество жидкости 50-80 мл/кг в течение 6 ч;
- 2-й этап — поддерживающая регидратация, задачей которой является восполнение текущих потерь жидкости при ОКИ. В сутки назначается 80-100 мл/кг жидкости. Длительность второго этапа оральной регидратации продолжается до момента выздоровления или появления показаний для парентеральной коррекции обезвоживания [24].
Согласно действующим современным подходам, для проведения оральной регидратации рекомендовано использование готовых форм растворов, сбалансированных по электролитному составу и осмолярности (75 мэкв/л натрия и 75 мэкв/л глюкозы и осмолярностью 245 мосм/л), при этом значению осмолярности растворов, рекомендуемых для педиатрического применения, уделяется огромное значение.
Также было показано, что данный тип растворов уменьшает потребность в инфузионной терапии, снижает выраженность диарейного синдрома и рвоты и позволяет уменьшить объемы растворов при проводимой оральной регидратации, что является важным преимуществом для педиатрии [16].
Необходимо учитывать, что коррекция обезвоживания должна проводиться с использованием и бессолевых растворов, среди которых предпочтение следует отдать питьевой воде (не минеральной!), возможно использование пектинсодержащих отваров (яблочный компот без сахара, морковно-рисовый отвар). Соотношение глюкозосолевых растворов и питьевой воды должно быть 1:1 при водянистой диарее, 2:1 при выраженной рвоте, 1:2 при инвазивных диареях [24].
Тяжелые формы ОКИ, отсутствие эффекта от оральной регидратации или наличие обильной рвоты, отеков, развитие функциональной (острой) почечной недостаточности являются показаниями для проведения парентеральной регидратации, которая может быть осуществлена с использованием одного из современных отечественных растворов — 1,5% раствора меглюмина натрия сукцината, доказавшего свою эффективность в интенсивной терапии данных состояний [30].
Патогенетическое обоснование необходимости применения пробиотических лекарственных средств при ОКИ не вызывает сомнения как в отечественной, так и в зарубежной литературе. Пробиотическую терапию рекомендовано назначать в составе комплексной стартовой терапии вне зависимости от этиологии заболевания и в как можно более ранние сроки. Данные препараты показаны также всем пациентам в периоде реконвалесценции с целью восстановления параметров микробиоценоза. Их применение при ОКИ у детей является не только патогенетически обоснованным, но и относится к самому высокому уровню доказательности — А — в соответствии с принципами доказательной медицины [31]. Данный факт был подтвержден в 2010 г. результатами метаанализа, включившего в себя результаты 63 рандомизированных контролируемых клинических исследований. В нем было показано, что использование пробиотиков достоверно уменьшает продолжительность диареи в среднем на 24,76 часа и сокращает частоту стула, при этом данные препараты характеризуются высоким профилем безопасности [32].
Одним из патогенетических механизмов, позволяющих рекомендовать пробиотики при ОКИ, является их положительное влияние на муциновый слой слизистой оболочки ЖКТ. На фоне течения инфекционного процесса наблюдается изменение физических характеристик данного барьера — снижение вязкости за счет разрушения дисульфидных связей между цистеиновыми мостиками суперструктуры данного геля, что может приводить к транслокации микроорганизмов из просвета кишечника в ткани. Данные процессы развиваются под действием патогенных микроорганизмов, имеющих соответствующие факторы патогенности в виде ферментов, разрушающих слизь (нейраминидаза, гиалуронидаза, муциназа). Длительное, в том числе в постинфекционном периоде, изменение физических свойств муцинового слоя приводит к риску развития воспалительных заболеваний кишечника [33]. Микроорганизмы, относящиеся к компонентам нормальной микрофлоры ЖКТ человека, а также продукты их обмена оказывают потенцирующее действие на состояние муцинового слоя посредством целого ряда механизмов, в том числе генетических [34, 35].
Современный взгляд на терапию пробиотиками подразумевает штамм-специфичный подход, который включает в себя установление в клинических исследованиях терапевтических эффектов, характерных для определенных генетически сертифицированных штаммов и дальнейшее их использование с учетом штамм-специфичных свойств пробиотиков в различных клинических ситуациях [36, 37].
Применительно к острым кишечным инфекциям у детей рабочая группа ESPGHAN в 2014 г. на основе анализа опубликованных систематических обзоров и результатов рандомизированных клинических исследований, в том числе плацебо-контролируемых, опубликовала меморандум, в котором разделила все пробиотические штаммы на пробиотики с положительной рекомендацией, с отрицательной рекомендацией и пробиотики с недостаточными доказательствами их эффективности. К рекомендованным штаммам (несмотря на низкий уровень доказательной базы по мнению экспертов) для терапии ОКИ у детей были отнесены Lactobacillus GG, Saccharomyces boulardii, Lactobacillus reuteri штамм DSM 17938 (исходный штамм ATCC 55730), а также термически инактивированный штамм Lactobacillus acidophilus LB, который формально к пробиотикам как живым микроорганизмам с заданными полезными свойствами отнесен быть не может, однако он показал свою эффективность при острых инфекционных гастроэнтеритах [38].
Lactobacillus reuteri DSM 17938 является одним из наиболее изученных штаммов. Данный микроорганизм относится к аутентичным для организма человека — он обнаруживается в грудном молоке человека, обитает в толстой кишке человека, встречается в ротовой полости, желудке, тонкой кишке, влагалище. В кишечнике человека Lactobacillus reuteri продуцирует антимикробную субстанцию — «реутерин», угнетающий рост Escherichia spp., Salmonella spp., Shigella spp., Proteus spp., Pseudomonas spp., Clostridium spp. и Staphylococcus spp., а также некоторых дрожжей и вирусов [39].
Штамм Lactobacillus reuteri DSM 17938 устойчив к следующим антимикробным средствам (возможен совместный прием пробиотиков Lactobacillus reuteri Protectis с этими средствами): амоксициллин, ампициллин, Аугментин, диклоксациллин, оксациллин, пенициллин G, феноксиметилпенициллин, цефуроксим, цефалотин, ванкомицин, доксициклин, тетрациклин, фузидовая кислота, ципрофлоксацин, энрофлоксацин, налидиксовая кислота, метронидазол. Lactobacillus reuteri DSM 17938 чувствительны к цефотаксиму, неомицину, стрептомицину, кларитромицину, эритромицину, рокситромицину, клиндамицину, хлорамфениколу, рифампицину, имипенему, линезолиду, виргиниамицину.
При этом Lactobacillus reuteri DSM 17938 характеризуется хорошим профилем безопасности, что подтверждено Продовольственной и сельскохозяйственной организацией ООН (Food and Agriculture Оrganization of the United Nations, FAO) и ВОЗ в 2002 г.
Клиническая эффективность Lactobacillus reuteri DSM 17938 показана при функциональных коликах у детей первого года жизни, в составе комплексной эрадикационной терапии H. рylori-инфекции, профилактики антибиотик-ассоциированной диареи, при метаболическом синдроме, в терапии аллергических заболеваний. Эффективность данного штамма подтверждена в 163 клинических исследованиях у 14 000 пациентов, из которых 114 — рандомизированные, двойные/слепые или слепые плацебо-контролируемые исследования, 47 — открытые исследования, 56 исследований проводились среди 7300 детей 0-3 лет жизни.
Однако наиболее хорошо изучены клинические эффекты данного штамма при ОКИ, что послужило причиной включения его в рекомендации ESPGHAN. Так, в многоцентровом рандомизированном простом слепом клиническом исследовании, проведенном среди госпитализированных с острым гастроэнтеритом детей, получавших традиционную терапию с или без 1 × 10 8 КОЕ Lactobacillus reuteri DSM 17938 на протяжении 5 дней, было показано, что назначение данного пробиотического штамма сокращает продолжительность диареи через 24 и 48 ч (50% в основной группе против 5% в группе сравнения, p < 0,001) и 72 ч (69% против 11%, р < 0,001), позволяет уменьшить сроки госпитализации (4,31 ± 1,3 дня против 5,46 ± 1,77 дня, р < 0,001) и снизить вероятность развития затяжного характера диареи (17% в группе сравнения и ни одного пациента в основной группе) [40]. Аналогичные данные были получены и в других исследованиях [41, 42].
Учитывая вышеизложенное, можно заключить, что в настоящее время в РФ единственным низкоосмолярным глюкозосолевым регидратационным раствором, содержащим Lactobacillus reuteri DSM 17938, является БиоГая ОРС (биологически активная добавка). Данный раствор оказывает терапевтическое действие по двум основным патогенетическим направлениям — корригировать и обезвоживание, и нарушения микробиоценоза при ОКИ у детей. Важно подчеркнуть, что, помимо глюкозы, солей и пробиотика, БиоГая ОРС содержит цинк, оказывающий положительное влияние на всасывание воды, который также потенцирует процессы иммунологической защиты и участвует в процессах регенерации.
По составу и осмолярности комбинация солей БиоГая ОРС соответствует рекомендациям Европейского общества педиатров, гастроэнтерологов и диетологов, а также ВОЗ и ЮНИСЕФ по оральной регидратации при легкой и средней степенях обезвоживания (табл. 2).
Эффективность данной комбинации — Lactobacillus reuteri DSM 17938 и растворов для оральной регидратации — была подтверждена в проспективном плацебо-контролируемом исследовании, где было показано снижение на 84% доли детей с обезвоживанием на вторые сутки приема данной комбинации [43].
Таким образом, комбинированная терапия пробиотиком и низкоосмолярным раствором для оральной регидратации (БиоГая ОРС) у детей без возрастных ограничений является не только патогенетически обоснованной, доказавшей свою несомненную эффективность и безопасность в контролируемых клинических исследованиях, но и наиболее перспективным направлением в лечении острых диарей любой этиологии, значительно уменьшающим полипрагмазию.
Литература
А. А. Плоскирева 1 , кандидат медицинских наук
А. В. Горелов, доктор медицинских наук, профессор, член-корреспондент РАН
Оральная регидратация - патогенетическая терапия острых кишечных инфекций у детей
Острые кишечные инфекции являются самыми массовыми инфекционными заболеваниями, которые характеризуются высокой частотой тяжелых форм и осложнений, особенно у детей раннего возраста. Клинические проявления острых кишечных инфекций, особенно вирусных диарей, сальмонеллеза, эшерихиоза и шигеллеза, развиваются быстро, иногда стремительно. Ведущей причиной тяжести острых кишечных инфекций у детей, приводящей к летальным исходам, является развитие синдрома обезвоживания (эксикоза).
К признакам обезвоживания относятся потеря массы тела от 5% до 10% и более, жажда, снижение тургора мягких тканей, сухость видимых слизистых оболочек, отсутствие саливации, западение большого родничка у младенцев, охриплость голоса, тахикардия, лихорадка, снижение диуреза.
В результате обезвоживания возможно развитие гиповолемического шока, ДВС-синдрома. Наиболее чувствительны к патологическим потерям жидкости новорожденные и дети грудного возраста, что обусловлено возрастными особенностями системы водно-солевого обмена:
- больший объем внеклеточной жидкости;
- большее, чем у взрослых, выделение воды через легкие и кожу в связи с относительно большей величиной поверхности тела на единицу массы;
- функциональная незрелость почек.
В связи с этим основой патогенетического лечения больных с острыми кишечными заболеваниями является использование оральной регидратации с применением глюкозо-солевых растворов в сочетании с диетотерапией, этиотропной терапией, энтеросорбцией в острый период заболевания.
Применение глюкозо-солевых растворов обосновано тем, что глюкоза усиливает перенос ионов натрия и калия через слизистую тонкой кишки, в результате чего быстрее восстанавливается водно-солевой баланс. Эффективность оральной регидратации зависит от ее применения с первых часов заболевания, поэтому важно начинать терапию в домашних условиях, при любой степени тяжести заболевания.
Необходимое количество жидкости рассчитывается по формуле:
V (мл/ч) = (Р x П : 6) x 10, где Р - масса больного в кг, П - процент острой потери массы тела больного, 10 - коэффициент пропорциональности.
Оральная регидратация осуществляется в 2 этапа: I этап - в первые 6 часов проводится ликвидация водно-солевого дефицита, II этап заключается в поддерживающей регидратационной терапии, проводимой весь последующий период лечения, с учетом суточной потребности ребенка в жидкости, солях и продолжающихся потерь. Во время проведения II этапа ребенок должен выпить столько раствора, сколько он потерял жидкости со стулом и рвотой за предыдущие 6 часов. Ориентировочный объем для поддерживающей регидратации составляет у детей до 2 лет 50 - 100 мл, а старше 2 лет - 100 - 200 мл после каждой дефекации. Эффективность оральной регидратации во многом зависит от правильной техники ее проведения. При быстром отпаивании большим количеством раствора возможно возникновение рвоты, поэтому рассчитанным врачом количеством жидкости ребенка выпаивают постепенно: по 1-2 чайные ложечки или из пипетки каждые 5-10 минут. В случае рвоты через 5-10 минут пероральное введение жидкости повторяют. У детей раннего возраста глюкозо-солевые растворы целесообразно сочетать с бессолевыми (чай, вода, рисовый отвар, отвар шиповника и др.) в соотношении:
- 1:1 - при выраженной водянистой диарее;
- 2:1 - при потере жидкости преимущественно с рвотой;
- 1:2 - при потере жидкости с перспирацией (лихорадка и умеренно выраженный диарейный синдром), при синдроме энтероколита.
Введение солевых и бессолевых растворов чередуется, так как их нельзя смешивать. Во время оральной регидратации кормление детей продолжается в уменьшенном объеме до 75-50%, дробно и часто.
Для проведения оральной регидратации в медицинской практике чаще всего используются сбалансированные полиионные растворы, такие как Гидровит ® , содержащий электролиты, недостаток которых отмечается при эксикозе у детей (Na, К, Сl, НСОз), а входящая в состав препарата глюкоза является не только источником энергии, но и средством усиления всасывания электролитов. Препарат разработан и выпускается компанией Stada CIS (Германия) в двух формах: Гидровит ® и Гидровит ® Форте.
В отличие от других препаратов для приготовления полиионных растворов, в состав Гидровита ® входит сорбент кремния диоксид коллоидный, обладающий сорбционными свойствами.
Гидровит ® и Гидровит ® Форте могут назначаться детям с рождения. Не секрет, что полиионные (глюкозо-солевые) растворы имеют специфический вкус и ими не всегда просто выпаивать детей раннего возраста. Для решения данной проблемы выпускается Гидровит ® с клубничным вкусом. Если у ребенка отмечается аллергическая реакция на клубничный ароматизатор, то можно назначить Гидровит ® без вкусовой добавки.
Препарат принимается внутрь. Содержимое одного пакетика Гидровит ® или Гидровит ® Форте растворяется в 200 мл питьевой охлажденной воды или чая. Раствор для приема внутрь должен быть приготовлен непосредственно перед употреблением, после чего он дается небольшими порциями, пока не будет достигнута рекомендованная доза.
Эмпирически можно рассчитать суточный объем раствора препаратов Гидровит ® и Гидровит ® Форте следующим образом:
- дети грудного возраста - от 100 до 150 мл/кг массы тела;
- дети младшего возраста - от 80 до 120 мл/кг массы тела;
- дети школьного возраста - от 50 до 80 мл/кг массы тела;
- дети старшего возраста и взрослые - от 20 до 60 мл/кг массы тела.
Вышеуказанные дозы имеют рекомендательный характер. Некоторым пациентам может понадобиться меньшее или большее количество препарата. Повышенные дозы могут быть полезными в начале лечения для быстрого и полного возмещения потери жидкости. Детям грудного возраста, которых кормят грудью, следует сначала дать рекомендованное количество растворенного порошка Гидровит ® или Гидровит ® Форте, а затем накормить. Лечение препаратами для оральной регидратации следует продолжать, пока длится диарея.
Эффективность оральной регидратации, проводимой в домашних условиях, оценивается по улучшению общего состояния ребенка, уменьшению объема потерь жидкости со рвотой и стулом, прибавке массы тела, появлению саливации, восстановлению диуреза.
Сведения об авторе:
Чащина Софья Евгеньевна, к.м.н., доцент кафедры детских инфекционных болезней и клинической иммунологии ГОУ ВПО УГМА Росздрава; врач высшей категории.
ОСТРЫЕ КИШЕЧНЫЕ ИНФЕКЦИИ в практике врача скорой медицинской помощи
В соответствии с рекомендациями ВОЗ термин «острые кишечные инфекции» (ОКИ) объединяет более 30 заболеваний бактериальной, вирусной или протозойной этиологии, основным симптомом которых является острая диарея (рис. 1). На практике
В соответствии с рекомендациями ВОЗ термин «острые кишечные инфекции» (ОКИ) объединяет более 30 заболеваний бактериальной, вирусной или протозойной этиологии, основным симптомом которых является острая диарея (рис. 1).
- заболевания, вызываемые неустановленным возбудителем (около 70% случаев);
- острые кишечные инфекции, вызываемые установленным возбудителем (около 20%);
- бактериальная дизентерия (около 10%).
Тот факт, что 70% случаев ОКИ приходится на заболевания с неустановленным возбудителем, можно считать следствием общепринятого для ОКИ «синдромального» принципа формирования диагноза, который полностью оправдывает себя при заболеваниях, не носящих эпидемического характера. В самом деле, при спорадических ОКИ (а их большинство) сходство клинической картины и течения заболеваний различной этиологии позволяет не тратить время на точное определение возбудителя, поскольку это существенно не влияет на выбор стратегии и тактики лечения. При эпидемических ОКИ как можно более раннее выделение и идентификация возбудителя болезни, напротив, становятся важнейшей задачей, требующей, к сожалению, значительных затрат времени и наличия хорошо оснащенной лаборатории.
Важно, что в наиболее обширную группу ОКИ неустановленной этиологии входят и большинство так называемых пищевых токсикоинфекций (ПТИ) — эту группу составляют приблизительно 20 этиологически разных, но патогенетически и клинически сходных заболеваний, не представляющих эпидемической опасности.
Более чем в половине случаев этиологию ОКИ не удается установить ни клинически, ни лабораторно. Эта задача, равно как и выбор патогенетического лечения, тем более не может быть решена (да и не ставится) на этапе догоспитальной помощи. Усилия врача скорой медицинской помощи (СМП) должны быть направлены на:
- коррекцию тяжелых нарушений жизненно важных функций организма больного;
- дифференцирование инфекционного, терапевтического или хирургического генеза заболевания;
- решение вопроса о необходимости госпитализации больного для специализированного лечения или проведения противоэпидемических мероприятий.
Клиническая картина ОКИ
ОКИ — заболевания различной этиологии и семиотики — объединяют общий для всех этих состояний, преимущественно фекально-оральный, способ передачи возбудителя и развитие вследствие этого характерного симптомокомплекса острой диареи (табл. 1).
ПТИ также относятся к БД, так как вызываются условно-патогенными бактериями и в ряде случаев имеют групповой, эксплозивный характер. Однако в подавляющем большинстве случаев ПТИ протекают спорадически с развитием острого гастрита, гастроэнтерита или гастроэнтероколита, с той или иной степенью обезвоживания и интоксикации и имеют благоприятный прогноз.
При диарее вирусной этиологии (ВД) целостность слизистой оболочки желудочно-кишечного тракта в большинстве случаев не нарушается и в процесс редко вовлекается толстая кишка. Инкубационный период, как правило, более короткий, чем при эпидемической БД. Острый вирусный гастроэнтерит, хотя и сопровождается лихорадкой и нарушением общего состояния больного, редко приводит к тяжелой интоксикации, развитию выраженной воспалительной реакции и дегидратации организма больного. К числу значимых дифференциальных критериев ВД можно отнести отсутствие при этих заболеваниях выраженной боли в животе, водянистый, а не слизисто-гнойный и кровавый характер испражнений. ВД нередко сопровождается острым респираторным заболеванием, особенно у детей. Продолжительность ВД редко превышает 3 дня, и в целом заболевание имеет благоприятный прогноз. Пациенты с относительно легким течением ВД в госпитализации не нуждаются.
Из ОКИ паразитарного происхождения (ПД) наибольшее клиническое значение имеют амебиаз и лямблиоз. Известно, что клиническая картина амебной дизентерии развивается приблизительно у 10% инфицированных амебой больных. Амебный колит характеризуется сильнейшей болью в животе, лихорадкой и кровавой диареей, которая чревата перфорацией толстой кишки. Генерализация амебиаза сопровождается септикопиемией с образованием абсцессов печени, легких или головного мозга и крайне неблагоприятным прогнозом для жизни больного. Заболевание носит эндемичный характер. Лямблиоз на территории России распространен очень широко и в 25-50% случаев приводит к развитию острого или хронического энтерита, сопровождающегося диареей. Наибольшую помощь в постановке доклинического диагноза при ПД может оказать тщательный сбор анамнеза настоящего заболевания и анамнеза жизни пациента, поскольку особую группу риска образуют лица, практикующие анальные сексуальные контакты.
В современной классификации ОКИ выделяют так называемые особые формы заболевания:
- диарея путешественников;
- диарея у мужчин-гомосексуалов;
- диарея у ВИЧ-инфицированных;
- антибиотико-ассоциированная диарея;
- синдром избыточного роста бактерий в желудочно-кишечном тракте.
Из особых форм ОКИ для практики врача СМП имеет значение лишь один из вариантов антибиотико-ассоциированной диареи — псевдомембранозный колит. Это заболевание развивается во время или значительно после приема антибактериальных препаратов и связано с колонизацией кишечника условно-патогенным микроорганизмом сlostridium difficile. Протекает псевдомембранозный колит с высокой лихорадкой, кровавой диареей, болью в животе и сопровождается существенной интоксикацией со всеми возможными осложнениями острой профузной диареи. При подозрении на псевдомембранозный колит больной должен быть госпитализирован в инфекционный стационар.
Доклиническая и дифференциальная диагностика ОД
Всестороннее изучение анамнеза настоящего заболевания является первым шагом в обследовании пациентов, имеющих характерные признаки ОКИ (табл. 1).
У больных необходимо выяснить:
- когда и как началось заболевание (например, внезапное или постепенное развитие заболевания, наличие инкубационного или продромального периода);
- характер испражнений (водянистые, кровянистые, с примесью слизи или гноя, жирные и т. д.);
- частоту стула, количество и болезненность испражнений;
- наличие симптомов дизентерии (лихорадка, тенезмы, примесь крови и/или гноя в испражнениях).
В беседе с больным очень важно установить наличие и, что особенно существенно, развитие субъективных и объективных проявлений обезвоживания (жажды, тахикардии, ортостатических реакций, уменьшения диуреза, вялости и нарушений сознания, судорог, снижения тургора кожи) и интоксикации (головной боли, тошноты, рвоты, мышечных болей).
Кроме того, во всех случаях необходимо выявить возможные факторы риска ОКИ: поездки в страны с неблагополучной по инфекционным диареям эпидобстановкой; род занятий; недавнее употребление в пищу небезопасных продуктов (например, недостаточно термически обработанного мяса, сырых яиц или моллюсков, непастеризованного молока и соков); купание в загрязненных водоемах или использование для питья воды из них (например, воды из озера или реки); пребывание в сельской местности, посещение «детских» зоопарков, контакт с дикими или домашними животными; наличие в окружении больных, имеющих сходные симптомы; регулярный или недавний прием лекарств (антибиотиков, антацидных препаратов, противодиарейных средств); наличие медицинских факторов, предрасполагающих к развитию инфекционной диареи (ВИЧ, прием иммунодепрессантов, гастрэктомия в анамнезе, ранний детский или старческий возраст); пристрастие к анальному сексу; принадлежность к декретированным группам населения (работники питания, воспитатели детских учреждений).
На догоспитальном этапе ОКИ необходимо дифференцировать с рядом острых неинфекционных заболеваний хирургического, терапевтического, гинекологического и иного профиля. Единственной целью дифференциального диагноза в данном случае является выбор направления госпитализации больного. Основные критерии для проведения дифференциального диагноза отражены в предлагаемом нами алгоритме догоспитальной медицинской помощи (рис. 2).
Распространенность ошибочной диагностики ОКИ иллюстрируют данные DuPont H. L. (1997). Предоставленные автором данные анализа более 50 тысяч случаев госпитализации больных с ОКИ констатируют, что в 7,4% случаев этот диагноз был установлен при таких заболеваниях, как острый аппендицит, острый холецистопанкреатит, странгуляционная кишечная непроходимость, тромбоз мезентериальных сосудов, инфаркт миокарда, крупозная пневмония, декомпенсация сахарного диабета, гипертонический криз. Напротив, указанные выше заболевания были ошибочно диагностированы у больных с ОКИ в 11,1% случаев.
Догоспитальная терапия ОД
Наибольшую угрозу для пациентов с ОКИ представляет развитие дегидратации и ассоциированной с ней артериальной гипотензии на фоне интоксикации, провоцирующей падение артериального давления и нарушение функции центральной нервной системы. Объем догоспитальной терапии при ОКИ базируется на мониторинге жизненно важных функций организма больного: состоянии сознания и функции внешнего дыхания, уровне АД и гидратации пациента. При наличии соответствующего оснащения бригады СМП терапия клинически значимой гиповолемической и инфекционно-токсической артериальной гипотензии должна осуществляться под контролем центрального венозного давления. В соответствии со стандартными рекомендациями терапия на этом этапе направлена:
- на восстановление сердечного ритма;
- на оптимизацию объема циркулирующей крови;
- на устранение гипоксии и нормализацию кислотно-щелочного равновесия;
- на проведение инотропной/вазопрессорной терапии.
Для устранения гипоксии больному назначают оксигенотерапию газовой смесью с 35%-ным содержанием кислорода.
Регидратацию больного начинают с диагностики обезвоживания, тяжесть которой может варьировать от I до IV степени (табл. 2).
При дегидратации I и II степеней (85-95% больных ОКИ) восполнение потери жидкости может и должно осуществляться оральным путем. ВОЗ рекомендует применять для оральной регидратации растворы следующей прописи: 3,5 г NaCl, 2,5 г NaHCO3 (или 2,9 г цитрата натрия), 1,5 г KCl и 20 г глюкозы или ее полимеров (например, 40 г сахарозы, или 4 столовые ложки сахара, или 50-60 г вареного риса, кукурузы, сорго, проса, пшеницы или картофеля) на 1 л воды. Это позволяет получить раствор, содержащий приблизительно 90 ммоль Na, 20 ммоль K, 80 ммоль Cl, 30 ммоль HCO3 и 111 ммоль глюкозы. Можно с успехом использовать любой из готовых растворов для оральной регидратации (цитроглюкосалан, регидрон, гастролит). Количество выпитой жидкости должно в 1,5 раза превышать ее потери с испражнениями и мочой. Компенсация обезвоживания сопровождается очевидным уменьшением жажды, нормализацией диуреза и улучшением общего состояния больного.
Дегидратация III и IV степеней, выраженная тошнота или рвота, а также бессознательное состояние больного требуют неотложной инфузионной терапии. Для внутривенной регидратации используют полиионные кристаллоидные растворы: трисоль, квартасоль, хлосоль, ацесоль. Менее эффективно введение моноионных растворов (физиологического раствора хлорида натрия, 5%-ного раствора глюкозы), а также несбалансированных полиионных растворов (раствора Рингера, мафусола, лактасола). Коллоидные растворы (гемодез, реополиглюкин, рефортан) вводят только в случаях упорной гипотонии, после восстановления объема циркулирующей крови в целом. В тяжелых случаях инфузия водно-электролитных смесей начинается с объемной скоростью 70-90 мл/мин, при средней тяжести состояния больного — с объемной скоростью 60-80 мл/мин. В ряде случаев необходимая скорость инфузии обеспечивается путем одновременного вливания в 2-3 вены. После стабилизации артериального давления скорость инфузии снижается до 10-20 мл/мин. Для предотвращения прогрессирования обезвоживания, развития гемодинамической недостаточности, отека легких, пневмонии, ДВС-синдрома и острой почечной недостаточности объем жидкости, вводимой после стабилизации состояния больного, может составлять 50-120 мл на 1 кг веса.
Назначение антибактериальной терапии среднетяжелых и тяжелых ОКИ на доклиническом этапе не только не входит в задачи врача СМП, но и категорически противопоказано, поскольку может существенно ухудшить состояние больного и затруднить лабораторную верификацию возбудителя заболевания. Возрастающая угроза инфекций, вызванных антибиотико-резистентными штаммами микроорганизмов, наличие нежелательных реакций при применении антимикробных препаратов, суперинфекция, связанная с эрадикацией нормальной микрофлоры антибактериальными средствами, и возможность индукции антибиотиками некоторых факторов вирулентности у энтеропатогенов (например, индукция фторхинолонами фага, ответственного за продукцию шигеллезного токсина), заставляют тщательно взвешивать все за и против при решении вопроса об антимикробной терапии и назначать ее только после точной диагностики возбудителя ОКИ. В связи с вышеизложенным антибактериальные препараты особенно не рекомендуются при гастроэнтеритическом варианте ОД любой степени тяжести, при легком, стертом течении колитического варианта и в период реконвалесценции при любой форме кишечного заболевания.
Эмпирическое назначение антибиотиков возможно в случае легкопротекающей и среднетяжелой ОКИ любой этиологии, а также при диарее путешественников, наиболее вероятным возбудителем которой являются энтеротоксигенные штаммы E.coli или другие бактериальные патогены. В этом случае взрослым назначают фторхинолоны, а детям — ко-тримоксазол, применение которых позволяет сократить длительность заболевания с 3-5 до 1-2 дней. Этой категории больных, как правило, не нуждающихся в госпитализации, можно рекомендовать амбулаторный прием антисептиков кишечного действия: эрцефурила, интетрикса или энтероседива в стандартных дозах в течение 5-7 дней, а также препаратов неантимикробного действия, облегчающих течение диареи (табл. 3).
Столь же опасным, как антибиотики, в отношении усугубления интоксикации является применение при ОКИ любого клинического течения сильных противодиарейных препаратов (имодиума) и противотошнотных средств (церукала, торекана).
Особое значение при ОКИ имеет коррекция микробиоценоза кишечника пробиотиками, проводимая на различных этапах лечения: в остром периоде — в целях конкурентного вытеснения патогенной микрофлоры, у реконвалесцентов — для обеспечения реабилитационных процессов. Весьма эффективно раннее, не позже второго дня болезни, назначение бифидумбактерина форте в ударных дозах (по 50 доз 3 раза каждые 2 часа в первый день лечения) с последующим приемом поддерживающих доз (30 доз в день, по показаниям — до 6 дней).
Пробиотик IV поколения бифидумбактерин форте обеспечивает высокую локальную колонизацию слизистой оболочки кишечника, элиминацию патогенной и условно-патогенной микрофлоры. Положительный клинический эффект при сальмонеллезе средней тяжести отмечен через 1-2 дня, при тяжелом течении сальмонеллеза и дизентерии — к окончанию курса. Из пробиотиков, приготовленных на основе микроорганизмов рода Bacillus, препаратом выбора является биоспорин, назначаемый по 2 дозы 2-3 раза в день в течение 5-7 дней. Препарат обладает выраженным антибактериальным, антитоксическим и иммуномодуляторным действием, индуцирует синтез эндогенного интерферона, стимулирует активность лейкоцитов крови, синтез иммуноглобулинов. При преобладании энтеритического синдрома рекомендуется энтерол, получаемый из сахаромицетов Буларди. Он назначается по 250 мг 2 раза в день в течение 5 дней. В периоде реконвалесценции наряду с традиционными патогенетическими средствами (стимуляторами репарации, общего и местного иммунного ответа) целесообразно применение препаратов облигатной флоры, оптимально — бифидумбактерина форте, оказывающего стабилизирующее влияние на микробиоценоз кишечника и гомеостатические процессы.
Несмотря на расширение возможностей по верификации возбудителя и большой выбор методов этиопатогенетической терапии, появившихся в арсенале врача за последние 20 лет, ОКИ и сегодня по-прежнему сопряжены с высокой летальностью. Так, по данным Н. Д. Ющука, при ПТИ и сальмонеллезе летальность составляет около 0,1%, а при дизентерии — 1,4%, при этом причиной 20% летальных исходов при бактериальной дизентерии и 44,4% летальных исходов при всех остальных ОКИ является инфекционно-токсический шок. Причины столь высокой летальности, вероятно, кроются в неадекватной оценке прогноза и тяжести состояния больного ОКИ и неоказании ему, в том числе по причинам недостаточного инструментального, медикаментозного и информационного обеспечения, неотложной помощи именно на догоспитальном этапе. Хочется надеяться, что предложенный нами простой алгоритм догоспитальной медицинской помощи при ОД (рис. 2) окажется небесполезным для практикующих врачей и их пациентов.
Общеклинические исследования
Растворителем, в котором работают почти все известные живые системы, служит окись водорода, или вода (H2O). В молекуле воды атом кислорода соединен с двумя атомами водорода одинарными ковалентными связями. Чтобы понять, почему это важно и на что это влияет, нам придется ввести несколько дополнительных понятий из общей химии.
Электроотрицательность — сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Это понятие ввел Лайнус Полинг (Linus Carl Pauling). Самый электроотрицательный элемент — фтор, за ним на шкале электроотрицательности следует кислород. Иными словами, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора (который в биологической химии практически не встречается). Запомним этот факт.

Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующие ее электроны никуда не смещены (в рамках старинной планетарной модели атома можно сказать, что они находятся точно посредине между атомами, как на картинке). Такая ковалентная связь называется неполярной.
Если ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого выше электроотрицательность. Такая связь называется полярной. При очень большой разнице в электроотрицательности она может даже стать ионной — это случится, если один атом полностью “отберет” у другого общую пару электронов.
Связь между водородом и кислородом в молекуле воды — типичный пример ковалентной полярной связи. Электроотрицательность кислорода намного выше, поэтому общие электроны смещены к нему. В результате на кислороде возникает маленький отрицательный заряд, а на водороде маленький положительный; эти заряды принято обозначать буквой δ (“дельта”).
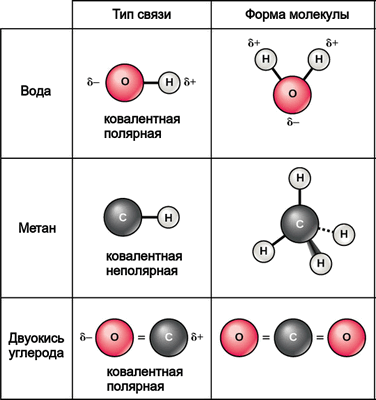
Связи кислорода с водородом или углеродом (H-O или C-O) — всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде. В то же время связь между углеродом и водородом (C-H) считается неполярной: разница в электроотрицательности между этими элементами так мала, что смещение электронов незаметно. Например, молекулы углеводородов в силу этого полностью неполярны, они не несут никаких частичных зарядов ни на каких атомах.

При наличии полярных связей между водородом и кислородом частичные заряды на этих атомах (отрицательные на кислороде и положительные на водороде) притягиваются друг к другу, образуя водородные связи. Эти связи гораздо слабее ковалентных, но могут давать сильный эффект, если их много. Например, именно из-за колоссального количества водородных связей у воды очень высокая теплоемкость — ее трудно нагреть и трудно остудить. Строго говоря, водородная связь может образоваться не только с кислородом, но и с другими электроотрицательными атомами (например, с азотом или фтором).

Любые заряженные частицы в водном растворе гидратируются, то есть окружаются молекулами воды — конечно, по-разному ориентированными в зависимости от того, положительная это частица или отрицательная. Любые ионы, растворенные в воде, на самом деле присутствуют там в гидратированном состоянии, то есть с водной оболочкой. На картинке для примера показана растворенная поваренная соль (NaCl) — образец чисто ионного вещества.

Полярные молекулы (а тем более ионы) хорошо взаимодействуют с водой, образуя с ней водородные связи и (или) подвергаясь гидратации. Такие вещества хорошо растворяются в воде и называются гидрофильными. Неполярные молекулы взаимодействуют с водой гораздо слабее, чем друг с другом. Такие вещества плохо растворяются в воде и называются гидрофобными. Типичные гидрофобные вещества — углеводороды. Типичные гидрофильные вещества — спирты, такие как этанол или показанный на картинке глицерин. Вообще кислородсодержащие соединения углерода, как правило, гидрофильны, если только в них нет совсем уж огромных углеводородных радикалов.
Могут ли подойти для жизни другие растворители, кроме воды? Ответ — да. Например, двуокись углерода (CO2) при более высоких давлениях, чем наше атмосферное, становится жидкостью и представляет собой хороший гидрофильный растворитель, в котором успешно идут многие биохимические реакции. В этом растворителе могут жить даже земные микроорганизмы: например, на дне Окинавского желоба в Восточно-Китайском море обнаружено целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии (Inagaki et al., 2006).

Некоторые исследователи предполагают, что океаны жидкой двуокиси углерода могут существовать на планетах-“суперземлях” с массой, в несколько раз превосходящей массу Земли (Budisa, Schulze-Makuch, 2014). На картинке — художественное изображение планеты GJ1214b в созвездии Змееносца.


На крупнейшем спутнике Сатурна — Титане — есть углеводородные озера и даже моря, состоящие из метана (CH4), этана (C2H6) и пропана (C3H8). Это гидрофобный растворитель, в котором тоже иногда предполагают существование жизни, хотя прямых подтверждений тому пока нет. На картине — пейзаж Титана. Жидкой воды на поверхности Титана нет, там слишком холодно.
Аммиак (NH3) — гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом, и напоминающий воду по физико-химическим свойствам. На более холодных планетах, чем Земля, аммиак находится в жидком состоянии и вполне может быть средой для жизни.

Теоретически возможно существование холодных землеподобных планет с аммиачными океанами (на картинке художественное изображение такой планеты). Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть сомнения, то углеродную жизнь в неводном растворителе представить гораздо легче.
Можно придумать и другие экзотические варианты — например, океан из плавиковой кислоты (HF) на планете, описанной в фантастической повести Ивана Ефремова “Сердце Змеи”. “Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…” Возвращаясь к земной биохимии, будем помнить, что она — не единственная теоретически возможная.
Оральные регидратационные соли

Оральные регидратационные соли или пероральные регидратационные соли (англ. oral rehydration salts; аббревиатуры ОРС, ПРС или ORS) — лекарственные препараты, предназначенные для возмещения потери жидкости и электролитов в организме при обильной диарее, многократной рвоте, экссудации с обширных раневых и ожоговых поверхностей, выделениях через дренажи и свищи, частых приемах слабительных средств. Регидратационные соли, кроме того, участвуют в коррекции кислотно-щелочной среды в организме пациента.
Оральные регидратационные соли продаются в аптеках в виде готовых растворов для питья или в виде порошков, предназначенных для приготовления растворов для питья
По фармакологическому указателю оральные регидратационные соли относятся к группе «Регуляторы водно-электролитного баланса и кислотно-щелочной среды в комбинациях». По АТХ оральные регидратационные соли относятся к подгруппе «A07CA Регидратанты для перорального приёма» группы «A07 Противодиарейные препараты».
Необходимость приёма регидратационных солей при диареи

Обезвоживание оказывается причиной многих обусловленных диареей летальных исходов. При этом обезвоживание на фоне острой диареи любой этиологии и в любом возрасте, за исключением ее тяжелых форм, можно без какого-либо риска и весьма эффективно вылечить в более 90% случаев простым методом, выпивая раствор, содержащий глюкозу и несколько солей, входящих в состав смеси под названием «оральные регидратационные соли». Раствор оральных регидратационных солей всасывается в тонкой кишке даже при сильной диареи, восполняя таким образом запасы воды и электролитов, которые уходят из организма при поносе. ВОЗ и ЮНИСЕФ считает важнейшим мероприятием при диарее пероральное или внутривенное введение больному растворов регидратационных солей.

ВОЗ («Лечение диареи», 2006) выделяет три состояния больного в отношении обезвоживания при диарее: «нет признаков обезвоживания», «некоторая степень обезвоживания» и «обезвоживание в тяжелой форме». Если дефицит жидкости от веса больного ребёнка находится в пределах от 5 до 10 %, то ориентировочно считается, что у него имеется «некоторая степень обезвоживания». В этой ситуации необходимо безотлагательное питье раствора оральных регидратационных солей (возможна замена другими солесодержащими жидкостями или продуктами). При тяжелой степени обезвоженности рекомендуется внутривенная регидратация.
Активная оральная регидратация солевыми растворами является обязательным компонентом лечения при всех видах секреторной диареи, так как уменьшает секрецию и улучшает всасывание (E.А. Белоусова, А.Р. Златкина).
Состав растворов оральных регидратационных солей
В течение нескольких десятилетий лет ВОЗ и ЮНИСЕФ рекомендовали для использования единственный состав оральных регидратационных солей на основе глюкозы, натрия и калия хлорида и натрия цитрата, имеющего осмолярность 311 мОсм/л. Указанные оральные регидратационные соли показали свою высокую эффективность при диарее, однако на основании проведенных исследований ВОЗ и ЮНИСЕФ в настоящее время (начиная с 2006 года) уточнили характеристики раствора ОРС и рекомендуют, особенно для детей с острой, не вызванной холерой диареей, вместо ранее рекомендованного стандартного раствора использовать раствор ОРС так называемый «с пониженной осмолярностью», приблизительно 245 мОсм/л (см. таблицу ниже).
*) разные лекарственные препараты выпускают в пакетиках, предназначенных для приготовления разного объема раствора оральных регидратационных солей; в таблице, рядом с названием препарата указано число пакетиков, необходимых для приготовления 1 литра раствора, а ниже приведено количество глюкозы или солей в указанном количестве пакетиков и требуемое для приготовления 1 л раствора ОРС
**) в состав Гастролита, вместо натрия цитрата, входит натрий бикарбонат, а также экстракт ромашки сухой 0,5 г на 5 пакетиков (1 литр раствора)
***) Цитраглюкосолан выпускается (выпускался) разными российскими производителями, состав, вес пакетиков может отличаться от указанных в таблице
Читайте также:
