Оценка ассоциации гена с болезнью
Обновлено: 20.05.2024
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, Москва
ФГБУ "Московский НИИ глазных болезней им. Гельмгольца" Минздрава России
ФГБНУ «Научно-исследовательский институт общей патологии и патофизиологии», ул. Балтийская, 8, Москва, 125315, Российская Федерация
ФГБУ «Научно-исследовательский институт общей патологии и патофизиологии», ул. Балтийская, 8, Москва, 125315, Российская Федерация
Ассоциация гена АВСВ1 с риском развития увеальной меланомы
Журнал: Архив патологии. 2014;76(2): 3‑7
Саакян С.В., Амирян А.Г., Цыганков А.Ю., Логинов В.И., Бурденный А.М. Ассоциация гена АВСВ1 с риском развития увеальной меланомы. Архив патологии. 2014;76(2):3‑7.
Saakian SV, Amirian AG, Tsygankov AIu, Loginov VI, Burdennyy AM. Association of the ABCB1 gene with risk for uveal melanoma. Arkhiv Patologii. 2014;76(2):3‑7. (In Russ.).
В работе исследована ассоциация полиморфного маркера C3435T гена АBСB1 с риском развития увеальной меланомы (УМ). Генотипирование осуществляли методом ПЦР-ПДРФ. Все опухоли, входившие в исследование, были гистологически верифицированы. Выявлена высокая частота встречаемости предрасполагающих аллелей и генотипов этого полиморфного маркера у больных с УМ. Показана ассоциация генотипа СС полиморфного маркера C3435T гена АBСB1 с повышенным риском развития УМ (OR=8,5, p=7∙10-6). Впервые установлена достоверная корреляционная связь частоты встречаемости генотипа СС полиморфного маркера C3435T гена АBСB1 с высотой и степенью пигментации опухоли (р=0,0391 и р=0,0381, по Фишеру). Впервые показана маргинальная ассоциация генотипа СС полиморфного маркера C3435T гена АBСB1 с состоянием сосудов и гистологическим типом.
Злокачественные внутриглазные опухоли меланоцитарного генеза представляют угрозу не только для зрения, но и для жизни пациента. Их частота достигает 15% от общего числа меланом других локализаций, при этом частота увеальной меланомы (УМ) составляет 85-88% всех первичных внутриглазных злокачественных новообразований [3]. В России заболеваемость УМ колеблется от 6,23 до 8 человек на 1 млн взрослого населения в год [1, 3]. УМ характеризуется агрессивным прогрессирующим течением, высокой вероятностью метастазирования и летального исхода. Установлено, что через 5 лет у 50% пациентов с УМ после проведенного лечения диагностированы метастазы в печени [12, 14].
В последние годы уделяется особое внимание поиску факторов прогноза течения опухолевого процесса при УМ. Исторически первыми были изучены клинические факторы. К ним относятся пол, возраст, расовая принадлежность, иммунологический статус, общий статус больного, сопутствующие заболевания, локализация и размер опухоли [5]. К сожалению, в настоящее время взаимосвязь многих из вышеперечисленных факторов с УМ изучена недостаточно. Более чувствительными являются патоморфологические факторы. К ним можно отнести тип гистологического строения опухоли, степень инвазии склеры, прорастание за пределы фиброзной капсулы, характер и тип ангиогенеза, степень лимфоидной инфильтрации в строме опухоли, уровень пролиферативной активности клеток новообразования, размеры ядра и ядрышкового анализатора и др. [9]. Выявление молекулярно-генетических изменений при УМ представляется наиболее перспективным способом прогнозирования течения заболевания. В настоящее время накоплен большой опыт исследований цитогенетических изменений при УМ [2]. К наиболее характерным хромосомным перестройкам и нарушениям численности отдельных хромосом можно отнести потерю одной копии хромосомы 3 (моносомия 3), что коррелирует с увеличением размера опухоли, вовлеченностью цилиарного тела, наличием в опухоли эпителиоидных клеток, полей оранжевого пигмента на поверхности опухоли, а также наличием замкнутых сосудистых петель [13].
При анализе клинических образцов, полученных от пациентов с УМ, были выявлены субпопуляции клеток, экспрессирующих маркер множественной лекарственной устойчивости (MDR), известный также как ABCB1 [8]. Ген MDR1/ABCB1 кодирует транспортный белок, гликопротеин Р, играющий ключевую роль в выведении целого ряда лекарственных веществ, включая препараты, применяемые при лечении УМ. На сегодняшний день у человека известно около 40 полиморфных маркеров гена MDR1. Как показали исследования, наибольшее клиническое значение имеет полиморфный маркер С3435Т, представляющий собой замену в нуклеотидной последовательности в положении 3435 цитозинового нуклеотида на тимидиновый [7]. Полиморфный маркер С3435Т гена MDR1, локализованный в экзоне 26, обусловливает изменение его экспрессии [10], что может приводить к замедленному выведению лекарственных препаратов. В работе
S. Landreville и соавт. [8] было показано, что субпопуляция клеток, содержащая АВСВ1-ген (ABCB1+), обладала как высокой метастатической, так и митохондриальной активностью в отличие от клеток, не содержащих данный ген (ABCB1-). При этом опухоли ABCB1+ соответствуют по своим свойствам опухолям, относящимся к классу 2 (по классификации AJCC TNM, учитывающей в том числе профиль экспрессии генов - GEP) [6], т.е. часто метастазируют и состоят из клеток различной степени дифференцировки, начиная от высокодифференцированных веретеновидных клеток и заканчивая низкодифференцированными эпителиоидными клетками. Опухоли ABCB1-, напротив, соответствуют опухолям класса 1 по той же классификации и обладают низкой метастатической активностью в сочетании с преобладанием дифференцированных веретеновидных клеток [11]. К недостаткам проведенных исследований относится невозможность проведения исследований in vivo с использованием первичных некультурированных клеток УМ. Такие факторы, как относительная редкость УМ и малое количество опухолевых клеток, полученных из относительно небольших новообразований, также препятствуют полноценным исследованиям в этой области [8]. Таким образом, исследование экспрессии гена ABCB1/MDR1 представляет интерес для практической офтальмоонкологии в связи с его потенциальной прогностической значимостью.
В связи с этим целью настоящей работы было изучение частоты распределения генотипов полиморфного маркера С3435Т гена MDR1/ABCB1 у больных с УМ in vivo и их взаимосвязи с клинико-морфологическими параметрами опухоли.
Материал и методы
Всего обследовано 30 ранее не леченных пациентов с УМ (12 мужчин и 18 женщин; 1:1,5) в возрасте от 23 до 72 лет (средний возраст 52,5±9,1 года). Во всех случаях глаза были энуклеированы. Гистологическая верификация опухоли проведена в отделе патологической анатомии и гистологии МНИИ ГБ им. Гельмгольца.
Высота опухоли составила от 2,6 до 13,8 мм (9,05±3,8 мм), диаметр основания - от 8,2 до 21,9 мм (15,4±5,6 мм). По локализации в исследование вошли опухоли цилихориоидальной области (n=5, 16,7%), хориоидеи (n=22, 73,3%) и иридоцилиохориоидальной области (n=3, 10%). По пигментации выделяли слабо- (n=17, 56,7%) и сильнопигментированные опухоли (n=13, 43,3%). Также опухоли разделяли по следующим клиническим параметрам: наличие (n=4, 13,3%) и отсутствие (n=26, 86,7%) гемофтальма; наличие невысокой (n=12, 40%), высокой (n=11, 36,7%) отслойки сетчатки и ее отсутствие (n=7, 23,3%); наличие (n=14, 46,7%) и отсутствие (n=16, 53,3%) субретинального экссудата, наличие (n=5, 16,7%) и отсутствие (n=25, 83,3%) эпибульбарного роста опухоли, наличие (n=11, 36,7%) и отсутствие (n=19, 63,3%) онкологических заболеваний в семейном анамнезе пациента. По гистологическому строению выделяли веретеноклеточные (n=16, 53,3%) (рис. 1) Рисунок 1. Веретеноклеточная УМ. Окраска гематоксилином и эозином. ×40. , смешанно-клеточные (n=9, 30%) и эпителиоидно-клеточные (n=5, 16,7%) опухоли (рис. 2) Рисунок 2. Эпителиоидно-клеточная УМ. Клеточный полиморфизм. Окраска гематоксилином и эозином. ×40. .
Из исследования были исключены больные с обострением хронических воспалительных процессов, аутоиммунными заболеваниями, наследственными и психическими болезнями. В качестве популяционного контроля использовали сопоставимую по возрасту и полу выборку лиц без онкологических заболеваний (n=60).
Материалом для исследования служила геномная ДНК, выделенная из лейкоцитов периферической крови с помощью протеиназы К с последующей фенольно-хлороформной экстракцией и осаждением этанолом. Выделенные образцы ДНК хранили при температуре -20 °С. Идентификацию аллелей полиморфного маркера C3435T (rs1045642) гена АBСB1 проводили с помощью ПЦР-ПДРФ. Для ПЦР использовали следующие олигонуклеотиды: ABCB-3435-F 5’-aggtttcacatcaccaagattcc-3’ и ABCB-343а5-R 5’-TTCTCAGAAAGGAGTATGCCTTA-3’. ПЦР проводили в 25 мкл реакционной смеси, содержащей 60 мМ трис-HCl; рН 8,9, 10 мМ 2-меркаптоэтанол,
25 мМ КС1, 0,1% тритон Х-100; 0,25 мМ каждого dNTP; 1-10 нг ДНК; 25 пмоль каждого праймера; 0,5 ед. Taq-полимеразы («СибЭнзим»); MgCl 2 в концентрации 2 мM. Амплификацию проводили по следующей программе: 94 °С 1 мин 30 с; 35 циклов 92 °С 15 c; 60 °С 20 с; 72 °С 15 с; 72 °С 1 мин 30 с на амплификаторe Терцик (Россия).
Далее амплифицированный фрагмент ДНК гена АBСB1 подвергали обработке с использованием рестриктазы PctI («СибЭнзим») в термостате при 50 °С в течение 16 ч. При наличии мутантного ТТ-генотипа амплифицируемый в ходе ПЦР фрагмент гена АBСB1 размером 206 п.н. гидролизуется рестриктазой PctI на два фрагмента - 143 и 63 п.н. В гетерозиготном генотипе гена АBСB1 СТ присутствуют все 3 фрагмента.

Результаты ПДРФ анализировали электрофоретически в 10% полиакриламидном геле с добавлением бромистого этидия (0,5 мкг/мл) и визуализацией в проходящем УФ-свете (рис. 3) Рисунок 3. Примеры анализа полиморфного маркера C3435T гена АBСB1 в 10% полиакриламидном геле. Н2О — отрицательный контроль (dd вода), К+ — образец до обработки рестриктазой, M — Lad 50 — маркер с шагом полос в 50 п.н. .
Статистическую обработку результатов проводили с использованием закона генетического равновесия Харди-Вайнберга для аутосомных признаков. При сравнении частот встречаемости генотипов применяли критерий Пирсона, а для малых выборок - точный критерий Фишера. Комплексную оценку связей между исследуемыми группами проводили с использованием логистической регрессии, определяя отношение шансов (OR) с 95% доверительным интервалом (CI) с уровнем значимости, равным 0,05. Рассматривали также результаты статистически маргинально значимые (0,05р≤0,1), что соответствует доверительному интервалу 94% (в отличие от стандартного доверительного интервала 95% при р=0,05). При сопоставлении генотипов и клинико-морфологических параметров опухоли учитывали такие факторы, как возраст пациента, высота и диаметр основания опухоли, локализация, наличие пигментации, гемофтальма, отслойки сетчатки, субретинального экссудата, отягощенного семейного онкологического анамнеза, а также гистологический тип опухоли. Расчеты проводили в системе для статистического анализа данных Statistica 6.1 RUS.
Результаты и обсуждение

Распределение частот аллелей и генотипов полиморфного маркера C3435T гена АBСB1 в контрольной группе и группе больных с УМ представлено в табл. 1 .
В 80% случаев был выявлен аллель С, что свидетельствует о высокой специфичности данного аллеля для УМ. При этом в опытной группе аллель С встречался почти в 2 раза чаще, чем в контрольной (80% против 41,7%).
Показана достоверная ассоциация предрасполагающего генотипа СС гена АBСB1 с риском развития УМ. Так, частота данного генотипа в группе больных оказалась в 4 раза выше по сравнению с группой контроля, в то же время генотип ТТ у больных обнаружен не был. Ассоциация генотипа CТ с риском развития УМ отмечалась в 40% случаев от общего количества аллелей С, тем не менее данная ассоциация не была значимой (p>0,05). Таким образом, можно предположить, что наличие аллеля С является неблагоприятным фактором при развитии УМ, в то время как аллель Т можно рассматривать как благоприятный фактор.

Нами была проведена оценка ранговых корреляций между генотипами гена ABCB1 и такими параметрами опухоли, как ее локализация, высота и диаметр, наличие пигментации, гемофтальма, отслойки сетчатки, субретинального экссудата, офтальмоскопически видимых собственных сосудов, гистологический тип опухоли, наличие эпибульбарного роста и отягощенного семейного анамнеза (табл. 2) .

Корреляция частот генотипов СТ и СС полиморфного маркера C3435T гена АBСB1 с параметрами прогрессии увеальной меланомы представлены на рис. 4 Рисунок 1. Корреляция частот генотипов СТ и СС полиморфного маркера C3435T гена АBСB1 с параметрами прогрессии УМ. а — пигментация опухоли в 13 случаях, в 17 — умеренная или отсутствует; б — высота опухоли в 18 случаях менее 10 мм, в 12 — 10 мм и более; в — состояние сосудов: в 23 случаях видны, в 7 — не видны; г — гистологическое строение: 16 случаев — веретеноклеточный тип (Вер), 9 — смешанно-клеточный (Сме) и эпителиоидно-клеточный (Эпит). . При этом удалось выявить значимую ассоциацию генотипа СС полиморфного маркера C3435T гена ABCB1 со степенью пигментации опухоли: с выраженной пигментацией исследовано 13 случаев, со слабой - 14, без пигментации - 3 (см. рис. 4). Частоты генотипов СТ и СС при выраженной пигментации опухоли значительно не отличались друг от друга и составили 52 и 46%, соответственно. В случае умеренно выраженной пигментации или ее отсутствия частота генотипа СС более чем в 2 раза превосходила таковую для генотипа СТ (71% (12 из 17 случаев) против 29% (5 из 17)). В настоящее время нет единого мнения относительно роли пигментации в течении опухолевого процесса при УМ, однако большая часть исследователей считают, что именно беспигментные и малопигментированные опухоли являются прогностически наиболее неблагоприятными [15]. В связи с этим наши данные могут свидетельствовать о большей злокачественности опухолей с генотипом СС.
Анализ распределения частот генотипов СС и СТ в зависимости от высоты опухоли показан на рис. 4, б. Исследованные опухоли были разделены на 2 группы: менее
10 мм (n=18) и 10 мм и более (n=12). При этом частота генотипов СС и СТ в первой группе была одинаковой и составила 50% (по 9 глаз в каждой подгруппе). Во второй группе мы отметили 3-кратное увеличение частоты генотипа СС по сравнению с генотипом СТ (75 и 25% соответственно), что свидетельствует о важной роли предрасполагающего генотипа СС гена ABCB1 в прогрессии УМ.
Нами была выявлена значимая ассоциация частот генотипов СС и СТ с наличием видимых сосудов в опухоли (n=23), что также принято считать относительно неблагоприятным прогностическим фактором (см. рис. 4, в). При этом частота генотипа СС составила 65%, а генотипа СТ - 35%. В 7 случаях видимые собственные сосуды при офтальмоскопии не выявляли, при этом частоты генотипов СС и СТ отличались незначительно и составили 42 и 58% соответственно.
При оценке ассоциации генотипов гена ABCB1 с различными гистологическими типами опухоли, такими как прогностически благоприятный веретеноклеточный (n=16), менее благоприятный смешанно-клеточный (n=9) и неблагоприятный эпителиоидно-клеточный (n=5), смешанно-клеточный и эпителиоидно-клеточный типы были объединены в одну группу (см. рис. 4, г). Частоты генотипов СС и СТ при веретеноклеточном типе опухоли не различались и составили по 50% (по 8 глаз в каждой группе). В случае смешанно-клеточного типа опухоли частота генотипа СТ составила 33% (3 глаза), тогда как частота генотипа СС была в 2 раза больше и составила 66% (6 глаз). При эпителиоидно-клеточном типе опухоли разница была еще больше - частота генотипа СТ была 20% (1 глаз), а генотипа СС - 80% (4 глаза). В объединенной группе с эпителиоидно-клеточным и смешанно-клеточным типом опухоли частота генотипа СТ составила 30%, а генотипа СС - 70%. Таким образом, убедительно показана неблагоприятная прогностическая значимость генотипа СС гена ABCB1 для развития УМ.
В одной из работ авторами была показана возможность выявления данных полиморфизмов в плазме крови, что в перспективе можно рассматривать как возможность потенциального скрининга по УМ для пациентов, входящих в группу риска по данному заболеванию, а также прогнозирования течения заболевания [4].
Заключение
В настоящей работе впервые изучены распределение частот генотипов полиморфного маркера C3435T гена АBСB1 с риском развития УМ и их связь с клинико-патоморфологическими параметрами УМ. Впервые показана статистически значимая ассоциация генотипа СС и ряда клинических (умеренная пигментация опухоли, высота опухоли и наличие видимых собственных сосудов) и патоморфологических (смешанно-клеточный и эпителиоидно-клеточный тип опухоли) факторов. При этом не выявлено связи между генотипами гена ABCB1 и такими клиническими факторами, как возраст пациента, локализация опухоли, диаметр основания, наличие гемофтальма, отслойки сетчатки, субретинального экссудата, эпибульбарного роста опухоли и отягощенного семейного анамнеза. Полученные нами данные могут свидетельствовать о значимости генотипов полиморфного маркера C3435T гена АBСB1 в развитии УМ и их патогномоничности для этой патологии. В то же время наличие аллеля Т гена АBСB1, безусловно, свидетельствует об относительно благоприятном течении опухолевого процесса. Выявленные особенности могут использоваться для разработки в ходе дальнейших исследований современных подходов к прогнозированию течения УМ, а также для скрининга пациентов, находящихся в группе риска по данному заболеванию.
Анализ ассоциации полиморфных генов основных цитокинов с синдромом раздраженного кишечника
В статье представлены результаты исследования иммуногенетической составляющей синдрома раздраженного кишечника. Установлены особенности частот встречаемости аллелей и генотипов генов цитокинов IL-1Ra, IL-1b, IL-4, TNFa у больных СРК. Проведен иерархический логлинейный анализ для выявления ассоциации комбинаций генотипов с предрасположенностью к синдрому раздраженного кишечника. Установлены комбинации генотипов генов цитокинов, обладающие протекторными свойствами при СРК: внутригенная комбинация -308G/G- -863 C/A гена TNFa и межгенная комбинация провоспалительных цитокинов IL-1b+3953 C/C- -863C/A TNFa. Выявлены гендерные различия в распределении полиморфизма цитокинов у больных СРК.
Синдром раздраженного кишечника (СРК) является одной из наиболее актуальных проблем современной гастроэнтерологии. Особенностями проблемы СРК являются: высокая распространенность полисистемных жалоб, отсутствие четких диагностических маркеров, ограничение спектра эффективных методов лечения, направленных на биологические дефекты. В большинстве работ СРК рассматривается как хронический абдоминальный симптомокомплекс [1].
Распространенность СРК в большинстве стран мира составляет в среднем 20 %, варьируя от 9 до 48 % [2]. В развитых странах Европы, Америки, в Японии, Китае обращаемость высока и распространенность заболевания достигает 30 %; в Таиланде — 5 %, в Иране — 3,4 %. Пик заболеваемости приходится на трудоспособный возраст — 30-40 лет. Соотношение женщин и мужчин среди больных, по разным данным, варьирует от 1:1 до 2:1. Средний возраст пациентов составляет 24-41 год [2].
Развитию СРК могут предшествовать личностные особенности, обусловленные генетически или сформировавшиеся под влиянием окружающей среды [3]. В качестве генетической составляющей СРК изучаются генетический полиморфизм, вовлеченный в обмен серотонина, адренэргической и опиоидной систем, а также гены, кодирующие белки с иммуномодулирующими и/или нейромоду-лирующими свойствами. Среди генов-кандидатов СРК в зарубежных источниках рассматриваются: SLC6A4 — ген серотонин-транпспортера, ген а-2адренэргического рецептора, СОМР-ген катехол-о-метилтрансферазы, GNB3 — ген Р3 субъединицы G-белка и т.д. [3].
Сегодняшние представления о патофизиологии СРК позволяют предположить, что в основе запуска или усиления патологического процесса лежит комбинация факторов — недостаточная или избыточная активация иммунной системы и дисбиоз кишечника. Участие цитокинов в патофизиологических процессах при СРК подтверждают данные лабораторных исследований: снижена экспрессия иммунорегуляторных цитокинов и повышена экспрессия провоспалительных цитокинов 5.
В связи с тем, что продукция цитокинов находится под генетическим контролем, то можно предположить, что генетические полиморфизмы определенных цитокинов могут выступать в качестве факторов, определяющих чувствительность персоны к развитию патологии и влияющих на вариабельность клинических проявлений СРК.
Цель: установить распределение частот аллелей, генотипов и сочетаний генотипов генов основных цитокинов IL-1Ra, IL-1b, IL-4, TNFa у больных синдромом раздраженного кишечника европеоидного происхождения, проживающих на территории Челябинской области.
Задачи:
- Оценить частоты встречаемости аллелей и генотиповIL-1Ra, IL-1b, IL-4, TNFa у больных СРК в сравнении с условно-здоровыми представителями русской популяции.
- Выявить особенности распределения полиморфизма геновIL-1Ra, IL-1b, IL-4, TNFa в зависимости от пола у больных СРК.
- Оценить ассоциацию межгенных и внутригенных взаимодействий L-1Ra, IL-1b, IL-4, TNFa в виде сочетаний генотипов генов цитокинов с восприимчивостью к СРК.
Материал и методы
В исследование включен 81 человек русской этнической группы с диагнозом СРК. Пациенты находились на лечении в гастроэнтерологическом отделении Дорожной клинической больницы МПС на станции «Челябинск» в период с 2001 по 2007 гг. Для диагностики заболевания использовались Римские критерии III (2007). Средний возраст начала заболевания составил 32,8±1,4 лет, длительность заболевания в среднем от 3 до 10 лет у половины пациентов. Обследования пациентов проводились по утвержденным Медико-экономическим стандартам Министерства здравоохранения 1998 г.
Контрольную группу составляли потенциальные доноры костного мозга ОГУП «Челябинская областная станция переливания крови»: 213 человек, из них мужчин — 119 (55,9 %), женщин — 94 (44,1 %). Средний возраст составил 34,6±0,75 лет. Этническая принадлежность больных СРК и здоровых лиц определялась согласно рекомендациям Международного Уоркшопа (1980 г., Лос-Анджелес, США). Демографическая характеристика обследуемых групп представлена в таблице.
Демографическая характеристика обследуемых групп

Характеристика исследуемых полиморфизмов. Гены IL-1b и IL-1Rа расположены на второй хромосоме в районе 2q12 [7, 8]. Для исследования полиморфизма по одному нуклеотиду (SNP) в 5 экзоне гена IL-1b (положение +3953) использовали разновидность ПЦР - ПДРФ - анализ полиморфизма длины рестрикционных фрагментов. В основе метода лежит ПЦР, с последующей обработкой ампликонов ферментом эндонуклеазой рестрикции Taq I при температуре +65 °С в течение 8 часов.
Ген IL-4 расположен на длинном плече 5 хромосомы [8, 9]. Для исследования VNTR IL-4 проводили ПЦР с праймерами, фланкирующими полиморфный регион в пределах 3-го интрона, в котором находится вариабельное количество тандемных повторов размером 70 н.п. В результате амплификации идентифицировали фрагменты ДНК размерами 255 и 325 н.п. соответственно, с 2 и 3 копиями тандемных повторов. Эти аллели были обозначены как 2R и 3R [9]. Наборы для типирования генов цитокинов синтезированы группой фармакогеномики Института химической биологии и фундаментальной медицины (ИХБФМ СО РАН). Детекция полученных ампликонов проводилась методом вертикального электрофореза в 8 %-ном полиакриламидном геле.
Ген TNFa располагается в пределах главного комплекса гистосовместимости МНС и относится к генам HLA III класса. Он отстоит на 600 кДа от локуса HLA-В и характеризуется высоким количеством SNPs в промоторной области, наиболее известными являются положения -308, -238. Однако есть и другие полиморфизмы типа SNP, например, -863, способные также влиять на экспрессию TNFa [7, 11]. Типирование SNPs в гене TNFa - ПДРФ - анализ полиморфизма длины рестрикционных фрагментов: амплификация с последующей обработкой ампликонов эндонуклеазами рестрикции NcoI (37 °С в течение 16 часов) для положения -308 (G/A), TaiI для положения -863 (65 °С в течение 8 часов). Детекция результатов — электрофорез в 8 % ПААГе.
Статистическая обработка. В работе использовались стандартные иммуногенетические критерии: критерий X 2 — для 1 степени свободы и выше, критерий X 2 с поправкой Йетса на непрерывность применялся для одной степени свободы, когда абсолютные частоты были меньше 10, критерий Фишера использовался при абсолютных частотах меньше 5. Для анализа ассоциации комбинаций генотипов с восприимчивостью к СРК применялся иерархический логлинейный анализ, в котором рассчитывался критерий максимального правдоподобия (G) и отклонения Фримана-Тьюки. Для оценки вероятности возникновения признака (заболевания или какой-то клинической характеристики) в зависимости от генетического варианта (аллеля, генотипа, комбинации генотипов) применялся критерий отношения шансов (OR) с расчетом 95 %-ного доверительного интервала (CI) — отношение шансов в одной группе к шансам этого же события в другой группе. Во всех случаях различия считали статистически значимыми при р < 0,05, незначимыми при р >0,10; для промежуточных значений р (0,05
Результаты и их обсуждение
- На первом этапе был проведен анализ распределения частот встречаемости аллелей и генотипов генов исследуемых цитокинов в группах больных СРК и условно-здоровых лиц русской популяции Челябинской области. Частоты встречаемости аллелей и генотипов геновIL-1Ra, IL-1b, IL-4, -308G/ATNFa не отличались между исследуемыми выборками. Различия были установлены только для частот аллелей и генотипов в точке -863TNFa (на уровне тенденции).
Группа больных СРК характеризовалась сниженной частотой аллеля с заменой -863* А, связанного с повышением продукции TNFa [11] и повышенной частотой другого — частого аллеля -863*С (на уровне тенденции X 2 = 3,23, p = 0,0722 для одной степени свободы), но по критерию отношения шансов (OR) такое перераспределение частот аллелей не имеет диагностической значимости (OR = 0,57 95 %CI 0,3-1,06).
Больные СРК также отличались от условно-здоровых лиц повышенной частотой генотипа -863 СС TNFa (82,5 % против 72,8 %, X 2 = 2,97, p = 0,0848 для одной степени свободы, на уровне тенденции), но как маркер предрасположенности к СРК данный генотип выступать, вероятно, не может, так как расчет критерия OR показал, что его доверительный интервал находится в диапазоне, захватывающем единицу: OR = 1,76 95 %CI 0,92-3,39.
Таким образом, установленные изменения частот аллелей и генотипа СС полиморфного сайта -863 промоторной области гена TNFa могут быть особенностью группы больных СРК, но не являются маркерами группы риска СРК.
- Вторая задача посвящена рассмотрению наличия или отсутствия изменений в частотах встречаемости аллелей и генотипов генов цитокинов у больных СРК в зависимости от пола. У женщин, больных СРК, выявлены следующие особенности.
IL-1b. В ходе анализа был показан вклад +3953 SNP IL-1P в предрасположенность к СРК у женщин (G = 6,64, df = 2, p = 0,036). Обнаружено, что статистически значимый эффект достигался за счет изменения частоты генотипа T/T (0 % против 9,57 % в контроле, р = 0,013).
TNFa -308 G/A. Еще одной особенностью являлось изменение частот генотипов SNP -308 G/A TNFa у практически здоровых и больных СРК женщин (на уровне тенденции). Группа больных СРК характеризовалась повышенной частотой гетерозиготного генотипа -308G/A (33,9 % против 20,21 %, X 2 = 3,57 p = 0,06, OR = 2,02 95 %CI 0,96-4,26) и пониженной частотой гомозиготного генотипа G/G -308 TNFa (64,41 % против 77,66 %, X 2 = 3,20p = 0,07, OR = 0,52 95 %CI 0,25-1,08). Однако по критерию отношения шансов такое изменение частот не имело прогностического значения для расчета вероятности развития предрасположенности к СРК у женщин.
Частоты аллелей и генотипов IL-4, -863 C/A TNFa не различались между исследуемыми группами.
Несмотря на то, что группа мужчин, страдающих СРК, была значительно меньше группы женщин, анализ распределения частот встречаемости аллелей и генотипов генов цитокинов у практически здоровых и больных СРК мужчин позволил выявить различия в частотах встречаемости аллелей и генотипов IL-1Ra и гомозиготного генотипа по редкому аллелю -308 A/A TNFa. У мужчин, страдающих СРК, чаще встречался генотип -308 A/A TNFa (9,09 % против 0,84 %, p = 0,064, OR = 11,8 95 % CI 0,99-139,2), несмотря на то, что благодаря такому распределению частот общий эффект оказался значим на уровне тенденции.
Более информативными были различия в распределении частот встречаемости аллелей и генотипов IL-1Ra. У мужчин, страдающих СРК, снижены частоты аллеля 2R и его гетерозиготного генотипа 4R/2R по сравнению с контролем. Согласно критерию отношения шансов носительство аллеля с 2-кратным повтором уменьшает вероятность возникновения СРК по сравнению с носительством других аллелей IL-1Ra (OR=0,38 95 % CI 0,15-0,94), но только в гетерозиготном состоянии вместе с аллелем 4R (OR=0,31 95 % CI 0,097-0,97). В свою очередь присутствие аллеля 4R в гомозиготном состоянии повышает вероятность развития СРК у мужчин: для носительства аллеля 4R коэффициент OR составил 2,4 95 % CI 1,012-5,62, для генотипа 4R/4R — OR = 3 95 % CI 1,09-8,27.
Таким образом, выделение групп больных по полу позволило установить маркеры предрасположенности к СРК среди исследуемых генов цитокинов отдельно для женщин и мужчин, тогда как при объединении в общую выборку установленные различия нивелировались.
- Оценка ассоциации межгенных и внутригенных взаимодействий с предрасположенностью / устойчивостью к СРК проводилась с помощью иерархического логлинейного анализа.
Установлена значимость следующих комбинаций генотипов: протекторными свойствами обладали комбинации генотипов SNPs TNFa -308G/G- -863 C/A (11,25 % vs 23,0 % X 2 = 4,35, p = 0,0371, OR = 0,57 95 %CI 0,19-0,91), IL-1b+3953 C/C- - 863C/A TNFa (6,25 % vs 16,43 X 2 = 4,29, p = 0,0384 OR = 0,34 95 %CI 0,13-0,9). По нашему мнению, ведущее значение в данных комбинациях отводится гетерозиготному генотипу — 863C/A TNFa.
- Особенность больных СРК европеоидного происхождения — повышенная частота гомозиготного генотипа -863С/С генаTNFa.
- Установлены маркеры, снижающие вероятность развития СРК: у женщин — гомозиготный генотип Т/Т +3953 IL-1b, у мужчин — аллель 2r и генотип 4r/2r генаIL-1Ra.
- Выявлены комбинации генотипов генов цитокинов, обладающие протекторными свойствами при СРК: внутригенная комбинация -308G/G- -863 C/A генаTNFa и межгенная комбинация генов провоспалительных цитокиновIL-1b+3953 C/C — - 863C/ATNFa.
Заключение
В патогенез каждого заболевания вовлекается много разных функционально взаимосвязанных генов той или иной локальной генной сети. Наряду с главными генами, провоцирующими начало болезни, всегда присутствуют другие, второстепенные, в том числе многочисленные гены-модификаторы, фенотипические эффекты которых во многом определяются средовыми факторами. К таким генам относятся гены воспаления, в частности гены цитокинов. Их идентификация, выявление характера функциональных поломок на уровне локальных генных сетей, особенностей ген-генных взаимодействий при мультифакторной патологии являются важными задачами постгеномной информатики и персонализированной медицины. Наше исследование вносит вклад в развитие представлений об иммуногенетической компоненте синдрома раздраженного кишечника.
Оценка ассоциации гена с болезнью
Андижанский государственный медицинский институт, Андижан, Республика Узбекистан
Оценка ассоциации вариантов генов BRCA1 и BRCA2 с развитием рака яичников у больных с высоким наследственным риском
Цель исследования — изучить особенности распределения частот генотипов и аллелей генов BRCA1 и BRCA2 у здоровых женщин и среди пациенток с раком яичников (РЯ) и определить вклад генов BRCA1 и BRCA2 в формирование основных форм заболевания, а также влияние на течение и эффективность лечения этого заболевания. Материал методы. Обследовали 208 пациенток с РЯ, леченных в Андижанском областном онкологическом диспансере за период с 2008 по 2015 г., и 80 лиц женского пола, являющихся их ближайшими родственницами. Результаты. Из 208 обследуемых пациенток с РЯ на наличие мутации в гене были выявлены 5 из 8 мутаций генов BRCA1 и BRCA2: 4153delA, 5382insC, Cys61Gly, 2080delA, 3819delGTAAA, что составило 11%. Превалирующими явились мутации 5382insC (BRCA1) — 8,7% и BRCA1_4153delA — 2,9% от всех случаев больных РЯ. Среди 80 здоровых родственниц вариант мутации BRCA_1 5382insC определен у 2% женщин. Выводы. Изложены данные изучения вклада мутаций генов BRCA1 и BRCA2 в развитие наследственных форм РЯ. Обнаруженные мутации имеют неблагоприятный прогноз, и статистически значимый коэффициент риска развития РЯ у женщин первой линии родства очень высок. Это подтверждают следующие исследования по изучению рисков: RR составил 8,9567 при p=0,0305 и OR — 9,8216 при p=0,0266.
К настоящему времени многочисленными исследованиями представлено два гена, наследуемые мутации в которых приводят к возникновению семейных форм рака молочной железы и рака яичников (РЯ) — BRCA1 и BRCA2. У всех родственников в семье, имеющих один и тот же патологический вариант гена, повышается риск развития онкологического заболевания, по некоторым данным, такой риск приближается к 90%. Однако наиболее угрожающими являются данные, которые демонстрируют, что носительство этих мутаций повышает риск развития заболевания в молодом возрасте в 10 раз [1—4]. Зачастую в одной семье обнаруживаются случаи и рака молочной железы и Р.Я. Выявление мутаций с последующей диспансеризацией пациенток позволяет предотвратить развитие заболевания не только у пациенток, но и у их родственниц. Однако следует понимать, что генетическая природа этих форм рака показана только в 15% от общего числа случаев, что демонстрирует многофакторность их патогенеза [5, 6].
Согласно данным некоторых авторов, ассоциированность с мутациями в генах BRCA1 и BRCA2 при РЯ составляет более 90% от всех форм наследственного рака. В связи с этим задача этого этапа исследования — изучить частоту и вклад мутаций BRCA при различных формах РЯ, включая спорадические случаи.
Цель исследования — изучить особенности распределения частот генотипов и аллелей генов BRCA1 и BRCA2 у здоровых женщин и среди пациенток с РЯ и определить вклад генов BRCA1 и BRCA2 в формирование основных форм заболевания и влияние на течение и эффективность лечения этого заболевания.
Проведено генотипическое обследование образцов ДНК от 208 пациенток узбекской этнопринадлежности, жительниц Андижанской области с диагнозом РЯ, наблюдаемых в гинекологическом отделении АООД в период с 2008 по 2015 г. Кроме того, обследованы 80 здоровых женщин первой линии родства (дочери, родные сестры и матери) пациенток с РЯ для изучения наследственных форм заболевания.
Для проведения исследований аллельных вариантов генов BRCA1 и BRCA2 использовали опухолевый материал на парафиновых блоках, взятый в период с 2008 по 2012 г., и образцы периферической венозной крови, полученные в период с 2013 по 2015 г. Сбор материала осуществляли в Андижане, после чего его доставляли для проведения молекулярно-генетических исследований на базу НДЦ «ImmunogenTest» при РНЦ иммунологии Минздрава Республики Узбекистан.
Результаты и обсуждения
При генотипировании вариантов BRCA1 - BRCA1_4153delA, BRCA1_5382insC, BRCA1_3819delGTAAA, BRCA1_300T>G (Cys61GLY), BRCA1_2080delA, BRCA1_185delA, BRCA1_3875delA, BRCA2_2080delA 6174delT — во всех изученных образцах общее наличие мутации обнаружено в 24 (9,3%) из 288 случаев. Выявлены достоверные различия характера распределения генотипических вариантов между пациентками с РЯ и их ближайшими родственницами.

Установлены достоверно значимые различия (χ 2 =3,92; р=0,05) между группой больных раком и группой здоровых, что составило 11,1 и 1,25% соответственно. В группе здоровых среди 80 женщин мутации обнаружены в 1,25% случаев, в то время как среди пациенток с РЯ — в 11,1% (табл. 1). Таблица 1. Частота встречаемости мутаций в гене BRCA 1, 2 в группах больных РЯ и здоровых родственниц
Из всех изученных 8 вариантов выявлено 5 мутаций (4153delA, 5382insC, Cys61Gly, 2080delA, 3819delGTAAA), однако превалирующими оказались 5382insC (BRCA1) в 8,7% и BRCA1_4153delA в 2,9% от всего числа больных РЯ (см. табл. 1). По данным других авторов [3, 6], мутации BRCA1 4153delA также идентифицированы как рисковые для РЯ, но не рака молочной железы.

Три варианта BRCA 1, 2 также выявлены с низкой частотой: BRCA1 300T>G (Cys61GLY) у 1% пациенток в группе РЯ и не обнаружены среди здоровых; BRCA1_2080delAи BRCA1_3819delGTAAA установлены по 1,4% среди пациенток с РЯ. У родственниц пациенток с РЯ выявлен вариант BRCA_1 5382insC у 2% женщин (рис. 1). Рис. 1. Встречаемость мутаций BRCA1_5382insC и BRCA1 4153delA у больных РЯ и их здоровых ближайших родственниц.
Например, по данным возможной связи гена BRCA с развитием рака молочной железы и яичников в России показана значимость мутации BRCA1_185delAG, BRCA2_6174IT и BRCA1_3875 delGTAAA. Однако в нашем исследовании эти варианты не выявлены ни в одном случае, что указывает на нецелесообразность включения данных вариантов в наши генодиагностические панели для выявления РЯ.
Таким образом, BRCA1 5382insC имеет большую значимость в возникновении наследственной формы РЯ, чем BRCA1 4153delA. Мутации аллеля BRCA1 5382insC можно использовать как критерий прогноза РЯ и включать в скрининговые исследования.
Нами впервые установлен характер генотипической вариабельности гена BRCA в Андижанском регионе как среди пациенток с РЯ, так и здоровых женщин. Аналогичные результаты представлены в других странах, где также преобладающим прогностически значимым вариантом был идентифицирован BRCA1 5382insC [7, 8].
Анализ полученных результатов показал, что мутация BRCA1_4153delA встречалась у 6 пациенток с РЯ, что составило 2,9% (р>0,05). Чаще всего в 18 (8,7%) случаях в обследуемой группе выявили мутацию BRCA1_5382insC, в группе здоровых ближайших родственниц эту мутацию определили у 1 (1,25%) обследуемой (р>0,05). Мутация BRCA1_300T>G (Cys61GLY) обнаружена у 2 (1%) женщин (р>0,05), BRCA1_3819delGTAAA — у 3 (1,4%) р>0,05) и BRCA1_2080delA — у 2 (1,4%) (р>0,05) (см. табл. 1).

Кроме того, проведен анализ показателей OR и RR с целью изучения возможного рискового вклада мутаций BRCA в развитие РЯ (табл. 2). Таблица 2. Показатели RR и OR для выявления вклада мутаций BRCA 1, 2 в развитие рака яичника При анализе групп с РЯ и здоровых (контроль) показатель RR составил 8,9567 при p=0,0305 (CI95% 1,2297—65,2376), а показатель OR — 9,8216 при p=0,0266 (CI95% 1,3037—73,9950).
Для определения вклада мутаций в гене BRCA при прогнозировании течения заболевания также провели анализ носительства мутаций при различных стадиях процесса РЯ в зависимости от стадии заболевания (с I по IV). Основную мутацию BRCA1_5382insC выявляли при всех стадиях заболевания, но чаще всего при IV стадии — 40%. В целом анализ показал, что частота встречаемости всех мутаций BRCA среди больных РЯ с I стадией составила 46,2% и среди пациенток с IV стадией — 40%. Достоверных различий встречаемости мутаций в зависимости от форм (наследственные/спорадические) и стадии процесса не выявлено.

Больные с I стадией процесса имели следующие виды мутаций: BRCA1_4153delA у 2 (15,4%) больных, BRCA1_5382insC у 4 (30,8%) больных и 3 вида мутации: BRCA1_3819delGTAAA, BRCA1_300T>G (Cys61GLY), BRCA1_2080delA, которые составили по 7,7% соответственно. У больных с II—III стадией заболевания были обнаружены мутации BRCA1_5382insC у 9 (6,4%) и 3 (6%) соответственно (табл. 3). Таблица 3. Встречаемость мутации в гене BRCA в зависимости от стадии заболевания
Таким образом, диагностику спектра мутаций BRCA1_5382insC, BRCA1_4153delA, BRCA1_3819delGTAAA, BRCA1_300T>G (Cys61GLY) и BRCA1_2080delA необходимо использовать для выявления заболевания на более ранних стадиях, помимо скринингового обследования для выявления риска развития РЯ.

Мы также провели анализ носительства мутаций гена BRCA при различных морфологических формах. При анализе данных встречаемости различных морфологических форм в зависимости от возрастных групп отметили, что в возрасте 46—55 лет (пременопауза) наиболее часто встречались опухоли эпителиального характера. Серозная форма диагностирована у 43 (16,7%), сосочковая — у 57 (22,1%), недифференцированная — у 26 (10,1%). Среди лиц молодого возраста до 17 лет серозная форма встретилась всего лишь у 1 (1,8%) больной. Недифференцированная гистологическая форма при РЯ, как и при других формах злокачественной опухоли, является самым неблагоприятным в прогнозе течения опухоли. Из всех гистологических форм недифференцированный рак выявлен у 26 (10,1%) женщин. Это означает, что пациентки с данной гистологической формой опухоли имеют плохой прогноз в плане общей выживаемости и безрецидивного периода течения заболевания. Продолжительность жизни за счет удлинения безрецидивного промежутка времени с применением самых современных методов лечения играет огромную роль у онкологических больных (табл. 4). Таблица 4. Наличие мутаций в различных гистологических группах Примечание. * — p

При изучении возрастного состава пациенток с мутацией в гене BRCA1 получены следующие данные: пациентки молодого возраста (до 35 лет) - 2 (5,5%), среднего возраста (35-59 лет) - 11 (48,6%), пожилого возраста (60 лет-74 года) - 10 (45,9%) (рис. 2). Рис. 2. Возрастная характеристика больных РЯ.
Интерес также представляет наличие мутаций в различных гистологических группах. Среди больных с сосочковой гистологической опухолью встречаемость мутаций обнаружена у 10 (41,7%), со светлоклеточной формой опухоли — у 1 (4,2%), с дисгерминомой — у 2 (8,3%), с эмбриональной опухолью — у 1 (4,2%), с недифференцированной формой — у 3 (12,5%) и с тератобластомой и гранулезоклеточной опухолью — у 4,2 и 4,2% соответственно. Из этого следует, что встречаемость мутаций в гене BRCA 1, 2 чаще характерна для эпителиальных опухолей у 18 (78,2%) пациенток по сравнению к неэпителиальными опухолями выявлены у 5 (21,7%). Интересным является тот факт, что у всех пациенток с мутацией в гене BRCA1 морфологически определяли сосочковую форму опухоли.
Таким образом, частота встречаемости серозной, сосочковой, недифференцированной форм в группе женщин узбекской популяции превалирует над другим морфологическим типом опухоли. Анализ показывает, что наличие мутации в гене ВRCA1 может привести к возникновению эпителиального РЯ, так как у пациенток с эпителиальной формой рака обнаружен большой процент мутаций.
Из 208 пациенток с РЯ у 11,1% выявлены 5 из 8 мутаций гена BRCA 1, 2 — 4153delA, 5382insC, Cys61Gly, 2080delA, 3819delGTAAA, превалирующими явились 5382insC (BRCA1) у 8,7% и BRCA1_4153delA у 2,9% от всего числа больных Р.Я. Среди 80 здоровых родственниц выявлен вариант BRCA_1 5382insC у 2% женщин. Изучение вклада мутаций BRCA в развитие РЯ показало, что неблагоприятный генотип имеет высокий статистически значимый коэффициент риска развития РЯ: RR составил 8,9567 при p=0,0305 и OR — 9,8216 при p=0,0266. Наличие мутации в гене BRCA1 у больных РЯ ассоциируется с прогностически неблагоприятным течением заболевания, общая эффективность 0%, а у больных без мутации 70,1%. Анализ относительного риска (RR) среди прооперированных больных с/без мутации в гене BRCA показал, что наличие мутации достоверно ассоциировано с прогрессированием заболевания: RR=1,2245 при р-valueRR=2,5444 при р<0,0001). Случаи с ранним рецидивированием у лиц с мутациями в гене BRCA достоверно отличались от таковых у пациенток без мутаций (RR=7,7516 при р<0,0001).
Оценка ассоциации генетических вариантов генов и с развитием рака яичников
Журнал: Оперативная хирургия и клиническая анатомия. 2018;2(3): 19‑24
Цель исследования. Изучение распределения частот генотипов и аллелей генов BRCA1 и BRCA2 у здоровых женщин и пациенток с раком яичников и их вклада в развитие заболевания. Материал и методы. Изучены данные 208 женщин с раком яичника, находившихся на диспансерном учете в Андижанском областном онкологическом диспансере в период 2008—2015 гг. и 80 здоровых ближайших родственниц пациенток. Результаты. Из 208 пациенток с раком яичников у 11,1% были выявлены 5 из 8 мутаций гена BRCA1/2 — 4153delA, 5382insC, Cys61Gly, 2080delA, 3819delGTAAA. При этом превалирующими явились 5382insC (BRCA1) у 8,7% и BRCA1_4153delA у 2,9% от всех больных раком яичников. Среди 80 здоровых родственниц был выявлен вариант BRCA1 5382insC у 2% женщин. Наличие мутации в гене BRCA1 у больных раком яичников ассоциируется с прогностически неблагоприятным течением заболевания, общая эффективность 0%, а у больных без мутации — 70,1%. Заключение. Полученные результаты вносят существенный вклад в современные достижения медицинской генетики, онкогинекологии и иммунологии. Особенности течения, лечения и прогнозирования рака яичника являются базой для дальнейшего изучения возникновения и развития этого заболевания.
Сегодня в многочисленных исследованиях представлено 2 гена, наследуемые мутации в которых приводят к возникновению семейных форм рака молочной железы (РМЖ) и рака яичника (РЯ) — BRCA1 и BRCA2. У всех родственников в семье, имеющих один и тот же патологический вариант гена, повышается риск развития онкологического заболевания, по некоторым сведениям он приближается к 90%. Данные мировой статистики за последние 10 лет говорят о том, что носительство этих мутаций повышает риск развития заболевания в молодом возрасте в 10 раз [1—5]. Зачастую в одной семье обнаруживаются случаи РМЖ и Р.Я. Выявление мутаций с последующей диспансеризацией пациенток позволяет предотвратить развитие заболевания не только у больных, но и их родственниц. Однако следует понимать, что генетическая природа этих форм рака показана только в 15% от общего числа случаев, что говорит о многофакторности их патогенеза [6—8].
Согласно данным некоторых авторов, ассоциированность с мутациями в генах BRCA1 и BRCA2 при РЯ составляет более 90% от всех форм наследственного рака. Поэтому задачей данного исследования явилось изучение частоты и вклада мутаций BRCA при различных формах РЯ, включая спорадические случаи.
Цель исследования — изучить особенности распределения частот генотипов и аллелей генов BRCA1 и BRCA2 у больных РЯ и здоровых женщин; определить вклад указанных генов в формирование основных форм, течение и эффективность лечения данного заболевания.
Проведено генотипическое обследование образцов ДНК от 208 пациенток узбекской этнопринадлежности, жительниц Андижанской области, с диагнозом РЯ, наблюдавшихся в гинекологическом отделении Андижанского областного онкологического диспансера в период 2008—2015 гг. Кроме того, были обследованы 80 здоровых женщин первой линии родства (дочери, родные сестры и матери) больных РЯ для изучения его наследственных форм.
Для проведения исследований аллельных вариантов генов BRCA1 и BRCA2 использовали опухолевый материал на парафиновых блоках (2008—2012) и образцы периферической венозной крови (2013—2015). В г. Андижане осуществляли сбор материала, который в последующем доставляли для проведения молекулярно-генетических исследований на базу Научно-диагностического центра «Immunogen Test» при Институте иммунологии АН РУз. (pcr.gl.uz).
Анализ последовательности ДНК в режиме реального времени, основанный на технологии пиросеквенирования, и Q-PCR HRM осуществляли с помощью проведения полимеразной цепной реакции. Для этого брали ДНК с приблизительной концентрацией 0,1 мкг/мл, разбавленную деионизированной водой, и соответствующие праймеры с концентрацией 10 пмоль/мкл.
Из парафиновых блоков делали срезы толщиной 20 мкм, с которыми проводили дальнейшее выделение ДНК:
— добавляли 100—120 мкл 0,5% раствора Твин 20;
— нагревали 15 мин при +90 °С;
— вливали 50 мкл протеиназы К при +55 °С;
— добавляли 100 мкл 5% раствора Челекс 100;
— вливали 5 мкл 0,5 М Трис и 1 М ЭДТА;
— термостатировали 15 мин при +100 °С;
— центрифугировали при 10 500 об/мин с последующим охлаждением;
— удаляли парафин с последующим нагревом осадка с хлороформом до +45 °C;
— центрифугировали при 10 500 об/мин;
— переносили супернатант 5 мкл 5 М хлористого натрия и 500мкл этилового спирта;
— центрифугировали при 10 500 об/мин 30 мин;
— после полного высушивания спирта добавляли 30—50 мкл dTE.
При генотипировании вариантов BRCA1 (BRCA1_4153delA, BRCA1_185delA, BRCA1_300T>G (Cys61GLY), BRCA1_3875delA, BRCA2_2080delA 6174delT, BRCA1_3819delGTAAA, BRCA1_2080delA, BRCA1_5382insC) во всех изученных образцах общее наличие мутации было обнаружено в 24 (9,3%) из 208 случаев. Выявлены достоверные различия в характере распределения генотипических вариантов между больными РЯ и их ближайшими родственницами.
Однако были установлены достоверно значимые различия (χ 2 =3,92, р=0,05) между группой раковых больных и группой здоровых обследованных, что составило 11,1 и 1,25% соответственно. В группе здоровых среди 80 женщин мутации обнаружены в 1,25% случаев, в то время как среди больных РЯ — в 11,1%.
Среди всех изученных 8 вариантов выявлено 5мутаций — 4153delA, 5382insC, Cys61Gly, 2080delA, 3819delGTAAA, однако превалирующими оказались 5382insC (BRCA1) в 8,7% и BRCA1_4153delA в 2,9% от всех больных Р.Я. По данным других авторов, мутации BRCA1_4153delA также идентифицированы как рисковые для РЯ, но не РМЖ [9].

Низкую частоту выявления показали 3 варианта BRCA 1, BRCA 2 — BRCA1_300T>G (Cys61GLY) найден в 1% случаев в группе больных РЯ и не обнаружен среди здоровых; BRCA1_2080delA и BRCA1_3819delGTAAA выявлены по 1,4% среди больных Р.Я. Среди родственниц больных РЯ был выявлен вариант BRCA_1 5382insC у 2% женщин (рис. 1). Рис. 1. Встречаемость мутаций BRCA1_5382insC и BRCA1_4153delA у больных РЯ и здоровых ближайших родственниц.
К примеру, по данным возможной связи гена BRCA с развитием РМЖ и РЯ в России показана значимость мутации BRCA1_185delAG, BRCA2_6174IT и BRCA1_3875 delGTAAA [8, 10], однако в представленном исследовании эти варианты не были выявлены ни в одном случае, что указывает на нецелесообразность включения этих вариантов в наши генодиагностические панели для РЯ.
Таким образом, BRCA1_5382insC имеет большую значимость в возникновении наследственной формы РЯ, чем BRCA1_4153delA. Мутации аллеля BRCA1_5382insC можно использовать как критерий прогноза РЯ и включить его для скрининговых исследований.
Нами впервые был установлен характер генотипической вариабельности гена BRCA в Андижанском регионе как среди больных РЯ, так и среди здоровых женщин. Аналогичные результаты были представлены в других странах, где также преобладающим прогностически значимым вариантом был идентифицирован BRCA1_5382insC [9, 11].

Анализ полученных результатов показал, что мутация BRCA1_4153delA встречалась у 6 (2,9%) больных РЯ, р>0,05. В наибольшем количестве в исследуемой группе выявлена мутация BRCA1_5382insC — 18 (8,7%) эпизодов, в группе здоровых ближайших родственниц эта мутация обнаружена у 1 (1,25%) женщины, р>0,05. Мутация BRCA1_300T>G (Cys61GLY) зафиксирована у 2 (1%) женщин, BRCA1_3819delGTAAA — у 3 (1,4%) пациенток, BRCA1_2080delA — у 2 (1,4%) обследованных, p>0,05 (табл. 1). Таблица 1. Частота встречаемости мутаций в генах BRCA1 и BRCA2 в группах больных РЯ и здоровых родственниц
Кроме того, был проведен анализ показателей отношения шансов (OR) и относительного риска (RR) с целью изучения возможного рискового вклада мутаций BRCA в развитие РЯ (табл. 2). Таблица 2. Показатели RR и OR для выявления вклада мутаций BRCA1 и BRCA2 в развитие РЯ При анализе групп больных РЯ и здорового контроля показатель RR составил 8,9567 при p=0,0305 (CI 95% 1,2297—65,2376), а показатель OR составил 9,8216 при p=0,0266 (CI 95% 1,3037—73,9950).
Для определения вклада мутаций в гене BRCA в целях прогноза течения заболевания был проведен анализ носительства мутаций при различных стадиях процесса РЯ в зависимости от стадии заболевания — с I по IV. Основная мутация BRCA1_5382insC была выявлена на всех стадиях заболевания, но с наибольшей частотой на IV стадии — 40%. В целом анализ показал, что частота встречаемости всех мутаций BRCA среди больных РЯ с I стадией составила 46,2%, среди пациенток с IV стадией — 40%. Достоверных отличий встречаемости мутаций в зависимости от наследственных форми стадии процесса выявлено не было.
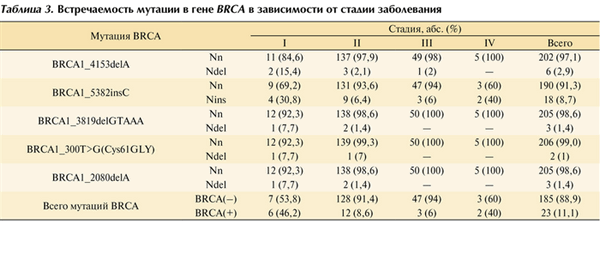
Больные с I стадией процесса имели следующие виды мутаций — BRCA1_4153delA — у 2 (15,4%) женщин, BRCA1_5382insC — у 4 (30,8%) пациенток, а также мутации BRCA1_3819delGTAAA, BRCA1_300T>G (Cys61GLY), BRCA1_2080delA составили по 1 (7,7%) соответственно. Среди больных со II—III стадиями заболевания были обнаружены мутации BRCA1_5382insC у 9 (6,4%) и 3 (6%) женщин соответственно (табл. 3). Таблица 3. Встречаемость мутации в гене BRCA в зависимости от стадии заболевания
В рамках представленного исследования был проведен анализ носительства мутаций гена BRCA при различных морфологических формах. В ходе анализа данных по встречаемости различных морфологических форм в зависимости от возрастных групп было обнаружено, что в возрасте 46—55 лет (пременопауза) наиболее часто встречались опухоли эпителиального характера. Серозная форма опухоли диагностирована у 43 (16,7%), сосочковая — у 57 (22,1%), недифференцированная — у 26 (10,1%) пациенток. Среди лиц молодого возраста (до 17 лет) серозная форма зафиксирована лишь у 1 (1,8%) больной. Недифференцированная гистологическая форма при РЯ, как и при других формах злокачественной опухоли, является самым неблагоприятным фактором в прогнозе ее течения. Из всех гистологических форм недифференцированный рак составил 26 (10,1%) случаев. Это означает, что пациентки с данной гистологической формой опухоли имеют плохой прогноз в плане общей выживаемости и безрецидивного периода течения заболевания. Продолжительность жизни за счет удлинения безрецидивного промежутка времени с применением самых современных методов лечения играет огромную роль у онкологических больных.

Изучение возрастного состава обследованных женщин с мутацией в гене BRCA1 показало, что среди них были 2 (5,5%) молодые пациентки (до 35 лет), 11 (48,6%) женщин среднего (35—59 лет) возраста и 10 (45,9%) женщин пожилого (60 лет —74 года) возраста (рис. 2). Рис. 2. Возрастная характеристика больных РЯ.

Интерес также представляет наличие мутаций в различных гистологических группах. Среди больных с папиллярной формой опухоли встречаемость мутаций была обнаружена у 10 (41,7%) пациенток; светлоклеточной формы опухоли — у 1 (4,2%) женщины; в дисгерминоме — у 2 (8,3%) обследованных; в эмбриональной опухоли — у 1 (4,2%) женщины; в недифференцированной форме — у 3 (12,5%) пациенток; в тератобластоме и гранулезоклеточной опухоли — у 1 (4,2%) и 1 (4,2%) пациенток соответственно. Из сказанного следует, что встречаемость мутаций в генах BRCA1, BRCA2 чаще характерна для эпителиальных опухолей (обнаружены у 18 (78,2%) пациенток) по отношению к неэпителиальным опухолям (выявлены в 5 (21,7%) случаях). Примечателен тот факт, что у всех пациенток с мутацией в гене BRCA1 морфологически определяли эпителиальную (папиллярную) форму опухоли (табл. 4). Таблица 4. Наличие мутаций в различных гистологических группах Примечание: * — достоверность p
Таким образом, частота встречаемости серозной, сосочковой, недифференцированной формы в группе узбекской популяции превалирует над другими морфологическими типами опухоли. Анализ показал, что наличие мутации в гене ВRCA1 может привести к возникновению эпителиального РЯ, так как у пациенток с эпителиальной формой рака был обнаружен большой процент мутаций.
Из 208 больных РЯ у 11,1% обследованных были выявлены 5 из 8 мутаций гена BRCA1/2 — 4153delA, 5382insC, Cys61Gly, 2080delA, 3819delGTAAA, превалирующими явились 5382insC (BRCA1) в 8,7% и BRCA1_4153delA в 2,9% от всех больных Р.Я. Среди 80 здоровых родственниц был выявлен вариант BRCA_1 5382insC у 2% женщин.
Изучение вклада мутаций BRCA в развитие РЯ показало, что неблагоприятный генотип имеет высокий, статистически значимый коэффициент риска развития РЯ: RR составил 8,9567 при p=0,0305 и OR — 9,8216 при p=0,0266.
Наличие мутации в гене BRCA1 у больных РЯ ассоциируется с прогностически неблагоприятным течением заболевания, общая эффективность 0%, а у больных без мутации — 70,1%. Анализ RR среди прооперированных больных с наличием мутации в гене BRCA и без таковой показал, что наличие мутации достоверно ассоциировано с прогрессированием заболевания: RR=1,2245 при р-value
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Мамадалиева Яшнар Мамасалиевна — д.м.н., доцент, заведующая курсом ультразвуковой диагностики ТАШ ИУВ, Республика Узбекистан
Азизов Юрий Далиевич — д.м.н., проф., заведующий кафедрой микробиологии Андижанского государственного медицинского института, Республика Узбекистан
Якуббекова Сохиба Садыковна — ассистент кафедры онкологии и медицинской радиологии Андижанского государственного медицинского института, Республика Узбекистан
Читайте также:
- Эффективность резекции легких при распространенном туберкулезе. Предоперационная подготовка при туберкулезе легких
- Влияние соматостатина на секрецию поджелудочной железы. Регуляция уровня глюкозы
- Синдром Мейенбурга-Альтерра-Улингера (Meyenburg-Altherr-Uehlinger)
- Врожденный вывих бедра и дисплазия тазобедренного сустава: атлас фотографий
- Инфекции грибов рода Aspergillus: диагностика, лечение, профилактика
