Химиотерапия немелкоклеточного рака легкого - эффективные препараты
Обновлено: 18.05.2024
«. При немелкоклеточном раке легкого 75% больных являются потенциальными кандидатами для проведения консервативной терапии»
См.материалы доклада проф.В.А.Горбуновой с соавт.
Доклад (Заседание Московского Онкологического Общества №524; тема Лекарственное лечение больных раком легкого)
Авторы: Бычков М.Б., Полоцкий Б.Е., Михина З.П., Дгебуадзе Э.Н. (РОНЦ им. Н.Н. Блохина)
Мелкоклеточный рак легкого (МРЛ) - выделенная особо морфологическая форма опухоли, которая характеризуется быстрым ростом, ранним метастазированием, высокой чувствительностью к лучевой и химиотерапии. За последние 20 лет отмечается уменьшение частоты МРЛ до 15-20%.
В 1970-80-х гг. МРЛ считался «терапевтическим», однако в связи с улучшением диагностики (КТ, МРТ, ПЭТ) МРЛ стал выявляться в более ранних стадиях, в связи с чем были пересмотрены показания к хирургическому лечению при этой морфологической форме. Для МРЛ особое значение имеет оценка распространенности процесса в символах ТNМ что определяет выбор лечебной тактики (хотя возможно подразделение МРЛ на локализованную и распространенную стадию). При локализованном процесса (ЛМРЛ) опухолевое поражение ограничено одной стороной грудной клетки с возможным вовлечением лимфоузлов корня и средостения, при распространенном - поражение выходит за пределы гемиторакса.
Общепризнано, что операция показана при ранних стадиях МРЛ (Т1-2 N0-1), но обязательно должна дополняться послеоперационной (адъювантной) химиотерапией (4 курса с интервалами 3 недели). Такое лечение позволяет добиться до 39% 5-летней выживаемости. Хирургическое лечение при более поздних стадиях МРЛ является предметом клинических исследований; которые должны дать ответ на вопрос о том, увеличивает ли операция продолжительность жизни этих больных. Лучевая терапия может привести к регрессии опухоли в 60-80% случаев, однако в самостоятельном виде не увеличивает продолжительность жизни из-за появления отдаленных метастазов.
Химиотерапия остается краеугольным камнем лечения МРЛ. За последние годы появились новые активные цитостатики, такие как таксол (паклитаксел), таксотер (доцетаксел), топотекан (гикамптин), кампто (иринотекан), гемзар (гемцитабин), которые показали свою активность при МРЛ. Показано также, что для I линии химиотерапии предпочтительнее схема ЕР, чем CAV, а также отмечена большая эффективность платиносодержащих схем химиотерапии. Наиболее часто применяются следующие активные схемы комбинированной химиотерапии МРЛ: 1) Этопозид + цисплатин (ЕР). 2) Таксол + карбоплатин. 3) Таксотер + цисплатин. 4) Иринотекан + цисплатин. 5) Циклофосфан + адриамицин + винкристин (CAV). 6) Циклофосфан + адриамицин + этопозид (CDE).
При локализованном процессе (ЛМРЛ) должна проводиться одновременная химиолучевая терапия. В больших рандомизированных исследованиях показано, что химиолучевая терапия при ЛМРЛ имеет преимущество над одной химиотерапией, а «ранняя» лучевая терапия (на I - II курсах химиотерапии) над «поздней» (на III - IV курсах). Медиана выживаемости при ЛМРЛ за последние 20 лет увеличилась в 1,5 раза (с 11,8 до 18,8 мес.), а 5-летняя выживаемость - более чем в 2 раза (с 5,2 до 12,2%). Однолетняя выживаемость при распространенном процессе возросла более, чем в 3 раза: до 1980 г. она составляла 12%, а после 2000 г. - 39,3%. У больных с распространенным процессом (это 60-75% всех больных МРЛ) основным методом лечения является комбинированная химиотерапия в указанных выше режимах. Облучение проводится на различные очаги метастазирования с паллиативной целью (метастазы в мозг, кости скелета, надпочечники и др.). Эффективность химиотерапии у этих больных составляет 60-70%, причем в 10-20% случаев удается достичь полной ремиссии.
Профилактическое облучение мозга (ПОМ) проводится в связи с высоким риском метастазирования в головной мозг (до 70% пациентов, проживших 2 года и более). Оно показано больным с полной регрессией, снижает частоту метастазов в мозг, увеличивает выживаемость. Суммарная доза - до 40 Гр, разовая - до 2 Гр. После проведения химиотерапии (или химио-лучевого лечения), к сожалению, прогрессирование процесса регистрируется у значительного числа больных. В этих случаях выбор дальнейшей лечебной тактики зависит от выраженности ранее достигнутого эффекта и продолжительности безрецидивного периода. У больных, имевших полный или частичный эффект, в случаях развития прогрессирования болезни более чем через 3 мес. после окончания лечения, показана попытка применения той же схемы, при которой был достигнут эффект индукционной терапии.
Для больных с рефрактерным рецидивом или прогрессированием, развившимся ранее 3 мес от начала лечения, показано применение других лечебных схем (II линии химиотерапии). Для II линии химиотерапии рекомендуется схема CAV (если I линия была ЕР) и наоборот, а также топотекан. Комбинация топотекана и цисплатина аналогична по эффекту схеме ЕР. В последние годы появились данные об эффективности химиотерапии у больных с метастазами МРЛ в головной мозг (схемы гемзар + цисплатин 1 раз в неделю и нидран (ACNU) + ЕР) у 60-70% пациентов.
Будущие исследования при МРЛ должны быть направлены на профилактику прогрессирования процесса у излеченных больных, определение наиболее эффективных комбинаций цитостатиков, а также разработку лечебной стратегии, учитывающую биологические особенности МРЛ (применение в схемах лечения антиангиогенных препаратов, таргетной терапии, а также достижений генетики и молекулярной биологии).
По материалам Вестника Московского Онкологического Общества, №1, январь 2006
Химиотерапия немелкоклеточного рака легкого - эффективные препараты
Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель Российского общества клинической онкологии (RUSSCO), профессор, доктор медицинских наук, Москва
Последние мои публикации были посвящены результатам применения ингибиторов контрольных точек иммунного ответа в первой линии системной терапии немелкоклеточного рака легкого (НМРЛ). Результаты исследований, доложенные на прошедших конгрессах AACR и ASCO в этом году, полностью изменили наше представление о характере ее проведения.
Уместно вспомнить, что еще в декабре 2016 года схема лечения метастатического НМРЛ была предельна проста. Больные аденокарциномой с активирующими мутациями были кандидатами для получения таргетных препаратов. В случае прогрессирования после ингибиторов тирозинкиназы больным было показано назначение химиотерапии. Остальные больные НМРЛ были кандидатами для получения химиотерапии. У больных аденокарциномой в качестве химиотерапии первой линии преимущественно назначали комбинации цисплатина и пеметрекседа или карбоплатина и паклитаксела. У больных плоскоклеточным раком в качестве химиотерапии первой линии назначали комбинацию цисплатина и гемцитабина или цисплатина и паклитаксела. В случае прогрессирования больным назначали вторую линию препаратами пеметрексед или доцетаксел.
Все изменилось в декабре 2016 года, когда стали доступны результаты исследования KEYNOTE 024, в котором проводили сравнение между ингибитором PD-1 пембролизумабом и химиотерапией в качестве первой линии у больных НМРЛ с экспрессией PD-L1 более 50%. Столь высокая экспрессия PD-L1 диагностируется у 25-30% больных НМРЛ независимо от гистологии опухоли. Назначение пембролизумаба в первой линии достоверно снизило относительный риск прогрессирования на 50% и риск смерти на 37% по сравнению с химиотерапией [1]. Медиана продолжительности жизни в группе пембролизумаба достигла 30,0 мес. по сравнению с 14,2 мес. в группе химиотерапии при одновременной лучшей переносимости лечения [2]. В связи с этим пембролизумаб был рекомендован в качестве предпочтительной первой линии системной терапии у больных как аденокарциномой, так и плоскоклеточным раком с высокой экспрессией PD-L1. Ни ниволумаб, ни атезолизумаб в монотерапии не смогли продемонстрировать преимущество перед химиотерапией у больных НМРЛ.
В исследовании KEYNOTE 189 у больных аденокарциномой независимо от экспрессии PD-L1 проведено сравнение химиотерапии и комбинации химиотерапии и пембролизумаба. Комбинация пембролизумаба и химиотерапии продемонстрировала лучшие отдаленные результаты по сравнению с химиотерапией только, достоверно уменьшив относительный риск прогрессирования и смерти на 48% и 51% соответственно [3]. Преимущество комбинации отмечено во всех изученных подгруппах, в том числе и у больных с различной экспрессией PD-L1. Относительный риск смерти при добавлении пембролизумаба был снижен на 41% в группе с отсутствием экспрессии PD-L1, на 45% - в группе с экспрессией PD-L1 1-49% и на 58% - в группе с экспрессией более 50%. Остается неясным, есть ли выигрыш от использования комбинации химиотерапии и пембролизумаба в сравнении с пембролизумабом только, который в монотерапии показал прекрасные результаты у больных с высокой экспрессией PD-L1. При этом большинство специалистов рекомендуют монотерапию пембролизумабом у больных с высокой экспрессией, резервируя использование комбинации с химиотерапией для больных аденокарциномой с низкой экспрессией (менее 50%) или ее отсутствием.
В исследовании iMPower 150 у больных с аденокарциномой независимо от экспрессии PD-L1 оценена целесообразность добавления атезолизумаба к комбинации химиотерапии и бевацизумаба. При медиане наблюдения 9,5 мес. добавление атезолизумаба достоверно уменьшило относительный риск прогрессирования на 38% и риск смерти на 22% по сравнению с комбинацией химиотерапии и только бевацизумаба [4]. Улучшение результатов лечения при добавлении атезолизумаба было отмечено у всех больных, независимо от уровня экспрессии PD-L1. Интерес представляет наблюдение о высокой активности комбинации атезолизумаба, бевацизумаба и химиотерапии у больных с активирующими мутациями при прогрессировании на фоне ингибиторов тирозинкиназы.
Оставалась еще одна группа больных, для которой требовалось определить эффективность иммунотерапии в первой линии. Это больные с плоскоклеточным раком и экспрессией PD-L1 менее 50%. В исследовании KEYNOTE-407 проведено сравнение химиотерапии и комбинации химиотерапии и пембролизумаба у больных IIIb-IV стадией плоскоклеточного рака независимо от уровня экспрессии PD-L1. При медиане наблюдения 8 месяцев назначение комбинации привело к снижению относительного риска смерти на 36% и прогрессирования на 44% по сравнению с химиотерапией [5]. Увеличение продолжительности жизни при добавлении пембролизумаба наблюдалось во всех анализируемых подгруппах, в том числе и при различной экспрессии PD-L1. Сделан предварительный вывод, что добавление пембролизумаба к химиотерапии достоверно и существенно улучшает отдаленные результаты лечения больных плоскоклеточным раком легкого независимо от уровня экспрессии PD-L1. Полученные результаты являются серьезным аргументом для регистрации комбинации пембролизумаба и химиотерапии в качестве предпочтительной первой линии системной терапии у больных плоскоклеточным раком с низкой экспрессией PD-L1.
Для больных плоскоклеточным раком независимо от уровня экспрессии PD-L1 в исследовании iMpower 131 проведено сравнение химиотерапии и комбинации химиотерапии и атезолизумаба. При медиане наблюдения 17 мес. добавление атезолизумаба к химиотерапии уменьшило относительный риск прогрессирования на 29% по сравнению с только химиотерапией, не оказав влияния на показатели общей выживаемости [6].
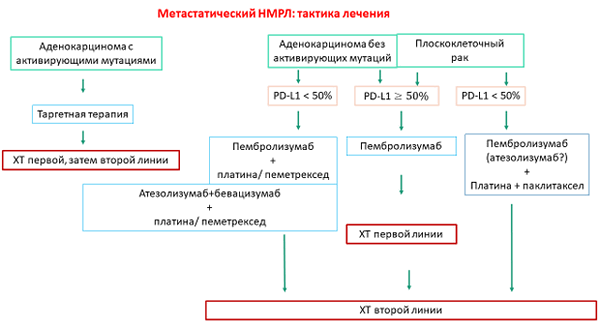
Рисунок 1. Тактика лечения больных метастатическим НМРЛ (по результатам проведенных исследований).
Таким образом, проведенные исследования изменили рекомендации по выбору первой линии системной терапии у больных НМРЛ (рис. 1). Химиотерапия, которая была до недавнего времени основным методом лечения этих больных, потеряла свое самостоятельное значение. У больных с высокой экспрессией PD-L1, вероятно, достаточно назначения одного пембролизумаба. У больных с аденокарциномой и низкой экспрессией PD-L1 показано назначение пембролизумаба и химиотерапии или комбинации атезолизумаба, бевацизумаба и химиотерапии. У больных с плоскоклеточным раком и низкой экспрессией PD-L1 рекомендовано назначения комбинации пембролизумаба и химиотерапии. Возможно, для этой группы больных будет рекомендована комбинация атезолизумаба и химиотерапии.
Ключевые слова: немелкоклеточный рак легкого, пембролизумаб, атезолизумаб, химиотерапия.
Химиотерапия метастатического немелкоклеточного рака легкого с отсутствием активирующих мутаций
Представлены современные алгоритмы лечения немелкоклеточного рака легкого с отсутствием активирующих мутаций. Препаратом выбора при плоскоклеточном раке является гемцитабин, при неплоскоклеточном - пеметрексед в комбинации с бевацизумабом (если он был компонентом фазы индукции).
- КЛЮЧЕВЫЕ СЛОВА: метастатический немелкоклеточный рак легкого, активирующие мутации, аденокарцинома, гемцитабин, пеметрексед, бевацизумаб, metastatic non-small cell lung cancer, activating mutations, adenocarcinoma, gemcitabine, pemetrexed, bevacizumab
На основании современных представлений о морфологии и эффективной фармакотерапии немелкоклеточный рак легкого подразделяют на плоскоклеточный, неплоскоклеточный (аденокарцинома, бронхиолоальвеолярный рак и редкие подтипы) и аденокарциному с наличием активирующих мутаций. Исследования патогенеза и биологии опухолевого роста, выявление ряда активирующих мутаций и создание препаратов, ингибирующих сигнальные пути, позволили значительно улучшить результаты лечения в таргетной популяции больных. Согласно существующим международным рекомендациям определение молекулярных подтипов рака легкого является строго обязательным. Это позволяет выбрать вариант лекарственной терапии. Тем не менее таргетная популяция больных весьма немногочисленна - от 10-17% в Европе и Америке и до 45% в странах Азиатского региона. В российской клинической практике превалируют больные плоскоклеточным раком, подлежащие классической неспецифической химиотерапии. При данной форме эффективные таргетные препараты только изучаются.
Отдельную позицию занимает ингибитор ангиогенеза бевацизумаб. Маркеров и предикторов его эффективности до настоящего времени не найдено. Установлено, что при плоскоклеточном раке препарат существенно увеличивает частоту фатальных легочных кровотечений, что стало причиной для его исключения из режимов лечения данного подтипа. В то же время включение бевацизумаба в режимы химиотерапии при неплоскоклеточном раке существенно улучшило результаты лечения.
В данном обзоре мы остановимся на наиболее распространенных подтипах без наличия активирующих мутаций.
При неоперабельном местнораспространенном или метастатическом раке основным методом лечения является химиотерапия, основанная на препаратах платины. Согласно международным рекомендациям оптимальными считаются комбинации цисплатина или карбоплатина (предпочтителен первый) с таксанами, гемцитабином, пеметрекседом или винорелбином. Эффективность в общей популяции больных невысока: объективный эффект достигается у 25-35% пациентов, медиана времени без прогрессирования составляет 4-6 месяцев, медиана общей выживаемости - 8-10 месяцев. Комбинации с циклофосфаном или Вепезидом считаются устаревшими как менее эффективные.
С учетом прогностических различий выбор варианта химиотерапии в зависимости от гистологического варианта опухоли представляется достаточно привлекательным.
Впервые достоверная связь гистологического подтипа немелкоклеточного рака легкого с результатами химиотерапии была установлена в 2008 г. Пеметрексед (Алимта) оказался единственным цитостатиком, эффективность которого зависела от гистологического типа опухоли.
Причины избирательной эффективности пеметрекседа при разных гистологических формах опухоли изучаются. Пеметрексед - это мультитаргетный антифолат, ингибирующий как минимум три разных энзима: тимидилатсинтазу (TS), дигидрофолатредуктазу (DHFR), глицинамид-рибонуклеотид-формил-трансферазу (GARFT). С помощью фермента фолилполиглутаматсинтазы пеметрексед в опухолевых клетках превращается в полиглутаматные формы. Полиглутаматные формы задерживаются в опухолевых клетках и являются более мощными ингибиторами TS и GARFT. Процесс полиглутамации зависит от времени и концентрации и имеет место в опухолевых клетках и в меньшей степени в нормальных тканях. У полиглутамированных метаболитов увеличивается период полувыведения, вследствие чего возрастает продолжительность действия и концентрация препарата в опухолевых клетках. Таким образом, пеметрексед считается препаратом с преимущественно внутриопухолевой активацией, что увеличивает эффективность при минимальном токсическом воздействии на нормальные ткани. На клеточных линиях было показано, что эффективность препарата ниже в случае выявления гиперэкспрессии TS и DHFR. Возможно, истинным предиктивным фактором является не гистологическая форма, а уровень TS. Показано, что ее средний уровень выше при крупноклеточном и плоскоклеточном раке по сравнению с таковым при аденокарциноме. Предклинические данные показали, что низкие уровни TS, DHFR, GARFT, MRP4, MRP5 коррелируют с повышенной чувствительностью к пеметрекседу [1].
Интересные данные о связи эффективности пеметрекседа с TTF-1 (thyroid transcription factor 1) получены при изучении маркеров в рамках исследования PointBreak [2]. Медиана общей выживаемости у больных, получавших пеметрексед, при позитивном TTF-1 (n = 73) была значимо выше, чем при негативном TTF-1 (n = 36), - 17,6 и 7,6 месяца соответственно. Данные требуют дальнейшего изучения, и при их подтверждении может быть установлен маркер эффективности успеха терапии пеметрекседом.
В крупном исследовании JMDB [3] 1725 больных в соотношении 1:1 были рандомизированы на две группы. Пациенты первой группы принимали цисплатин и гемцитабин, пациенты второй - цисплатин и пеметрексед. В общей популяции медиана общей выживаемости была одинаковой в обеих группах (10,3 против 10,3 месяца). При подгрупповом анализе установлено, что при аденокарциноме (n = 847) и крупноклеточном раке (n = 153) в группе пеметрекседа значения медианы были достоверно выше - 12,6 против 10,9 месяца (р = 0,03) (относительный риск (ОР) 0,84; 95% доверительный интервал (ДИ) 0,71-0,99) и 10,4 против 6,7 месяца (р = 0,005) (ОР 0,67; 95% ДИ 0,48-0,96) соответственно. При плоскоклеточном раке получены противоположные результаты: медиана общей выживаемости составила в группе пеметрекседа 9,4 месяца, в группе гемцитабина - 10,8 месяца (р = 0,05) (ОР 1,23: 95% ДИ 1,00-1,51). С гистологической структурой коррелировала и частота достижения объективного эффекта в сравниваемых группах. Так, при аденокарциноме у получавших пеметрексед она была достоверно выше - 31,9 против 24,5% (р = 0,024). При плоскоклеточном раке гемцитабин был эффективнее пеметрекседа - 36,7 против 26,9% (р = 0,033).
Особого внимания заслуживает достоверно более редкое развитие гематологических осложнений 3-4-й степени выраженности в группе пеметрекседа: частота нейтропении, включая фебрильную, тромбоцитопении и анемии была в два-три раза ниже.
В этом исследовании единственным фактором предсказания эффективности химиотерапии с включением пеметрекседа оказался гистологический тип опухоли.
В результате принцип выбора режима химиотерапии был поставлен в зависимость от гистологической структуры немелкоклеточного рака легкого. Были достигнуты, пожалуй, наиболее высокие из существующих при химиотерапии значения медианы общей выживаемости и частоты достижения объективного эффекта при использовании пеметрекседа при аденокарциноме и гемцитабина при плоскоклеточном раке.
Помимо высокой эффективности привлекательность применения пеметрекседа подчеркивает низкая частота развития серьезных побочных эффектов, позволяющая безопасно его комбинировать с карбоплатином даже у проблемных пациентов.
В рамках исследования фазы III 205 больных, имеющих статус 2 по шкале ECOG/ВОЗ, были рандомизированы на группу терапии только пеметрекседом (монотерапия является опцией лечения для данной категории) и группу комбинированной терапии пеметрекседом и карбоплатином [4]. В группе комбинированной химиотерапии достоверно чаще достигались объективный эффект (24 против 10,5%), стабилизация болезни (60,8 против 42,6%). Были достоверно выше медианы выживаемости без прогрессирования болезни - 5,9 против 3,0 месяца (р 2 три недели № 6, ранняя вторая линия) и группу наблюдения. При появлении первых признаков прогрессирования во второй группе назначали доцетаксел в аналогичном режиме. Основной целью исследования было влияние на общую выживаемость. Медиана выживаемости без прогрессирования болезни была достоверно выше у больных, получавших доцетаксел сразу по завершении фазы индукции, - 5,7 против 2,7 месяца (р = 0,0001). Достоверного влияния на общую выживаемость не установлено, медианы составили 12,3 против 9,7 месяца соответственно (р = 0,085). При сравнении качества жизни и спектра побочных эффектов достоверных различий в группах не выявлено. Таким образом, результаты данного исследования следует считать негативными: достоверного увеличения общей выживаемости не зафиксировано.
Рациональная тактика лечения больных немелкоклеточным раком легкого включает фазу индукции - комбинации производного платины с таксанами или гемцитабином, или навелбином, или пеметрекседом. Если принимать во внимание прогнозируемый спектр токсичности, при плоскоклеточном раке легкого более эффективными представляются комбинации с гемцитабином или таксанами. С учетом эффективности и безопасности при неплоскоклеточном раке, на наш взгляд, наиболее перспективны комбинации с пеметрекседом. Эффективность значимо повышается при включении в режим бевацизумаба. При отсутствии прогрессирования болезни после четырех курсов химиотерапии рационально проведение фазы поддержки. Среди существующих опций наиболее привлекательным препаратом выбора при плоскоклеточном раке является гемцитабин, при неплоскоклеточном - пеметрексед в комбинации с бевацизумабом (если он был компонентом фазы индукции).
«. При немелкоклеточном раке легкого 75% больных являются потенциальными кандидатами для проведения консервативной терапии»
Доклад (Заседание Московского Онкологического Общества №524; тема Лекарственное лечение больных раком легкого)
Авторы: Горбунова В.А., Маренич А.Ф., Пчелин Ю.Ю. (Отделение химиотерапии РОНЦ им. Н.Н.Блохина)
Пациентов НМРЛ можно условно разделить на 3 группы. В первой (сравнительно малочисленной) рассматриваются операбельные больные I-II стадиями, имеющие противопоказания к хирургическому лечению, которым возможно провести химиотерапию. Во второй группе (10-15%) - больные либо с местно-распространённым процессом (T3-4), либо с метастазами в регионарные лимфоузлы (N2-3). Большая часть из них обычно получает консервативное лечение (лучевую или химио-лучевую терапию), лишь немногие при T3 или N2 могут эффективно лечиться хирургическим методом. В третьей группе (примерно 50%) рассматриваются больные, у которых выявляются отдалённые метастазы (M1); лучевая или химиотерапия у этих пациентов может облегчить симптомы болезни. Кроме того, у каждого второго радикально оперированного больного выявляются местные рецидивы или/и отдалённые метастазы, при которых возможно проведение химио-лучевого лечения. Таким образом, 75% всех больных НМРЛ являются потенциальными кандидатами для проведения консервативной терапии.
Химиотерапия НМРЛ при III A стадии. У больных клинической стадией III A (N2) 5-летняя выживаемость составляет 10-15%. Однако, при массивном поражении медиастинальных лимфоузлов этот показатель снижается до 2-5%. В зависимости от клинических обстоятельств, основными методами лечения больных III A стадией являются лучевая терапия, химиотерапия, хирургия и комбинация этих методов. Хотя большинство больных не достигают полной ремиссии на лучевой терапии, она обеспечивает долговременное улучшение выживаемости у 5-10% пациентов при использовании стандартных доз, а также значительное симптоматическое улучшение. Добавление современных платиносодержащих режимов химиотерапии к лучевой терапии улучшает выживаемость. Метаанализ 11 клинических исследований продемонстрировал снижение летальности на 10% у больных, получавших цисплатин-содержащие режимы + лучевую терапию, по сравнению с применением только лучевой терапии. Оптимальная последовательность методов, фракционирование лучевой терапии и химиотерапевтические режимы продолжают изучаться.
Эффективным является проведение неоадъювантной химиотерапии. В двух исследованиях медиана выживаемости больных, получавших химиотерапию, оказалась в 3 раза большей, чем у больных в группе хирургического лечения. В работе Vansteenkiste проведение неоадъювантной химиотерапии позволило улучшить 2-летнюю выживаемость на 20%, а 5-летнюю - на 6%.
Современные режимы комбинированной неоадъювантной химиотерапии показали хорошие результаты и удовлетворительную переносимость. Ещё один лечебный подход, активно изучаемый в настоящее время - это неоадъювантная химио-лучевая терапия с использованием современных цитостатиков, которые по предварительной оценке оказались высокоэффективными и хорошо переносимыми.
Большинство ретроспективных исследований подтверждают, что послеоперационная лучевая терапия уменьшает частоту местных рецидивов, однако, остаётся спорным - улучшает ли это общую выживаемость. Метаанализ девяти рандомизированных исследований, сравнивавших результаты операции и лучевой терапии и одной операции, не показал различий выживаемости у больных с N2. При, сравнении результатов (только) послеоперационной лучевой терапии и её сочетания с одновременной химиотерапией Цисплатин + Этопозид, преимуществ последней схемы не выявлено. В настоящее время профилактическая химиотерапия не может быть рекомендована как стандартный метод лечения и находится в процессе изучения.
Химиотерапия НМРЛ при III В стадии. Стандартным подходом к лечению больных с неоперабельной III B стадией, при хорошем их состоянии, является химио-лучевая терапия. Однако, больным со злокачественным плевритом редко проводится лучевая терапия и их лечение подобно лечению больных IV стадией. Многочисленные рандомизированные исследования показали преимущества по выживаемости, у больных с нерезектабельной III B стадией, при одновременной цисплатин-содержащей химиотерапии и лучевой терапии, по сравнению с одной лучевой терапией. Ослабленные больные с III B стадией являются кандидатами для паллиативной лучевой терапии. Основными вопросами, которые обсуждаются в настоящее время, являются - выбор оптимальной последовательности химиотерапии и лучевой терапии, оптимального режима химиотерапии и конкретных цитостатиков с учётом их радиосенсибилизирующих свойств.
Результаты II-й фазы клинического исследования LAMP (Locally Advanced Multimodality Protocol) дали некоторую информацию по этим вопросам. В исследование было включено 276 больных, рандомизированных на 3 группы.
- Таксол + Карбоплатин * 2 цикла, затем лучевая терапия (ЛТ) в дозе 63 Гр. Медиана выживаемости - 12,5 мес.
- Таксол + Карбоплатин * 2 цикла, затем Таксол + Карбоплатин в еженедельном режиме + ЛТ в течение 7 недель, 63 Гр. Медиана выживаемости - 11 мес.
- Таксол + Карбоплатин + ЛТ в течение 7 недель, 63 Гр, затем Таксол + Карбоплатин * 2 цикла. Медиана выживаемости - 16,1 мес.
Медиана выживаемости в этом исследовании сравнивалась с медианой выживаемости 14,5 мес., продемонстрированной при последовательной химио-лучевой терапии в исследовании RTOG-8808. Анализ показал отсутствие улучшения выживаемости у больных в 1,2-й группах по сравнению с историческим контролем. Наилучший терапевтический эффект был получен в 3-й группе. Лечение оказалось хорошо переносимым. Несмотря на частые эзофагиты в группе 3 - 67% больных закончили химио-лучевую терапию и 75% - консолидирующую химиотерапию.
Два исследования по III фазе показали преимущество одновременной химио-лучевой терапии, что отразилось на выживаемости. Исследование Furuze продемонстрировало улучшение непосредственной эффективности и выживаемости у больных, получавших одновременное химио-лучевое лечение (общий эффект - 84% против 66%, p=0,0002; медиана выживаемости - 16,5 мес. против 13,3 мес., p=0,03998). Кроме того, были выше показатели 5-летней выживаемости. II фаза SWOG-9504 также показала преимущество совместной химио-лучевой терапии в комбинации с консолидирующей химиотерапией. Однако, проведение одновременной химио-лучевой терапии может привести к усилению токсичности.
В некоторых исследованиях использовались “старые” (традиционные) режимы химиотерапии. Пока нет рандомизированных исследований по III фазе, в которых бы изучалась последовательность применения современных химиотерапевтических режимов. В рамках I-II фазы определены некоторые комбинации, активные при НМРЛ, которые могут назначаться неоперабельным больным III стадией. Широко изучался режим Таксол + Карбоплатин в сочетании с ЛТ, демонстрируя общий эффект 50-79% и медиану выживаемости 14-26 мес, при хорошей общей переносимости. По мнению некоторых исследователей назначение индукционной химиотерапии перед химио-лучевой терапией может ухудшать переносимость последней, что может привести к ухудшению отдалённых результатов. Целесообразность проведения консолидирующей химиотерапии после химио-лучевого лечения, остаётся в настоящее время предметом изучения.
Таким образом, сочетанная химио-лучевая терапия - стандартный метод лечения больных с неоперабельной III стадией НМРЛ, а также - для больных с любой стадией, которые не могут быть оперированы по медицинским причинам. Лечение может меняться в зависимости от индивидуальных особенностей пациента. Для ослабленных (PS ? 2) и пожилых полные дозы сочетанной химио-лучевой терапии могут оказаться токсичными. Возможно, новые менее токсичные режимы, включая расщеплённый курс лучевой терапии, могут стать приемлемыми для лечения этой категории больных. Химиотерапия НМРЛ при IV стадии (M1). Доказано, что использование системной паллиативной химиотерапии у больных с неоперабельной III B и IV стадиями НМРЛ даёт улучшение выживаемости по сравнению с оптимальной поддерживающей терапией (симптоматическим лечением).
Метаанализ показал, что применение цисплатин-содержащих режимов улучшает 1-летнюю выживаемость на 10%. Кроме того, у 65% больных, отмечено симптоматическое улучшение. Часто пациенты с распространённым опухолевым процессом имеют серьезные сопутствующие заболевания, ухудшающие их состояние, что осложняет проведение агрессивной химиотерапии. Появление в последние годы новых, более эффективных и хорошо переносимых препаратов расширяет контингент больных, подлежащих лекарственному лечению.Выбор метода лечения основывается на анализе прогностических факторов. Наиболее важными являются общее состояние больного (Performance Status - PS), возраст и потеря веса. В многочисленных исследованиях было показано, что больные в хорошем общем состоянии имеют больше шансов достичь объективного ответа на химиотерапию (лучшей выживаемости), а также меньшую вероятность развития серьезных осложнений.
По данным SWOG, 1-летняя выживаемость пациентов с PS = 0-1, составила 20%, по сравнению с 9% для пациентов с PS, соответствующим 2-4. Ретроспективный анализ 5 клинических исследований ECOG (1960 больных), также подтвердил, что PS достоверно влияет на медиану выживаемости. Следует также учитывать пол, локализацию и количество метастатических очагов, уровень гемоглобина и ЛДГ, число лейкоцитов. Что касается выбора препаратов, то в настоящее время предпочтение отдаётся платиносодержащим комбинациям, хотя в некоторых исследованиях показана сопоставимая эффективность неплатиновых и платиносодержащих режимов.
Мультицентровые рандомизированные исследования показали преимущество платиносодержащих режимов с включением новых препаратов, таких как Таксол, Таксотер, Гемзар, Навельбин, Иринотекан, по сравнению со стандартной комбинацией Этопозид + Цисплатин. Сравнение в проспективном рандомизированном исследовании 4-х наиболее часто используемых в настоящее время режимов: Цисплатин + Таксол, Гемзар + Цисплатин, Таксотер + Цисплатин, Карбоплатин + Таксол не выявило достоверных различий в эффективности и выживаемости. В другом мультицентровом рандомизированном исследовании (TAX-326) сравнивались 3 режима: Таксотер + Цисплатин, Таксотер + Карбоплатин и Навельбин + Цисплатин. Выживаемость в группе больных, получавших комбинацию Таксотер + Цисплатин, оказалась достоверно выше чем в группах, леченных Навельбином и Цисплатином. Качество жизни больных, получавших Таксотер-содержащие режимы, также оценено как более высокое.
Химиотерапию больным распространённым НМРЛ следует начинать как можно раньше. Длительность её зависит от результатов лечения и переносимости. Согласно практическим рекомендациям ASCO (1997 г.), для лечения неоперабельных больных НМРЛ не следует проводить более 8 курсов химиотерапии. Больные в хорошем состоянии, обладающие первичной резистентностью к I линии химиотерапии, могут достичь частичной регрессии при проведении II линии. Большие шансы на успешное лечение имеют пациенты, у которых отмечалось объективное улучшение и длительный период до прогрессирования. Перспективным направлением в лечении распространённого НМРЛ является изучение принципиально новых препаратов, воздействующих на молекулярные мишени (ингибиторы эпидермального фактора роста, антисенсы, ингибиторы ангиогенеза и др.).
Новые направления химиотерапии. Таргетные агенты и подходы к противоопухолевой терапии.
Применение “таргетных”, или целевых агентов кардинально меняет не только методику клинического изучения новых лекарств, но и всю стратегию химиотерапии злокачественных опухолей. «Таргетные» препараты действуют на свои собственные мишени, экспрессия которых тем или иным образом влияет на опухолевый рост. Они отличаются от классических цитотоксических препаратов не только по механизму действия, но и по токсичности. Препараты направлены на стабилизацию опухолевого процесса, на перевод его в хроническое состояние. И поэтому многие из них должны быть использованы на более ранних этапах лечения, когда ещё нет повреждения мишеней другими агентами и при более ранних стадиях болезни. Они имеют более выраженное не цитотоксическое, а цитостатическое действие, вызывая остановку опухолевого роста, приводя к стабилизации процесса. К «таргетным» препаратам относятся Антиангиогенные ЛС: ингибиторы эндотелиальной тирозинкиназы и пептидов, блокирующих VEGF - бевацизумаб (авастин), неовастат (AE-941).
Ингибиторы тирозинкиназы EGFR: ZD-1839 (Иресса) и OSI-774 (Тарцева) Ингибиторы фарнезилтрансферазы (RAS-мутации): SCH 66336 (лонафарниб); R 115777 (зарнестра). Ингибиторы рецепторов Her-2/neu: трастузумаб. Блокаторы или ингибиторы протеинкиназы С, влияющий на апоптоз: SIS 3521; UCN-01 - производное сткуроспорина; бриостатин. Ретиноиды (влияющие на апоптоз): бексаротин (LGD-1069)
В табл. представлены распространенные режимы комбинированной неоадъювантной химиотерапии, опубликованные в материалах ASCO-2002.
Таблица1. Современные режимы неоадъювантной химиотерапии при НМРЛ III стадии
Автор, число больных, режим лечения (дозы препаратов в мг/м 2 )
Оценка эффективности
Betticher D. et al. (90 б-х ст. IIIA) Таксотер 85 в 1 день Цисплатин 40-50 в 1 и 2 дни, каждые 3 недели, 3 цикла, далее - операция ( + ЛТ в случае нерадикальной операции)
ОЭ=62%, (8% ПЭ) 77 больных оперировано, радикально - 56
Морфологическое подтверждение . ПЭ в16%
Cappuzzo F. et al. (36 б-х ст. III A-B) Гемзар 1000 в 1; 8 дни. Цисплатин 50 в 1;8 дни Таксол 125 в 1;8 дни Курсы каждые 3 недели. Далее - операция.
ОЭ=72%, (2% ПЭ) 21 больной оперирован. Морфологическое подтверждение ПЭ в 8%
Esteban E. et al. (25 б-х) Цисплатин 50 в 1; 8 дни
Гемзар 1250 в 1; 8 дни. Курсы каждые 3 недели, далее - операция.
ОЭ=72%. Оперировано 6 больных.
Морфологическое подтверждение ПЭ в 16%
Esteban E. et al. (22 б-х) Цисплатин 50 в 1, 8 дни. Гемзар 1250 в 1, 8 дни
Навельбин 25 в 1, 8 дни
ОЭ=73%. Оперировано 7 больных.
Морфологическое подтверждение ПЭ в 12%
Wu Y. I. et al. (13 б-х ст. III A) Гемзар 1000 в 1; 8 дни. Цисплатин 30 в 8; 9; 10 дни. Курсы - каждые 3 недели. Далее - операция.
ОЭ=69%. Оперировано 9 больных.
Морфологическое подтверждние.ПЭ в 8%.
Примечания: Общий эффект (ОЭ) = полный эффект (ПЭ) + частичный эффект
Для больных IV стадией в удовлетворительном состоянии, основным методом лечения является системная, паллиативная химиотерапия. На сегодняшний день не существует единого стандарта среди современных равноэффективных химиотерапевтических режимов. Выбор делается с учётом функциональных резервов больного и токсического профиля препарата. Лучевая терапия играет вспомогательную роль, и используется для купирования тягостных симптомов болезни. Оптимальным для больных местно-распространённым и метастатическим НМРЛ является участие в клинических исследовательских программах, что обеспечивает использование новейших технологий диагностики и лечения. К сожалению, количество больных, включённых в клинические исследования, не превышает 1-2%. В настоящее время, одним из наиболее активно изучаемых направлений лечебной стратегии при НМРЛ является использование “таргетных” препаратов. Другая область исследовательского интереса - это создание функциональных моделей для прогнозирования ответа на лечение и индивидуализацию лечебного плана.
По материалам Вестника Московского Онкологического Общества, №1, январь 2006
Таргетная терапия немелкоклеточного рака легкого
Приведены результаты применения таргетных препаратов при лечении диссеминированного немелкоклеточного рака легкого. Показано, что у пациентов с определенными мутациями опухоли применение таргетных препаратов в комбинации с химиотерапией увеличивает общую выживаемость пациентов и время до прогрессирования.
- КЛЮЧЕВЫЕ СЛОВА: таргетная терапия, рак легкого, онкология, лечение рака легкого
C 1985 г. рак легкого (РЛ) - главный глобальный онкологический «киллер» у мужчин. По данным Международного агентства по изучению рака (МАИР), в 2008 г. в мире заболели РЛ 1 095 000 мужчин, умерли от этой болезни 951 000, таким образом, коэффициент «cмертность/заболеваемость» (с/з) составил 0,87. По мировым показателям, на рак легкого у мужчин приходится 16,5% всех вновь регистрируемых раковых опухолей и 22,5% смертельных исходов от всех злокачественных новообразований. У женщин РЛ находится на 4-м месте в глобальном списке опухолевых заболеваний (после рака молочной железы, рака толстой кишки и рака шейки матки). В 2008 г. раком легкого заболели 513 000 женщин, что составило 8,5% всех злокачественных опухолей, умерли от этой болезни 427 000 пациенток (12,8% от общей онкологической смертности), таким образом, у женщин коэффициент с/з при РЛ равен 0,83. По показателям заболеваемости РЛ развивающиеся страны «догоняют» развитые. Если в 1980 г. распределение заболевших РЛ в развитом и развивающемся мире составляло 69% и 31% соответственно, то в 2008 г. - 54% и 46% [1, 2].
В Европе в 2008 г. РЛ диагностирован у 391 000 больных (12,2% всех новообразований), из них умерли 342 000; соотношение с/з равно 0,8. Европейские стандартизованные показатели заболеваемости у мужчин - 73,2 на 100 000 населения, у женщин - 18,7 на 100 000 населения, стандартизованные показатели смертности - 63 на 100 000 и 15,7 на 100 000 соответственно. В пятерку стран с наивысшей заболеваемостью РЛ у мужчин в Европе входят Венгрия (113,7 на 100 000 населения), Польша (103,3), Эстония (93,4), Хорватия (93,4), Сербия (92,6); у женщин максимальные показатели заболеваемости - в Дании (52,8), Исландии (40,1), Венгрии (39,8), Нидерландах (36,5) и Ирландии (36,4). В странах Северной и Западной Европы заболеваемость РЛ у мужчин снижается в связи с массовым отказом от курения. Особенно это заметно в Великобритании, Финляндии и Норвегии [3]. В США в 2011 г. РЛ диагностирован у 222 000 больных (14% всех злокачественных опухолей), умерли 157 000 больных (27% от уровня смертности от онкологических заболеваний). Соотношение с/з в США составляет 072, это лучше, чем в Европе и в мире в целом. В стандартизованных показателях заболеваемость у мужчин в США составляет 89 на 100 000 населения, у женщин - 55,2 на 100 000; смертность - 73,4 и 41,4 на 100 000 соответственно. Одногодичная выживаемость в США достигает 43%, пятилетняя - 16%. Последний показатель за 35 лет увеличился всего на 4% (при раке толстой кишки за тот же период произошло его увеличение на 20%) [4, 5].
В России в 2009 г. выявлено 57 052 новых случая РЛ, это 19,8% от онкологической заболеваемости у мужчин и 3,9% у женщин; умерли 51 433 больных (27,4% от уровня смертности от онкологических заболеваний), таким образом, коэффициент с/з равен 0,9. Стандартизованные показатели заболеваемости РЛ в России (европейский стандарт) составляют 79,5 на 100 000 населения у мужчин, у женщин - 10,2 на 100 000; стандартизованные показатели смертности от РЛ (мировой стандарт) у мужчин - 50,4 на 100 000, у женщин - 5,8 на 100 000. В России рак легкого I и II стадии диагностируют в 26,5% случаев, в Азербайджане - в 31,6%, Армении - в 12,1%, Беларуси - в 35,7%, Казахстане - в 21,9%, Киргизии - в 7,4%, на Украине - в 22,1%, в США - в 53% случаев [4, 6]. Из-за различных лечебных подходов рак легкого делят на немелкоклеточный рак (НМРЛ), который встречается в 85% случаев, мелкоклеточный рак (МРЛ), встречающийся в 10% случаев, и другие гистологические варианты, регистрируемые в 5% случаев. НМРЛ дифференцируется на плоскоклеточный рак, аденокарциному и крупноклеточный рак.
Настоящая статья посвящена таргетной терапии диссеминированного НМРЛ, в ней не рассматриваются вопросы, связанные с терапией МРЛ. Все типы рака легкого происходят из мультипотентных стволовых клеток бронхиального эпителия: МРЛ возникает в центральных крупных проводящих воздух бронхах; плоскоклеточный рак в 35-45% случаев - в проксимальных сегментарных бронхах; аденокарциномы и крупноклеточный рак в 45-50% и 10% случаев соответственно возникают в периферических бронхах. По классификации ВОЗ существует несколько подтипов аденокарцином: ацинарный, папиллярный, бронхиоло-альвеолярный, муцинозый, перстневидноклеточный, светлоклеточный. Клетки железистого рака однородны, с большими ядрами, имеют высокий ядерно-плазматический индекс, цитоплазма вакуолизирована, что связано с продукцией муцина. Большинство клеток умеренно дифференцировано. Особое внимание в настоящее время уделяют бронхиоло-альвеолярному раку (БАР). В отличие от других форм аденокарцином легкого, БАР распространяется по альвеолярным перегородкам, не инвазируя легочную паренхиму. Существует два варианта опухоли - чаще встречающийся немуцинозный и более редкий продуцирующий муцин. Классическим симптомом БАР является бронхорея.
Крупноклеточный рак легкого при микроскопии не похож ни на аденокарциному, ни на плоскоклеточный рак, представлен крупными недифференцированными клетками с везикулярными ядрами и эозинофильными ядрышками с выраженной цитоплазмой с отчетливой мембраной. Клинически у больных с этим вариантом РЛ выявляется периферическая опухоль крупных размеров, метастазы возникают рано, лишь 5% пациентов выживают в течение 5 лет. Плоскоклеточный РЛ локализуется в центральной зоне легкого. В соответствии с классификацией ВОЗ различают папиллярный, светлоклеточный, мелкоклеточный и базалоидный варианты этой формы рака. Дифференцировка может быть высокой, умеренной и низкой. Плоскоклеточный рак легкого и плоскоклеточный рак других органов практически не отличаются [2, 7, 8].
В рамках традиционной (не таргетной) терапии метастатического немелкоклеточного рака легкого лекарственными схемами выбора являются платиновые дуплеты - цисплатин + один из следующих препаратов: этопозид, паклитаксел, доцетаксел, гемцитабин, винорелбин, иринотекан. Медиана выживаемости при указанных схемах варьирует при первой линии терапии от 9 до 11 мес. Монотерапия в первой линии лечения назначается редко, при ECOG 2. В большинстве исследований режимы с цисплатином более эффективны с точки зрения выживаемости пациентов, чем дуплеты с карбоплатином. Применение двухкомпонентных платиновых схем дает такие же значения медианы выживаемости, как и после платиновых триплетов, однако переносимость последних хуже. При использовании неплатиновых дуплетов одногодичная выживаемость пациентов меньше, чем на платиновых. Продолжительность лечения не должна превышать 4-5 курсов, увеличение их числа не увеличивает выживаемость и ухудшает качество жизни больных.
В крупном исследовании G.V. Scagliotti и соавт. [9], в котором участвовали 1725 больных НМРЛ, продемонстрированы статистически значимые различия в эффективности терапии в зависимости от гистологических вариантов опухолей: при применении в первой линии комбинации «пеметрексед + цисплатин» или «гемцитабин + цисплатин» первый режим дает лучшее значение медианы выживаемости при аденокарциноме, второй - при плоскоклеточном раке. Во второй линии химиотерапии НМРЛ предпочтительнее монотерапия с одним из препаратов, не применявшихся в первой линии терапии, - доцетакселом, винорелбином, гемцитабином, иринотеканом 8. Исследования в области таргетной терапии НМРЛ масштабны. Наибольшую эффективность демонстрируют ингибиторы EGFR и ангиогенеза. Несколько новых классов препаратов еще находятся в стадии активных исследований - это ингибиторы гистондиацетилазы, стрессовых белков (HSP 90), протеасом, KRAS, mTOR, инсулинового фактора роста, циклооксигеназы-2 (COX-2), ретиноидных Х-рецепторов [11]. В профиле молекулярных изменений при НМРЛ основное значение придается доминантным онкогенным нарушениям EGFR, KRAS, мутациям супрессорных генов p53, Rb, p16.
Мишенью лекарственных разработок при метастатическом НМРЛ является тирозинкиназный рецептор эпидермального фактора роста (EGFR). Он экспрессируется при НМРЛ (в 58% случаев - при плоскоклеточном раке, в 39% - при аденокарциномах и в 38% - при крупноклеточном раке) и не обнаруживается при МРЛ. EGFR вовлечен в сигнальный каскад, контролирующий процессы клеточной пролиферации, апоптоза, ангиогенеза, инвазии и метастазирования. Созданы синтетические препараты из группы хинозолинов - ингибиторы тирозинкиназ EGFR (малые молекулы для орального приема) гефитиниб и эрлотиниб. Оказалось, что частота экспрессии EGFR не является маркером предполагаемого эффекта от вышеуказанных препаратов. К молекулярным факторам, позитивно влияющим на прогноз лечения, относят мутации EGFR (замена аргинина на лейцин) в экзонах 18, 19 и 21, напротив, мутации генов KRAS, erbB2 и EGFR T790M ответственны за резистентность к тирозинкиназным ингибиторам этого фактора роста [7, 11].
В результате ряда исследований, о которых пойдет речь ниже, были установлены клинические факторы, сопровождающие мутации EGFR в 18, 19, 21-м экзонах, которые предсказывают полезность лечения гефитинибом или эрлотинибом: восточно-азиатская раса больных, аденокарциномы легкого (особенно не муцинозный бронхиоло-альвеолярный рак), женский пол, никогда не курившие, ECOG 0-1, возраст старше 65 лет, выраженная кожная сыпь во время лечения упомянутыми таргетными препаратами [12, 13]. Первые исследования гефитиниба без уточнения молекулярных и клинических показаний для назначений были по существу отрицательными. Например, в исследованиях Intact 1 и Intact 2 гефитиниб (Иресса) добавлялся к режиму «гемцитабин + карбоплатин». Суммирования эффекта и увеличения продолжительности жизни пациентов в группах, получавших дополнительно таргетный препарат, достигнуто не было. Был сделан вывод, что «Иресса не любит комбинаций с химиотерапией» [14]. Из начальных испытаний гефитиниба важным являлось установление эффекта от терапии данным препаратом у больных, резистентных к доцетакселу [14].
Эрлотиниб, так же как и гефитиниб, не увеличивал эффективность первой линии химиотерапии НМРЛ. Было проведено рандомизированное исследование с участием 1772 больных, половина из которых получала эрлотиниб, половина - плацебо. Всем пациентам одновременно вводились гемцитабин и цисплатин. Эффект терапии, время до прогрессирования и медиана выживаемости в обеих группах были одинаковы, у пациентов, получавших эрлотиниб, добавились лишь побочные эффекты [15]. После стратификации материалов по вышеуказанным молекулярным и клиническим маркерам эффекта последовали новые оптимистические заключения о ценности гефитиниба и эрлотиниба для терапии метастатического НМРЛ. L.V. Sequist и соавт. в 2007 г. показали, что гефитиниб дает эффект у больных с аденокарциномой легкого с мутациями в 19-м и 21-м экзонах EGFR в 70% случаев, у пациентов без данных мутаций - в 10% случаев [16].
В 2012 г. опубликованы результаты исследования SATURN (приняли участие 889 пациентов) по применению эрлотиниба с поддерживающей целью после химиотерапевтического лечения и достижения (в первой линии терапии) эффекта или стабилизации заболевания при диссеминированном НМРЛ; терапия эрлотинибом проводилась в сравнении с плацебо, до прогрессирования. Эрлотиниб достоверно улучшал время до прогрессирования в группах, в которых отмечен противоопухолевый эффект (ОР (отношение рисков) = 0,72) и стабилизация заболевания (ОР = 0,68), а также общую выживаемость в этой же группе (ОР = 0,72) [24]. Применение при НМРЛ моноклональных анти-EGFR-антител цетуксимаба и панитумумаба пока дает скромные результаты. В двух рандомизированных исследованиях III фазы цетуксимаб добавлялся либо к режиму «цисплатин + винорелбин», либо «карбоплатин + таксаны». В первом крупном исследовании (n = 1125) разница в общей выживаемости скромна, но достоверна - 11,3 и 10,1 мес. соответственно (p = 0,044) [25]. Результаты второго исследования (n = 676) отрицательные, время до прогрессирования в группе, получавшей исключительно химиотерапевтическое лечение, и у больных, дополнительно получавших цетуксимаб, не различалось - 4,2 и 4,4 мес. соответственно (p = 0,236) [26]. В ряде исследований замечена позитивная корреляция между эффектом терапии и выраженностью кожной сыпи после лечения моноклональными антителами или малыми молекулами - тирозинкиназными ингибиторами анти-EGFR [27].
В разных странах включены в арсенал терапевтического лечения НМРЛ гефитиниб, эрлотиниб, кризотиниб, бевацизумаб. Первые два препарата являются ингибиторами тирозинкиназных доменов EGFR. Обнаружены молекулярные предикторы эффекта этих препаратов - мутации рецепторов эпидермального фактора роста в 19-м и 21-м доменах. Эти мутации встречаются у 10-12% европейских и североамериканских больных с аденокарциномой легкого и у 20- 59% больных с подобной опухолью легкого у лиц восточно-азиатской расы. Клиническими маркерами эффекта являются также женский пол, отсутствие курения, кожная сыпь в результате лечения. При лечении ингибиторами тирозинкиназных доменов EGFR медиана времени до прогрессирования у этой категории больных в 2-3 раза больше, чем при применении режимов «паклитаксел + карбоплатин», «доцетаксел + цисплатин», «гемцитабин + цисплатин» и «гемцитабин + карбоплатин» в первой линии терапии. Схемы «бевацизумаб + дуплеты цисплатина» повышают общую выживаемость преимущественно у мужчин с диссеминированным плоскоклеточным раком легкого более чем на 2,5 мес. по сравнению с применением исключительно химиотерапии. Несомненно, будущие открытия в области изучения генома рака легкого приведут к большей индивидуализации терапии, основанной на понимании механизмов канцерогенеза, расшифровке ключевых мутаций и идентификации новых молекулярных мишеней.
Читайте также:
