Врожденный иммунитет носа и его полостей
Обновлено: 19.04.2024
Наш нос устроен достаточно сложно. Вокруг носовой полости расположено несколько пазух (синусов). Они заполнены воздухом и связаны с полостью носа через специальные отверстия. Поверхность пазух выстлана слизистой оболочкой, которая может воспаляться.
Инфекционное воспаление в одном или обоих синусах бывает острым и хроническим и называется гайморитом. Однако подобное заболевание может развиваться не у всех детей. До 4-5 лет гайморовы пазухи у ребёнка еще не сформированы. С этого возраста и до 11-12 лет начинается активное формирование синусов над верхней челюстью, их увеличение в размерах. Гайморит может возникнуть как уже в сформированных пазухах у детей старше 11 лет, так и в период их формирования, то есть после 5 лет. На фоне перенесенной ОРВИ болезнь развивается у 6-9% детей до 18 лет 3 .
Почему развивается гайморит у ребёнка?
Причиной гайморита чаще всего является бактериальный возбудитель стрептококковой или стафилококковой природы 1 . В большинстве случаев болезнь возникает как осложнение ОРВИ, ринита, отита и других проблем в ближайших ЛОР-органах.
Факторы риска для развития инфекции в детском возрасте:
- снижение иммунитета, частые простуды;
- хронические заболевания, ослабляющие организм;
- разрастание аденоидных вегетаций и их воспаление;
- склонность к аллергическим процессам в носоглотке;
- полипы в носовой полости и окружающих пазухах;
- врождённые и приобретённые искривления носовой перегородки;
- отсутствие своевременного и правильного лечения болезней дыхательной системы, кариеса, инфекций уха и гланд 2 .
Лечение гайморита должно начинаться немедленно, в противном случае высок риск развития осложнений.
Проявления заболевания и формы
Опасность гайморита в детском возрасте заключается в том, что на фоне ОРВИ с симптомами ринита болезнь 1-2 недели протекает без классических признаков 3 . За это время острый гайморит может перерасти в хронический, который тяжело лечить. Заподозрить болезнь позволят следующие признаки:
- длительность ОРВИ более недели с повторным повышением температуры через 5-7 дней;
- сильная заложенность носа, затруднение носового дыхания;
- обильные выделения из носа зеленоватого цвета с неприятным запахом;
- боли при надавливании на переносицу и в области расположения пазух (область под глазами ближе к носу);
- постоянные головные боли, больше в области лба;
- снижение или полная потеря обоняния 3 .
Среди симптомов гайморита могут преобладать те или иные признаки в зависимости от формы болезни. Различают следующие виды гайморита:
- Экссудативный. Чаще вызывается вирусами, для него характерны обильные выделения из носа, но без гноя.
- Гнойный. Характеризуется обильными гнойными выделениями, которые имеют склонность быстро засыхать, образовывать корочки, которые могут блокировать носовые ходы и препятствовать полноценному дыханию.
- Продуктивный. Слизистая может истончаться или чрезмерно разрастаться в зависимости от формы заболевания. Также возникают полипы, некрозы (отмирание участков слизистой). Чаще встречается при хронической инфекции 2 .
Также гайморит может быть односторонним или двусторонним, острым или хроническим.
Осложнения гайморита у детей
Отсутствие своевременной лекарственной терапии может привести к развитию серьёзных осложнений. К ним относятся:
- воспаление уха;
- конъюнктивит и гнойные поражения глаза;
- поражение соседних пазух носа;
- воспаление костной оболочки в пазухе с формированием флюса (воспаления покрывающей кость оболочки – надкостницы);
- менингит (воспаление мозговых оболочек);
- возникновение аутоиммунных реакций с поражением почек, сердца, суставов;
- общее ослабление иммунитета с высоким риском развития частых простуд, ангин, ринитов 4 .
Самым распространенным осложнением является формирование хронического воспаления в гайморовой пазухе. При этом дети постоянно страдают от насморка и головных болей.
- сосудосуживающие капли в нос строго по инструкции;
- противовоспалительные препараты;
- местные активаторы иммунитета для защиты слизистой оболочки носа и предотвращения увеличения количества возбудителей 3 .
При неэффективности консервативного лечения ребёнку нужно проводить хирургическое вмешательство (прокалывание пазух). Гайморит – серьезная проблема, до возникновения которой лучше не доводить. Для этого нужно своевременно лечить ОРВИ и грипп у ребёнка, уделять внимание местной защите дыхательных путей.
С целью активации иммунитета слизистой носа может применяться ИРС®19. Препарат помогает снижать риск развития осложнений при ОРВИ и гриппе, в том числе и вероятность воспаления гайморовых пазух 5 .
ИРС ® 19 в профилактике гайморита
Профилактика гайморита у детей в домашних условиях заключается в правильном и своевременном лечении ОРВИ и других инфекций дыхательных путей. При этом стоит уделять внимание и местной иммунной защите слизистых оболочек, которая сразу при попадании вирусов и бактерий на слизистую будет их нейтрализовать. Активировать ее может помочь препарат ИРС®19. Этот назальный спрей содержит 18 лизатов бактерий (фрагментов разрушенных бактерий), которые начинают действовать сразу после попадания на слизистую 5,6 , запуская каскад защитных факторов, и тем самым помогают активировать местный иммунитет 5 . При распылении ИРС®19 образуется мелкодисперсный аэрозоль, который покрывает слизистую оболочку носа, что приводит к быстрому развитию местного иммунного ответа 5 . ИРС®19 разрешён детям с трех месяцев 6 .
Врожденный иммунитет носа и его полостей
Приобретенный иммунитет человека представляет собой механизм антиген-специфичного ответа на определенный чужеродный агент. Основными компонентами приобретенного иммунитета являются Т- и В-лимфоциты, а также семейство иммуноглобулинов. В-клетки происходят из красного костного мозга и несут на своей поверхности IgM и Ig D. Покинув костный мозг, они мигрируют во вторичные лимфоидные органы и пролиферируют в ответ на антигенную стимуляцию и взаимодействие с Т-клетками.
При стимуляции В-клетки превращаются в секретирующие иммуноглобулин клетки, специфические для антигена. Далее эти плазмоциты созревают и переключаются на синтез других иммуноглобулинов, таких как IgA, IgE и IgG, у каждого из которых есть своя специфическая роль в иммунитете. Из всех классов иммуноглобулинов особого внимания заслуживают IgA и IgE, имеющие большое значение в местном иммунитете полости носа и околоносовых пазух.
IgА является наиболее распространенным иммуноглобулином полости носа. Он существует в форме мономера и димера, в полости носа он по большей части представлен в форме секретирующего димера (SIgA). SIgA представляет собой 390-kDa димер, связанный J-цепью и содержащий секреторный компонент, отвечающий за активный транспорт через эпителий полости носа.
SIgA, находящийся в слизи, связывает бактерии и другой антигенный материал, предотвращая его проникновение в слизистую.
Важность IgA в борьбе против внешнего вторжения демонстрируют случаи его отсутствия. Селективный дефицит IgA является наиболее распространенным изолированным дефицитом иммуноглобулинов, частота встречаемости в США варьирует от 1:223 человека до 1:1000. У этих пациентов В-клетки не способны дифференцироваться в секретирующие IgA плазмоциты, часто у них наблюдается компенсаторный повышенный уровень IgМ. Клиническая картина вариабельна, от отсутствия каких-либо симптомов до рецидивирующих инфекций околоносовых пазух, легких и желудочно-кишечного тракта.
Инфекция пазух в основном бактериальной природы. Аллергические и аутоиммунные расстройства также встречаются чаще в этой популяции пациентов. Лечение пациентов с изолированной недостаточностью IgA включает лечение острых бактериальных инфекций или профилактический ежедневный прием антибиотиков, в зависимости от тяжести симптомов.
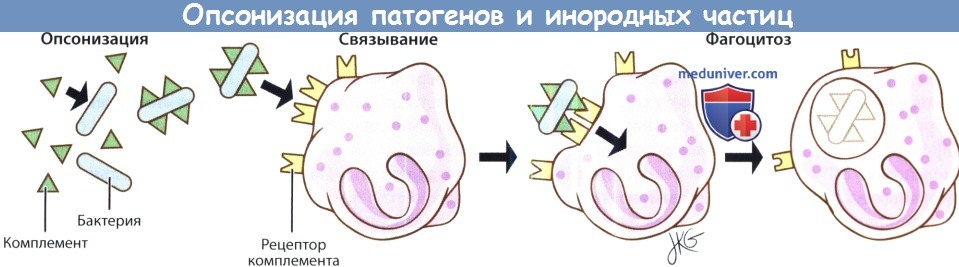
Опсонизация патогенов и инородных частиц делает более эффективным связывание и фагоцитоз.
Вторым иммуноглобулином, играющим основную роль в иммунитете полости носа, является Ig Е. Он является основным иммуноглобулином, отвечающим за аллергический иммунный ответ, а также играет роль в патогенезе аллергического ринита. Хот я IgE-продуцирующие плазмоциты не являются нормальным компонентом слизистой носа, у пациентов с аллергическим ринитом повышен уровень аллерген-специфического IgE в тканях нижних носовых раковин. Это является доказательством того, что проникающий в слизистую пациентов с аллергией IgE синтезируется на месте, а не мигрирует из отдаленных источников.
Несколько исследований показали возможность смены класса иммуноглобулинов в тканях полости носа, исследования ex vivo продемонстрировали вызванную аллергеном смену класса в тканях носовых раковин. Исследователи также показали повышение уровня антиген-специфического IgE у пациентов с ринитом, имеющих отрицательные результаты тестирования на аллергены. На основании отрицательных системных тестов было высказано предположение, что местный аллергический ответ может быть инициирующим фактором у пациентов с предшествующим диагнозом неаллергического ринита. Дальнейшие исследования в данном направлении могут помочь в понимании патогенеза и принципов лечения заболевания этой категории пациентов.
Т-клетки представляют второй класс клеток, участвующих в приобретенном иммунитете. Они происходят из тимуса, где созревают и подвергаются дифференцировке. Аутореактивные клетки подвергаются апоптозу перед миграцией из тимуса. После выхода из тимуса они привлекаются клеточными сигналами лимфоидных органов. При встрече с антигеном Т-клетки активируются, а затем образуют множество клонов со специфичностью к данному антигену.
Далее Т-клетки дифференцируются на два основных типа: Т-хелперы, несущие CD4, и Т-цитотоксические, несущие CD8. Далее Т-хелперы подразделяются на ТЫ и Th2, отличающиеся профилем цитокинов и выполняемыми функциями. Th1-клетки продуцируют ИЛ-2 и интерферон-у, которые ответственны за цитотоксические воспалительные реакции в ответ на внутриклеточные патогены. Они участвуют в реакции гиперчувствительности замедленного типа, выполняют свои функции посредством клеточно-опосредованного взаимодействия и передают информацию посредством цитокинов.
Th2-клетки продуцируют ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-10, отвечают за IgE-опосредованные аллергические реакции и продукцию эозинофилов. Цитокины одного клеточного типа подавляют активацию цитокинов другого клеточного типа, предотвращая таким образом активацию конфликтующих воспалительных реакций.
В зависимости от активации Тh1 - или Th2-опосредованных воспалительных процессов в полости носа развиваются различные патологические состояния. При хроническом полипозном риносинусите преобладают Th2-клетки и Th2-ассоциированные цитокины, ИЛ-4 и ИЛ-5. С другой стороны, хронический неполипозный синусит опосредован преимущественно ТЫ воспалением. Активация Th2-хелперов приводит к резкому увеличению количества эозинофилов, составляющих от 60% до 90% клеточного состава полипозной ткани. Воспалительные продукты эозинофилов способы вызывать локальное повреждение тканей, наблюдаемое при хроническом полипозном процессе.
Доминирование Th2-хелперов и эозинофильных реакций также объясняет связь полипоза с астмой и аллергией, также вызываемыми Th2.

Семейство Т-лимфоцитов и пути дифференцировки Th1-хелперов и Th2-хелперов.
Ключевые моменты:
• Местный иммунитет полости носа основан как на врожденных, так и на приобретенных механизмах.
• Как избыточный, так и недостаточный иммунный ответ может приводить к развитию заболеваний.
• При помощи мукоцилиарного клиренса патогены и инородные частицы перемещаются в сторону носоглотки.
• Механизмы врожденного иммунитета могут быть как неспецифичными, так и антиген-специфичными.
• В процессе опсонизации происходит аттракция и активация клеток, регулирующих воспалительный процесс.
• Химические мессенджеры способны повышать экспрессию генов, помогающих организму бороться с патогенами.
• Дифференцировка В-лимфоцитов и продукция IgE может происходить на местном уровне.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гистология эпителия полости носа
Занимая ключевую позицию в начале дыхательных путей, полость носа постоянно обрабатывает раздражители из окружающей среды. К ним относятся как отдельные частицы, такие как микробы, молекулы химических веществ, чужеродные белки, так и факторы, связанные с такими свойствами вдыхаемого воздуха как температура и влажность.
Именно здесь определяется, представляет ли раздражитель опасность для организма и при необходимости запускается процесс нейтрализации. Для выполнения этой задачи в полости носа функционируют сложно устроенные системы врожденного и приобретенного иммунитета. Врожденный иммунитет является первой линией защиты, в которую входят как специфические, так и неспецифические механизмы.
Приобретенный иммунитет обладает свойствами специфичности и памяти, которые реализуются посредством клональной пролиферации Т- и В-лимфоцитов. Любые нарушения в функционировании этих систем, как слишком сильный, так и слишком слабый ответ, могут вызывать нарушения в дыхательной системе и приводить к развитию различных заболеваний.

Микрофотография респираторного эпителия полости носа. b, базальная клетка;
с, реснитчатая клетка; д, бокаловидная клетка; Ip, собственный слой; m, слизистая железа.
Преддверие полости носа выстлано плоским ороговевающим эпителием продолжающим кожу лица. На уровне входа в полость носа плоский эпителий трансформируется в кубический или цилиндрический, прежде чем перейти в респираторный эпителий, выстилающий всю оставшуюся площадь полости носа и околоносовых пазух. Респираторный эпителий представляет собой многорядный цилиндрический мерцательный эпителий, который состоит из трех основных видов клеток: реснитчатых, бокаловидных и базальных.
Преобладающим видом клеток на поверхностном эпителии являются реснитчатые. Каждая ресничка имеет девять пар микротрубочек, расположенных в конфигурации, аналогичной всему реснитчатому эпителию организма: наружные микротрубочки соединены между собой деиновыми ручками. Каждая реснитчатая клетка содержит около 200 ресничек, которые бьются с частотой 10-20 ударов в секунду, обеспечивая работу мукоцилиарного клиренса. Бокаловидные клетки покоятся на базальной мембране, они синтезируют слизь и выделяют ее через свою апикальную поверхность.
Базальные клетки также находятся на базальной мембране, из них в дальнейшем синтезируются реснитчатые и бокаловидные клетки.
Также в полости носа находится меланоциты и интраэпителиальные лимфоциты, рассеянные плазматические клетки, тучные клетки, эозинофилы. Популяция интраэпителиальных лимфоцитов состоит исключительно из Т-лимфоцитов, В-лимфоцитов мало, или они отсутствуют вовсе. Это, вероятно, объясняет тот факт, что большинство лимфом полости носа являются NK/Т-клеточными лимфомами. Лимфомы околоносовых пазух, напротив, чаще являются В-клеточными.
Поперечный срез реснички, демонстрирующий распределение ресничек и связывающих белков. Мукоцилиарный клиренс перемещает захваченные частицы в сторону носоглотки.
Основной особенностью врожденного иммунитета полости носа является защита респираторного эпителия и мукоцилиарный клиренс. Слизь, преимущественно состоящая из высокомолекулярных, высокогликозилированных макромолекул, расположена над слоем серозной жидкости, продуцируемой собственным слоем слизистой.
Вязкий слизистый слой захватывает вдыхаемые частицы, в то время как жидкий серозный слой позволяет ресничкам свободно биться, продвигая слизь вместе с захваченными частицами по направлению к носоглотке, предотвращая, таким образом, повреждение дыхательных путей. Эффективность этого механизма зависит от физических свойств слизи и частоты биения ресничек.
Повреждение микроструктуры ресничек, дефекты в их деиновых ручках, приводит к развитию такого заболевания как первичная цилиарная дискинезия. В результате происходит нарушение работы мукоцилиарного клиренса. Из-за стаза слизи пациенты с таким состоянием страдают от рецидивирующих синуситов, бронхитов и бронхэктазов, в неонатальном периоде часто отмечается респираторный дистресс-синдром.
В раннем детстве они страдают от кашля и эпизодов ринита, рецидивирующих риносинуситов, средних отитов, бронхитов, пневмонии. Триада из рецидивирующих синуситов, бронхэктазов и зеркального расположения органов известна под названием синдрома Картагенера. Диагноз первичной цилиарной дискенезии возможно поставить с помощью браш-биопсии слизистой полости носа с последующим ультраструктурным анализом.
Также в опознавании частиц на слизистой участвуют поверхностные рецепторы макрофагов и дендритных клеток, которые поглощают захваченные частицы. Совместно с этой функцией идет процесс опсонизации, при котором на поверхности чужеродных молекул адсорбируются антитела и факторы комплемента. Во время опсонизации также происходит миграция и активация других клеток воспаления, локализованных в собственном слое: лимфоцитов, нейтрофилов, эозинофилов, базофилов, тучных клеток и плазматических клеток. И хотя этот процесс по большей части неспецифичен, структура некоторых опсонинов допускает возможность некоторой специфичности. Сывороточный амилоид А, опсонин, секретируемый респираторным эпителием и способный связываться с грамположительными бактериями, а также поверхностные протеины SP-A и SP-D способны связывать и агглютинировать бактерии, грибы, аллергены и неорганические частицы.

Мукоцилиарный клиренс перемещает захваченные частицы в сторону носоглотки.
Клетки респираторного эпителия секретируют небольшие внеклеточные пептиды, такие как -дефензин, а также более крупные белки, например, кателицидин, лизоцим, лактоферрин, способные подавлять рост микроорганизмов, обладают быстрой бактерицидной активностью или даже иммуномодулирующей активностью. Действие лизоцима, фермента, секретируемого также моноцитами и макрофагами, направлено на разрушение пептидогликанов клеточной стенки микроорганизмов родов Streptococcus и Pseudomonas. Уничтожение грамотрицательных микроорганизмов лизоцимом возможно только при присутствии дополнительных веществ, таких как аскорбиновая кислота, комплексов комплемент-антитело и лактоферрина, железосвязывающего белка, обнаруживаемого в гранулах нейтрофилов. Белок псориазин повышает проницаемость клеточной стенки таких бактерий, как Escherichia coli. Белок кальпротектин обладает как противомикробной, так и противогрибковой активностью.
Человеческий организм постоянно подвергается воздействию вирусов, для которых дыхательные пути являются одной из основных мишеней. Первой линией защиты являются фильтрация воздуха полостью носа, слизистый барьер, а также секреция иммуностимулирующих цитокинов и хемокинов эпителиальными клетками, макрофагами и нейтрофилами. Наиболее важными из этих химических передатчиков являются а-интерферон и -интерферон, которые повышают экспрессию генов, отвечающих за защиту клетки от репликации вирусов. В настоящее время усилия сосредоточены на разработке фармакологических агентов, способных активировать эти генетические процессы, вызывая быстрый и неспецифичный ответ на вирусную реакцию, что было бы особенно полезно во время эпидемий, когда вакцины оказываются неэффективными.
Защита полости носа от паразитов происходит в первую очередь за счет белков комплемента, отвечающих за опсонизацию, хемоаттракцию, клеточную активацию и прямое уничтожение паразитов. Другими белками, выполняющими схожие функции, являются коллектины и петраксины (С-реактивный белок и сывороточная амилаза), который могут или секретироваться, или находиться на поверхности клеточной мембраны.
Еще одной линией защиты является семейство хитиназы, в особенности кислой хитиназы млекопитающих (АМСаза), которые относятся к классу генов, регулируемых интерлейкином-13 (ИЛ-13), важным Th2-цитокином. Эти вещества действуют на хитин, в избытке содержащийся в паразитах, нематодах, насекомых и грибах. Есть теории, предполагающие, что аллергические болезни, большую роль в которых также играет Th2 ответ, являются видом избыточной реакции возникшей в процессе эволюции способности защищаться от распространенных ранее повсеместно агрессоров. Современные данные показывают, что избыточная экспрессия АМСаз связана со стойким хроническим риносинуситом.
Еще одним белком, способным вызывать проблемы в случае избыточной реакции, является фактор активации В-клеток (BAFF), член семейства факторов некроза опухоли (ФНО). BAFF продуцируется эпителиальными и подслизистыми клетками полости носа и околоносовых пазух, он регулирует выживание, пролиферацию В-клеток и продукцию антител. Есть доказательства того, что у пациентов с хроническим полипозным риносинуситом повышена секреция BAFF, который повышает секрецию иммуноглобулина А и вызывает эозинофильное воспаление. Другими цитокинами, регулирующими В-клеточный ответ у пациентов с полипозом, являются хемокин-1 привлекающий В-клетки (ВСА-1) и стромальный клеточный фактор-la (SDF-1a).
Толл-подобные рецепторы — особый класс клеточных рецепторов, которые могут содержаться в растворенной, трансмембранной или цитозольной формах на макрофагах, дендритных клетках и эпителиальных клетках дыхательных путей. Эти древние по происхождению рецепторы способны распознавать патоген-ассоциированные молекулярные паттерны (PAMPs), такие как бактериальные липопептиды, эндотоксины, флагеллины, днРНК (двухнитевые PFIK), бактериальные ДНК.
По неизвестным причинам толл-подобные рецепторы способны не реагировать на нормальную бактериальную флору, но будучи активированными патогенами, инициировать как врожденные, так и адаптивные реакции. TLR9, один из 11 известных толл-подобных рецепторов млекопитающих, был изучен за его способность стимулировать ТЫ иммунный ответ, в то же время подавляя Th2 ответ. Изучается возможность использования CpG, последовательности ДНК бактерий и агониста TLR9, в качестве дополнения к вакцинам против гепатита и рака, а также в качестве иммуностимулятора для лечения аллергии, астмы и хронического риносинусита.
Мукозальный иммунитет верхних дыхательных путей и ротоглотки

Наряду с кожей и желудочно-кишечным трактом дыхательные пути представляют собой большую поверхность, которая активно взаимодействует с окружающей средой. Иммунные механизмы, защищающие слизистые оболочки от инфекционных агентов, объединены термином «мукозальный иммунитет».
Мукозальный иммунитет верхних дыхательных путей и ротоглотки включает в себя врожденные и адаптивные звенья. Наряду с кожей и желудочно-кишечным трактом дыхательные пути представляют собой большую поверхность, которая активно взаимодействует с окружающей средой. Площадь дыхательных путей человека составляет 500 м 2 , что соответствует размеру теннисного корта 3 .
Большой объем воздуха, постоянно проходящего через респираторный тракт, определяет огромное число аэрогенных контактов с потенциально патогенными микроорганизмами. При этом носовые ходы, носоглотка и ротоглотка выполняют фильтрующую роль, задерживая на своей поверхности большую часть бактерий, вирусов и грибов. Слизистые оболочки этих биотопов являются одновременно и входными воротами, и первым барьером на пути большинства патогенов человека.
Исход контакта с микробами (либо нейтрализация инфекционных агентов на самых ранних этапах их внедрения, либо инаппаратная колонизация слизистых оболочек, либо манифестное заболевание), определяется эффективностью и адекватностью противоинфекционного иммунитета.
Иммунные механизмы, защищающие слизистые оболочки от инфекционных агентов, объединены термином «мукозальный иммунитет 4 ».
Мукозальный иммунитет верхних дыхательных путей и ротоглотки включает в себя врожденные и адаптивные звенья.
Врожденный иммунитет – раньше его называли «естественной (или неспецифической) резистентностью» – это совокупность защитных механизмов, реализация которых не зависит от предшествующей встречи с чужеродным агентом и определяется только генотипом макроорганизма.
Врожденные иммунные механизмы в верхних дыхательных путях и ротоглотке включают пассивные и активные механизмы.
Усиливая звенья местного иммунитета (главным образом, за счет активации выработки интерферона и секреторного иммуноглобулина А), можно существенно снизить вероятность развития инфекционно-воспалительного заболевания. Именно на активацию иммунитета верхних дыхательных путей направлены топические иммуномодуляторы ИРС®19 и Имудон®, фармакологические эффекты которых осуществляются в слизистых носо- и ротоглотки. В том числе речь идет и о финальном этапе иммунологической защиты – выработке специфических антител 1 .
К ключевым пассивным врожденным механизмам относят:
- целостность эпителия, обеспечиваемая плотными и эластичными контактами между эпителиоцитами и своевременной репарацией поврежденных клеток;
- образование слизи, покрывающей эпителиальные поверхности;
- мукоцилиарный клиренс (только в дыхательных путях), т.е. удаление из респираторного тракта патогенов, попавших в слизь, за счет ритмичной работы ресничек мерцательного эпителия;
- проглатывание патогенов, после чего большинство из них погибает от агрессивных факторов желудка и двенадцатиперстной кишки;
- спонтанную продукцию защитных молекул (например, лизоцима и некоторых других антимикробных пептидов) эпителиальными клетками и подслизистыми железами.
К активным (т.е. индуцированным контактом с патогеном) врожденным механизмам относятся:
- активация выработки антибактериальных (например, индуцируемых антимикробных пептидов) и противовирусных (например, интерферонов I и III типов) молекул – эпителиоцитами, дендритными клетками, нейтрофилами и некоторыми другими клетками слизистой оболочки;
- активация секреции желез;
- привлечение в дыхательные пути и активация фагоцитирующих клеток;
- экссудация в очаге инфекции жидкой части крови с содержащимися в ней антимикробными факторами, в том числе компонентами комплемента.
Часто звенья врожденного иммунитета не способны сдержать микробную атаку, и тогда на помощь приходят адаптивные иммунные механизмы.
Адаптивный (или приобретенный) иммунитет – антиген-специфические иммунные реакции, развивающиеся в ответ на появление конкретных патогенов и направленные на удаление этих патогенов и формирование иммунной памяти.
Адаптивные иммунные реакции опосредуются В- и Т-лимфоцитами.
В-лимфоциты являются клетками-эффекторами гуморального (антительного) иммунного ответа. В-лимфоциты активируются, получив антигенную информацию от антигенпрезентирующих (дендритных) клеток и дополнительные сигналы от CD4+-Т-клеток-помощников (Т-хелперов 2 типа) в лимфатических узлах, дренирующие очаг инфекции. После этого активированные антигеном В-лимфоциты покидают лимфоузлы и мигрируют либо в костный мозг, либо в слизистые оболочки респираторного тракта, где превращаются в плазматические клетки, вырабатывающие антитела. В защите верхних дыхательных путей и ротоглотки принимают участие как системно циркулирующие антитела (иммуноглобулины M, G, мономерные иммуноглобулины A) костномозгового происхождения, так и локально вырабатываемые в слизистых оболочках секреторные антитела, в первую очередь секреторные (димерные) иммуноглобулины А 2 .
CD8+-Т-лимфоциты (цитотоксические Т-лимфоциты, или Т-киллеры) являются эффекторами клеточного иммунного ответа. Антиген-зависимая активация этих клеток происходит в дренирующих лимфоузлах при участии антигенпрезентирующих клеток и CD4+-Т-клеток-помощников (Т-хелперов 1 типа). Цитотоксические Т-лимфоциты распознают пораженные вирусом клетки по наличию на их поверхности вирусных антигенов вместе с молекулами главного комплекса гистосовместимости I класса, что получило название «двойного распознавания». После такого распознавания Т-клетки уничтожают инфицированные клетки.
Внесение топических бактериальных лизатов непосредственно во входные ворота инфекции – либо в носовые ходы и носоглотку (ИРС®19), либо в полость рта и ротоглотку (Имудон®) – представляет собой рациональную стратегию комплексного лечения и профилактики инфекционных заболеваний этих локализаций. Вызванная курсовым приемом топических бактериальных лизатов стимуляция иммунитета верхних дыхательных путей и ротоглотки воспроизводит и/или восстанавливает закрепленные эволюцией локальные и системные механизмы защиты организма от вторгающихся патогенов. В частности, Имудон® и ИРС®19 повышают концентрацию лизоцима и интерферонов I типа в слюне и назальном секрете соответственно. Кроме того, ИРС®19 и Имудон® способствует выработке sIgA, стимулируют систему комплемента, а также поглотительную и переваривающую активность нейтрофилов 1 .
Компоненты бактериальных клеток, входящие в состав Имудон® и ИРС®19, являются естественными триггерами врожденных (индукция интерферонов и лизоцима, активация фагоцитоза и системы комплемента) и адаптивных (индукция антител, стимуляция Т-клеточного иммунитета) звеньев мукозального иммунного ответа в дыхательных путях 1 .
Подробнее
Материал разработан при поддержке компании Abbott в целях повышения осведомлённости пациентов о состоянии здоровья. информация в материале не заменяет консультацию специалиста здравоохранения. Обратитесь к лечащему врачу.
Читайте также:
- Влияние бактерий кишечника на ее воспалительную реакцию
- Регуляция сердечного выброса по кислороду. Влияние венозного притока на сократимость миокарда
- Наследственный овалоцитоз (врожденный эллиптоцитоз): клиника, диагностика, лечение
- Инвагинация толстой кишки - диагностика
- Гиперэкстензионно-флексорная травма - хлыстовая травма. Спастичность при повреждении спинного мозга.
