МРТ зоны фокального перифизарного отека бедренной кости
Обновлено: 22.04.2024
В качестве стандартных методов обследования при острой травме коленного сустава чаще всего используются клинические и рентгенологические методы. При первичном обследовании поврежденного коленного сустава врач травматолог-ортопед часто пренебрегает использованием такого современного неинвазивного метода диагностики, как магнитно-резонансная томография (МРТ). Поэтому ошибки в диагностике патологии коленного сустава в острой стадии, по мнению многих авторов, достигают 30% [1—3]. Несмотря на то что МРТ-диагностика с успехом используется в медицине начиная с 1990-х годов, в нашей стране только в последнее десятилетие произошел бурный рост активности использования современных МР-томографов с высоким разрешением изображения, увеличилось их количество [4]. Однако стоимость МРТ-исследования с каждым годом растет, что замедляет распространение и использование этого метода диагностики острых травм, в частности, коленного сустава. МР-томографы с напряжением магнитного поля от 1,5 Tesla и более позволяют с 95—98% точностью определять повреждения связочно-капсульных структур, менисков, хряща и костной ткани коленного сустава [5]. Наше внимание привлекли контузионные изменения мыщелков бедренной и большеберцовой костей и их влияние на клиническую картину повреждения передней крестообразной связки (ПКС) коленного сустава. В тактике общего лечения острой травмы коленного сустава мы стали учитывать обнаруженные при МРТ контузионные изменения костных структур, образующих коленный сустав. В момент травмы коленного сустава наиболее часто контузии подвергаются наружные мыщелки бедренной и большеберцовой костей, что на МРТ выглядит в виде сигнала низкой интенсивности в режиме Т1 и сигнала высокой интенсивности в режиме Т2 [6, 7].
Материал и методы
В период 2003—2006 гг. на базе ГМЦ № 1 Минздрава России, НМХЦ им. Н.И. Пирогова в отделении ортопедии был прооперирован 221 пациент (67 (30,4%) женщин и 154 (69,6%) мужчины) с острым повреждением ПКС и хронической нестабильностью коленного сустава. Возраст пациентов колебался от 15 до 57 лет (средний возраст составил 29,3 года).
Из общего числа пациентов острая травма коленного сустава отмечена у 86 (40,7%) пациентов, хроническая и рецидивная нестабильность коленного сустава — у 125 (59,3%) пациентов. Механизм травмы коленного сустава был связан со сгибанием, ротацией, вальгусным и варусным отведением. Клиническое и специальное обследование пациентов проводилось по стандартным методикам. При этом мы ввели МРТ-диагностику в стандартное обследование.
Все пациенты как с хронической патологией коленного сустава, так и с острой его травмой были обследованы с помощью МРТ-диагностики, что резко повысило качество дооперационной диагностики внутрисуставных повреждений коленного сустава. МРТ-диагностику выполняли на томографах 3—4-го поколения, с напряжением магнитного поля свыше 1,5 Tesla, разрешающая способность которых позволяла визуализировать повреждения связочных структур, менисков, суставного хряща, костной ткани коленного сустава (рис. 1 и 2).

Рис. 1. Острое повреждение ПКС коленного сустава. Стрелки указывают на зоны повреждения ПКС.
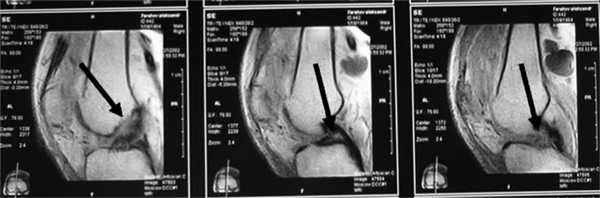
Рис. 2. МРТ старого повреждения ПКС коленного сустава. Стрелки указывают на зоны повреждения ПКС.
При МРТ-исследовании у 86 пациентов с острой травмой коленного сустава мы обнаружили в 39 (43%) случаях не только мягкотканные повреждения связочного аппарата, менисков, хряща, но и участки с контузией губчатой части мыщелков бедра и большеберцовой кости разной степени выраженности. Без применения МРТ такие травматические изменения (контузия) губчатой кости ранее вообще не диагностировались никакими другими методами. Мы обратили внимание на то, что все эти пациенты в отличие от остальных пациентов с острой травмой коленного сустава жаловались на выраженный болевой синдром и имели длительный период сгибательно-разгибательной контрактуры коленного сустава. В таких случаях мы откладывали оперативное лечение до стихания острого периода и болевых ощущений (рис. 3).
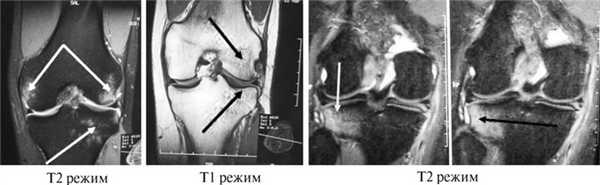
Рис. 3. МРТ-изображение коленного сустава в Т1- и Т2-режимах с участками острых контузионных изменений в мыщелках бедренной кости и наружном мыщелке большеберцовой кости (указано стрелками).
С помощью МРТ-контроля мы обнаружили, что внутрикостные кровоизлияния в мыщелках бедра и большеберцовой кости регрессировали примерно через 2—4 мес после травмы при условии целенаправленного медикаментозного и физиотерапевтического лечения именно этих контузионных явлений. По мере того как, по данным МРТ, костная ткань становилась нормальной, уменьшались болевой синдром и болевая защитная контрактура коленного сустава, возникала более благоприятная ситуация для дальнейшего оперативного лечения. И только на этом этапе всем 39 пациентам была проведена реконструкция ПКС из аутотканей по стандартным артроскопическим методикам.
Результаты
Дооперационное выполнение МРТ-диагностики всем без исключения 211 пациентам с патологией коленного сустава позволило повысить уровень диагностики острой травмы коленного сустава до 76,6%, а в хронической стадии этот процент был доведен до 100. Таким образом, в клинике нам удалось повысить качество дооперационной диагностики острого повреждения ПКС коленного сустава.
Кроме того, после операции, помимо клинического обследования, мы выполняли МРТ для еще большей объективизации результатов аутопластики ПКС коленного сустава. Контрольная МРТ проводилась через год после аутопластики ПКС (рис. 4).

Рис. 4. МРТ-изображение трансплантата ПКС в разных срезах через 1 год после операции (указано стрелками). Трансплантат выглядит структурным, гомогенным и напряженным.
В последующем при обращении пациентов в клинику проводился МРТ-контроль в более поздние сроки. МРТ-контроль позволял определить плотность, структуру, напряжение трансплантата по наличию четкого контура, признаки его разрыхленности или повреждения (рис. 5 и 6).

Рис. 5. МРТ коленного сустава через 3 года после аутопластики ПКС из BTB (кость—связка—кость) с фиксацией рассасывающимися винтами (стрелки указывают на хорошо сформированный трансплантат ПКС и на винты в бедренном и большеберцовом каналах). Показывают расположение трансплантата и имплантов в бедренной и большеберцовой костях.

Рис. 6. МРТ левого коленного сустава через 5 лет после аутопластики ПКС из STGT (а) с поперечной фиксацией RigitFix в бедренном канале и винтом BioIntrafix в большеберцовом канале (б). Это известные аббревиатуры для травматологов-ортопедов.
Заключение
Качественная МРТ-диагностика была ранее недоступна клиницистам, что приводило к длительному болевому синдрому в коленном суставе, формированию артрогенных контрактур и других нарушений у больных. Информация, которую способна дать МРТ, особенно важна в случае выполнения операции по реконструкции ПКС. По нашему мнению, если хирург не догадывается о наличии контузии мыщелков бедра и большеберцовой кости, он не может объяснить отрицательную клиническую картину у оперированных пациентов в ближайшем послеоперационном периоде.
Таким образом, не умаляя необходимости проведения полноценного клинического обследования, мы считаем, что МРТ-диагностика должна стать в нашей стране стандартным методом исследования патологии не только коленного, но и любого другого сустава как в хронической, так и в острой стадии, и особенно в острой. Кроме того, МРТ-диагностика крайне полезна для послеоперационного наблюдения за трансплантатом ПКС при условии использования рассасывающихся фиксирующих имплантатов.
МРТ зоны фокального перифизарного отека бедренной кости
ФГБНУ «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний», Кемерово, Россия
Медицинская школа ЕМС, Москва, Россия
Universitätsklinikum Bonn, Бонн, Германия
Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина Минздрава России, ФГБУ «Федеральный центр сердечно-сосудистой хирургии» Минздрава России, Пермь, Россия, Научный центр хирургии им. акад. М.А. Топчибашова Минздрава Азербайджана, Баку, Азербайджан
ФГБОУ ВО «НГМУ» Минздрава России, Новосибирск, Россия
Оценка перифокальных изменений при опухолевой и неопухолевой патологии с использованием мультипараметрической МРТ
Журнал: Онкология. Журнал им. П.А. Герцена. 2020;9(1): 29‑33
Введение. В настоящее время в лучевой диагностике существует проблема системного подхода к оценке и стандартизации протоколов лучевых исследований. Цель исследованиия — оценить значимость различных МР-методик при оценке как самого очага, так и перифокальных изменений в диагностике патологии головного мозга. Материал и методы. Проведен ретроспективный анализ 187 протоколов исследования головного мозга, выполненного на 1,5Т МР-системах, с применением диффузионных и перфузионных методик в протоколе сканирования. Результаты и обсуждение. Выполненный сравнительный анализ показал, что возраст, ограничения диффузии и количество пациентов, выписанных с улучшением, были выше в группе с неопухолевой патологией головного мозга. Более высокие значения измеряемого коэффициента диффузии (ИКД) перифокальной зоны и худшее состояние пациентов отмечали при опухолевой патологии головного мозга. Изучение перфузионных показателей при сканировании головного мозга rСBF продемонстрировало статистическую разницу между группой опухолевой патологии и неопухолевой. Заключение. Применение системного подхода необходимо для проведения лучевых исследований. Перфузионные методы в сочетании с диффузионными и анатомическими последовательностями, а также оценка перифокальных изменений повышают диагностическую и прогностическую значимость МРТ при различной патологии головного мозга. При кровоизлиянии невозможно дать адекватную количественную оценку диффузионных и перфузионных показателей.
Большинство врачей, занимающихся лучевой диагностикой, работают в неспециализированных учреждениях, поэтому рутинно выполняют исследования различных органов и систем. Вместе с этим отсутствует системная оценка лучевого исследования, зачастую тот или иной метод исследования изучают только на этапе интерпретации томограмм. В современной научной литературе имеется очень небольшой объем работ, в которых дается оценка клинической картины, протокола сканирования, метода сканирования как единого взаимосвязанного процесса. На наш взгляд, кажется безусловным, что качественно выполнить какое-либо исследование можно только в том случае, если все вышеперечисленные этапы связаны между собой.
Отсутствие целостного системного подхода к сканированию влечет за собой отсутствие общих алгоритмов исследования. На современном этапе МР-исследование головного мозга является быстро развивающейся областью исследования. Несмотря на распространенность и повсеместность выполнения таких исследований, сканирование именно головного мозга вызывает наибольшие трудности как в методике, так и в интерпретации полученных результатов.
Оценка перифокальных изменений очень важна для качественной интерпретации результатов сканирования основного патологического очага, но вероятной причиной неточности при интерпретации томограмм является сосредоточенность на описании исключительно самого очага без взаимосвязи с характеристиками перифокальных изменений. На сегодняшний день в литературе имеется незначительное количество научных трудов, в которых уделяется внимание изучению перифокальных изменений вокруг охарактеризованного патологического очага и корреляции изменений перифокальный зоны с основным очагом. Ввиду того, что опухолевая, сосудистая и воспалительная патологии нередко сопровождают друг друга, становится не очень корректным и ограниченным процесс дифференциальной диагностики в свете оценки одного лишь основного очага. Детальное изучение перифокальных изменений позволяет сделать более четкий и обоснованный вывод относительно нозологии заболевания.
Цель исследования — оценить значимость различных МР-методик при оценке как самого очага, так и перифокальных изменений в диагностике патологии головного мозга.
Проведен ретроспективный анализ исследований, выполненных на 1,5 Т МР-системах. Всего в настоящее исследование включено 187 протоколов сканирования исследований головного мозга.
Патология головного мозга включала в себя: внутримозговые кровоизлияния — 8,02% (n=15), инсульт по ишемическому типу — 59,89% (n=112), абсцесс — 1,07% (n=2), псевдотуморозную форму рассеянного склероза — 3,21% (n=6), внемозговые образования — 14,44% (n=27), глиомы — 13,37% (n=25).
Протоколы сканирования содержали диффузионно-взвешенные изображения (ДВИ) с построением карт измеряемого коэффициента диффузии и перфузионный метод (DSE — динамическое Т2* — чувствительное контрастирование) с оценкой rCBF (относительной объемной скорости потока) и rCBV (относительного объема потока) [1, 2].
Статистический анализ проводили с помощью программы Stata 13 («Stata Corp LP, College Station, TX», СШA). Проверку гипотезы о нормальности распределения признаков проводили с помощью критерия Шапиро—Уилка. Условие равенства дисперсий распределения признаков проверяли с помощью критерия Левена. Качественные переменные представлены в виде чисел (в %), количественные — в виде медианы (25-й; 75-й процентиль), если не указаны другие (Q1; Q3). Для определения достоверности различий парных сравнений в группах номинальных данных применяли непараметрический критерий МакНемара, в группах порядковых данных — непараметрический критерий знаков Уилкоксона. Для определения достоверности различий межгрупповых (независимых) сравнений в группах номинальных данных использовали критерий Фишера, в группах порядковых данных — непараметрический U-критерий Манна — головного мозга и органов таза — Уитни. Регрессионный анализ для выявления предикторных переменных прибинарной переменной отклика использовали простую и множественную логистическую регрессию. Уровень значимости для всех использующихся методов установлен как p
Пациенты были разделены на две группы: в 1-ю группу включены пациенты с неопухолевой патологией — 72,19% (n=135), во 2-ю группу — с опухолевой патологией — 27,81% (n=52). Выбраны зоны интереса: перифокальные изменения вокруг ядра ишемии или кровоизлияния — 67,91% (n=127), вокруг основного опухолевого очага — 27,81% (n=52) или неопухолевого объемного образования — 4,28% (n=8).
Результаты и обсуждение

Ввиду того, что современная МРТ имеет широкий диапазон последовательностей и методов, для каждого пациента необходимо проводить подбор используемых методик, с помощью которых можно наиболее точно сформулировать клинический диагноз (рис. 1). Рис. 1. Алгоритм планирования обследования конкретного пациента в отделении лучевой диагностики с учетом клинической задачи.
В рамках исследования головного мозга в настоящее время выполнение программы ДВИ считают одной из обязательных последовательностей.
Выявлено, что диффузия ограничена у пациентов с опухолевым поражением, при острой/подострой стадии ишемии [3], воспалительных изменениях, различных видах отека. С целью исключения очагов псевдоограничения диффузии и для детализации изменений необходимо анализировать карты измеряемого коэффициента диффузии (ИКД) и измерять их значения, которые играют важную роль при планировании и оценке эффективности терапии при опухолевых процессах [4] и др.
Результаты исследования пациентов с опухолью головного мозга показали, что ограничение на ДВИ встретилось в 16 (30,77%) случаях; p=0,00001, а при неопухолевом поражении — в 115 (85,18%) случаях; p=0,00001. Значение ИКД основного очага в группе опухолевой патологии составило 1,3 (0,71; 2,7)·10 –3 мм 2 /с; p=0,00001, в группе неопухолевой патологии — 0,47 (0,34; 0,66)·10 –3 мм 2 /с; p=0,0001. Значение ИКД перифокальных изменений в группе опухоли было 0,760 (0,59; 0,85)·10 –3 мм 2 /с; p=0,00120, в группе неопухолевой патологии — 0,805 (0,71; 1,1)·10 –3 мм 2 /с; p=0,00120. При проведении сравнительного анализа выявлено, что такие показатели, как возраст, ограничение диффузии и количество пациентов, выписанных с улучшением, выше в группе неопухолевой патологии. Значения ИКД перифокальной зоны были выше и общее состояние пациентов более тяжелым в группе опухолевой патологии — эти данные значимо отличались между группами. Однако необходимо учитывать, что существуют перекрестные значения ИКД при опухолевой и неопухолевой патологии.
Значения ИКД перифокальных изменений по патологии головного мозга в нашем исследовании коррелируют с данными литературы. Так, при глиоме G1−2 значение ИКД составляет 1,14±0,18·10 –3 мм 2 /с [5], при глиоме G3—4 — 0,82±0,13·10 ·3 мм 2 /с [6, 7], для перифокальных изменений при абсцессе — 1,38±0,25·10 –3 мм 2 /с [8, 9], для глиобластомы — 0,78±0,18·10 –3 мм 2 /с. Соответственно, если степень злокачественности опухоли невысока, то и разница в значениях ИКД основного узла и перифокальных изменений с опухолевым и воспалительным поражением будет непоказательна.
Таким образом, нужно оценивать не только ограничение диффузии и значение ИКД основного процесса, но и показатель ИКД перифокальных изменений.
Ограничением при оценке значений ИКД будет являться кровоизлияние. По данным литературы, значение ИКД в острой и подострой стадиях будет составлять 0,70—0,73·10 –3 мм 2 /с (без достоверных различий между стадиями), в хронической стадии — 2,56·10 –3 мм 2 /с [10]. При кровоизлиянии демонстрируется Т2-просвечивание в ранние стадии и Т2-вычернение (в практике известное как black out-эффект) в хронической стадии, что является ограничением метода [11].
Следующая важная часть МРТ-исследований — это перфузионные методы. В последнее время перфузионные методы вошли в рутинное использование при МРТ-исследованиях. При исследованиях головного мозга чаще применяется Т2*-перфузия (DSC) [12].
При глиомах в рамках МРТ используются значения относительно контралатерального полушария (rCBV, rCBF): чем больше степень злокачественности опухоли, тем выше будут перфузионные показатели [13]. Для внемозговых образований при наличии опухолевой инфильтрации мозгового вещества показатель rCBV от самой опухоли обычно повышается, от перифокальных изменений не повышается значимо, однако знечения rCBF увеличиваются более наглядно [14].
В группе пациентов с опухолью головного мозга выявлена корреляция показателя rCBV, который составил 1,9 (1,4; 2,7); p=0,0001, и rCBF — 1,5 (1,2; 2); p=0,001 (см. таблицу).
Корреляция показателей rCBF и rCBV при патологии головного мозга
В нашем исследовании в группе пациентов с опухолями головного мозга показатель rCBV от перифокальных изменений составил 1,34 (0,85; 4,1); p=0,00001, rCBF — 1,65 (0,8; 4,2); p=0,0001; при неопухолевом поражении rCBV — 1,23 (1,12; 1,41); p=0,00001, rCBF — 10,48 (1,23; 1,70); p=0,0001. Средние значения показателей оказались очень близки.
Таким образом, при интерпретации перифокальных изменений стоит обращать внимание как на значения rCBV, так и rCBF. В данном исследовании показатели rСBF продемонстрировали статистическую разницу между опухолевой и неопухолевой патологией, что может являться критерием дифференциальной диагностики особенно для предположения степени злокачественности внемозговых образований.
Подводя итоги практики использования перфузионных методик, можно сказать, что для дифференциального диагноза опухолевой и неопухолевой патологии при исследованиях головного мозга перфузионные программы имеют ключевое значение.
Если вопрос применения ДВИ практически в каждом протоколе сканирования при исследованиях головного мозга не вызывает сомнений, то использовать контрастирование или нет — необходимо каждый раз решать индивидуально в рамках проводимого МР-исследования.

Для решения вопроса о необходимости применения контрастного усиления при исследованиях головного мозга можно предложить использовать следующий алгоритм (рис. 2). Рис. 2. Алгоритм принятия решения о необходимости введения контрастного препарата и виде методики контрастирования.
Таким образом, при наличии солитарного очага и проведении дифференциального диагноза опухолевого и воспалительного процесса головного мозга важно анализировать данные ИКД и проводить корреляционный анализ значений с перфузионными показателями. Основные последовательности для принятия решения внутри дифференциального ряда: Т2-взвешенные изображения (ВИ), Т1-ВИ, FLAIR, ДВИ, ИКД, изображения, взвешенные по неоднородности магнитного поля, ДКУ, DSE, постконтрастные Т1 SE-ВИ.
На наш взгляд, значимость различных МР-методик при оценке как самого очага, так и перифокальных изменений в диагностике патологии головного мозга достаточно высока и перспективна, что позволит повысить прогностическое значение этого метода лучевой диагностики.
Вывод
Ограничение исследования: настоящее исследование ретроспективное, что является основным ограничением. Для подтверждения или опровержения данных, полученных в настоящем исследовании, необходимо проведение многоцентрового проспективного рандомизированного исследования с большим количеством пациентов.
Участие авторов:
Концепция и дизайн исследования — Т.А.Б., С.Е.С., Н.А.М.
Сбор и обработка материала — С.Е.С., Т.А.Б., Н.А.М., А.В.С., И.А.С.
Статистическая обработка — И.А.С., Т.А.Б., С.Е.С.
Написание текста — Т.А.Б., С.Е.С, И.А.С.
Редактирование, иллюстрации — Т.А.Б., С.Е.С., И.А.С., А.В.С.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Асептический некроз головки бедренной кости
Асептический некроз головки бедренной кости (АНГБК) – заболевание, которое может приводить к инвалидности в любом возрасте. Из-за недостаточного кровоснабжения костная ткань рассасывается, а новые трабекулы не образуются из-за пониженной активности остеобластов. Асептический некроз головки бедренной кости МРТ выявляет лучше других методов, особенно на ранних стадиях.
Что такое асептический некроз головки бедренной кости?
Чаще всего это патологическое состояние встречается среди мужчин в возрасте 30 – 50 лет. Приводит к вторичным изменения в суставе, нарушению функции нижней конечности. Чаще процесс двусторонний. Различают асептический остеонекроз:
Первичный – не определена причина, возможно, генетическая склонность.
Вторичный развивается после травмы, на месте поражения сосудов в кости. Это могут быть тромбы, эмболы, аутоиммунное воспаление мелких сосудов, сдавление извне.
Способствуют ишемии следующие болезни:
Патология системы крови – гемолиз эритроцитов приводит к образованию тромбов, нарушения свертываемости.
Прием гормональных контрацептивов, гиперфункция надпочечников.
Злоупотребление алкоголем, интоксикации.
Нарушения белкового и липидного обмена, панкреатит.
На тазобедренный сустав приходится большая нагрузка. При избыточном весе, длительном сидячем положении, неудобной рабочей позе она еще больше увеличивается. Результатом микротравм становится отек кости и постепенное ухудшение микроциркуляции, активизируется процесс ее рассасывания.

Рисунки 1,2. МРТ тазобедренных суставов
Головки бедренных костей сферической формы, суставной хрящ головок бедренных костей и вертлужных впадин однородной структуры, неравномерной толщины, целость его не нарушена.
МРТ тазобедренных суставов покажет асептический некроз головки?
По классификации ARCO выделяют 5 стадий. На каждой будет отличаться картина асептического некроза головки бедра на МРТ:
0. Ранняя, или нулевая стадия. Симптомы отсутствуют, на МР снимках с контрастом есть признаки замедления кровотока в зоне начинающегося остеонекроза.
1. Начальная, изменения обратимые. Имеется некроз костного мозга, начинается разрушение костных трабекул, что сопровождается отеком костной ткани. На месте повышенного разрушения кости развивается грануляционная и фиброзная ткань. На МРТ без контрастирования можно выявить характерный отек костного мозга, тогда как на рентгене и КТ их не видно. Эти зоны диагностируют по изменению интенсивности МР сигнала (на Т1 взвешенных снимках она понижается, на Т2 – повышается). Размеры отека сильно отличаются: начинаются с тонкой серповидной полоски в субхондральной зоне и постепенно достигают больших объемов – занимают всю головку, шейку, зону между вертелами бедра. При правильно проведенном лечении все изменения костной ткани проходят.
2. Начальная, но уже необратимая. Участок некроза отделен от здоровой кости реактивной зоной. На этой стадии можно диагностировать остеонекроз по рентгеновским снимкам. Видны очаги просветления в костной ткани бедра под хрящом, возможны очаги остеосклероза, которые возникают в ответ. На КТ хорошо виден склеротический ободок, который расположен ниже очага остеонекроза.
На МРТ выявляют «двойную линию» серповидной формы. Это патогномоничный признак остеонекроза, присутствует в 80 % случаев. Первая линия, ближе к некрозу, высокой интенсивности, это богатая сосудами грануляционная ткань. Вторая – низкой интенсивности, это склерозированная кость. Сам участок некроза может выглядеть по-разному: интенсивность сигнала зависит от наличия крови, суставного выпота, фиброзной ткани на месте разрушенной кости. Возможны изменения со стороны тазобедренного сустава – выпот, признаки воспаления.

Рисунок 3. МРТ тазобедренных суставов
Состояние после протезирования правого тазобедренного сустава.
На фоне минимального отека костного мозга в области опорного сегмента головки бедренной кости слева субхондрально определяется зона остеонекроза с четкими неровными «географическими» контурами, отделенная от неизмененных участков кости ободком (грануляционная ткань). Головка бедренной кости не деформирована, без признаков субхондрального импрессионного перелома.
3. Имеется импрессионный перелом с вдавлением в зоне под хрящом. Типичны жалобы на болевой синдром при движениях в суставе. Рентген выявляет симптом полумесяца – полоска просветления, которая идет вдоль суставной поверхности. С этого момента начинается уплощение головки бедренной кости, которое постепенно нарастает.
На МРТ тоже виден полумесяц. Это связано с тем, что жидкость из сустава затекает к месту перелома. МРТ выявляет размеры зоны отека кости, но изменения формы головки бедра лучше визуализируются на КТ.

Рисунки 4,5. МРТ тазобедренных суставов
На фоне умеренного отека костного мозга по суставной поверхности головки бедренной кости (преимущественно в наружных отделах) субхондрально определяется зона остеонекроза с четкими неровными «географическими» контурами, отделенная от неизмененных участков кости ободком (грануляционная ткань). Головка бедренной кости в передне-верхних отделах деформирована за счет формирования импрессионного субхондрального перелома.
4. Поздняя – присоединяются и нарастают дегенеративно-дистрофические изменения тазобедренного сустава: сужается щель, есть краевые разрастания кости, в субхондральной зоне выраженный склероз и кисты. Головка бедренной кости принимает грибовидную форму, клинически определяется укорочение ноги, резкое ограничение движений в суставе. Вторично из-за неправильного распределения нагрузки страдает коленный сустав, мышцы бедра атрофируются.
Изменения касаются и вертлужной впадины тазовой кости, меняется ее форма, она уплощается. Возможен анкилоз сустава, то есть полная неподвижность. Человек в этом случае становится инвалидом.
Что выбрать для диагностики: рентген, КТ или МРТ?
Начальные стадии выявляют только на МРТ. Это время, когда изменения еще обратимые, добиться их обратного развития можно при помощи консервативной терапии. Назначают:
Витамин Д, кальций, гидроксиапатит.
Стимуляторы остеогенеза – кальцитонин.
Обезболивающие и противовоспалительные средства – диклофенак и другие НПВС.
Разжижающие кровь, сосудорасширяющие препараты.
Покой – ходьба с костылями, ношение ортезов, снижающих нагрузку на сустав.
Физиотерапия – миостимуляция, ударно-волновая терапия, обогащение тканей кислородом при помощи гипербарической оксигенации.
Это позволяет уравновесить процессы разрушения и образования новой кости, остановить прогрессирование остеонекроза. На более поздних стадиях проводят хирургическое лечение – от декомпрессии при помощи штифта до пересадки костной ткани, замены тазобедренного сустава на искусственный.
В более поздних стадиях АНГБК хорошо виден и на рентгене, КТ. МРТ в этом случае назначают для определения размеров отека кости и костного мозга, степени поражения сустава. Это влияет на прогноз, выбор тактики лечения.
Чувствительность МРТ при диагностике асептического некроза доходит до 90 – 100%. Это значит, что его точно обнаружат на снимках. Специфичность тоже очень высокая – 85 – 100 %, то есть состояние не спутают с другими заболеваниями.
Отек костного мозга на МРТ позвоночника
Боли в спине – одна из самых распространенных причин обращения людей к врачу. Благодаря современным высокотехнологическим исследованиям врач может определить характер патологии, локализацию, размеры, выработать план лечения.
МРТ регистрирует отклик атомов водорода в тканях человека на сильное магнитное поле, на снимках ткани визуализируются по-разному в зависимости от содержания в них воды. Поэтому можно обнаружить изменения структуры костного мозга и его отек на МРТ позвоночника.

Причины отека костного мозга
Костный мозг расположен внутри тела каждого позвонка. Между трабекулами кости располагаются стволовые клетки, рыхлая соединительная ткань, жировая ткань. Здесь образуются все клетки крови – эритроциты, лейкоциты, тромбоциты. Поэтому изменения в костном мозге сопровождаются анемией, снижением иммунитета, обострением аутоиммунных заболеваний, склонностью к кровотечениям. С возрастом жировые клетки замещают большую часть костного мозга.
Причину отека помогает выявить опрос пациента. Большое значение имеет предшествующая травма, характер и длительность боли, нарушения чувствительности кожи, сопутствующие заболевания.
Травматический отек
Наиболее частой причиной его возникновения является травма спины: человек упал или ударился, боль со временем не проходит. Характерная особенность боли – она локализована выше, чем травмированное место. Это связано с тем, что отекший позвонок сдавливает спинномозговые корешки, сами нервы выходят из спинного мозга выше и какое-то время следуют внутри позвоночного канала, затем покидают его через межпозвоночные отверстия.
Трабекулярный отек сопровождает травмы в 100 % случаев. Встречается в любом отделе позвоночника – от шейного до копчика, локализация зависит от механизма травмы. Под действием механического фактора увеличивается давление на костную ткань, может произойти перелом позвонка, растяжение и разрывы связок. Кровеносные сосуды повреждаются, жидкая часть крови и клетки выходят из сосудов и заполняют место между костными балками. Симптоматическое лечение временно облегчает состояние, но без прицельного воздействия на причину отека костного мозга вылечиться невозможно.
Вторичный отек кости
Вторичные отеки не связаны с травмой, они осложняют течение других патологических процессов:
Отек спинного мозга часто сопровождает воспалительные процессы в позвоночнике (остеомиелит, туберкулез). Микробы могут попадать в тела позвонков с кровью из любого очага хронической инфекции (кариес, тонзиллит, эндокардит).
Дегенеративные явления (остеохондроз, межпозвоночные грыжи, артрозы фасеточных суставов – соединений между двумя соседними позвонками) нарушают питание кости, приводят к отеку. При первичном очаге в хряще отек сначала субхондральный, то есть под хрящом, далее распространяется на остальную костную ткань.
Опухоли сдавливают окружающие ткани, приводят к нарушению кровоснабжения кости, что проявляется в виде перифокального отека костного мозга позвоночника, то есть вокруг новообразования.
Нарушения обмена, эндокринные заболевания, хроническая патология почек, расстройства пищеварения ведут к дисбалансу электролитов, накоплению ионов натрия, могут стать причиной развития метаболического отека кости.
Ятрогенные причины: после операций на позвоночнике (реактивный отек), в результате приема некоторых лекарств (стероидных гормонов), на фоне лучевой терапии.
Отек костного мозга, что покажет МРТ позвоночника?
Из-за скопления жидкости в костной ткани тела позвонков увеличивается в размерах, приобретают раздутую форму. Если они увеличиваются настолько, что начинают сдавливать спинной мозг, проходящий в канале позвоночного столба, появляются неврологические симптомы, на снимках видны структурные изменения спинномозговых корешков и спинного мозга. Это уже очень опасно, развиваются:
Двигательные и чувствительные нарушения в нижних конечностях, если поражен поясничный отдел позвоночника, появляются нарушения работы тазовых органов (нарушение мочеиспускания, дефекации, половые расстройства).
При поражении шейного отдела позвоночника страдает иннервация рук (изменяется чувствительность, ограничение движений). При сильном отеке спинной мозг сдавливается не только на уровне шеи, нарушение кровообращения распространяется в вышележащие отделы. Могут присоединиться нарушения зрения, головные боли, менингеальные симптомы, рвота, повышение внутричерепного давления из-за отечности и сдавления нервов, мозговых оболочек. В продолговатом мозге расположены жизненно важные центры – дыхания и сердечной деятельности. Вовлечение их в патологический процесс может привести к летальному исходу.
Отек спинного мозга, нервов, оболочек мозга характеризуется повышением интенсивности сигнала по сравнению со здоровыми тканями. При гидроцефалии расширяются желудочки мозга.

Как выглядит отек костного мозга на МРТ?
На снимках МРТ отек костного мозга выглядит как очаг внутри кости большей интенсивности с размытыми однородными контурами. Само тело позвонка увеличено, несколько размыты границы. В норме содержание жидкости в кости до 10 %. При отеке эта цифра увеличивается до 20 %. Под действием магнитного поля можно определить концентрацию атомов водорода в тканях, границы отека, какие структуры кроме костного мозга вовлечены. Это особенно ценно, так как другие методы – рентген, КТ не выявляют отек костного вещества, микротрещины. На них визуализируются более значительные повреждения – перелом, остеопороз, трещина, смещение, некроз.
На МРТ, когда отекает костная ткань, выявляют гиперинтенсивность костного мозга. Впервые явление было зафиксировано Уилсоном в 1988 году, получило название отек костного мозга. Некоторые рассматривают его как первую, обратимую стадию развития остеонекроза. Обычно эту формулировку используют как клинико-радиологический синдром для уточнения основного заболевания. И только при исключении всех возможных других патологий ставят диагноз отек костного мозга. Для дифференциальной диагностики назначают МСКТ с контрастом, МРТ с контрастом, рентген, определение онкомаркеров в крови, ревматоидного фактора, пункцию с последующей биопсией костного мозга.
После определения с диагнозом выбирают лечение.
МРТ – единственное исследование, которое выявляет отек костного мозга позвоночника. Кроме того, на снимках видно состояние всех мягких тканей по соседству – нервов, связок, мышц, кровеносных сосудов, визуализируются грыжи на начальных стадиях. Это очень ценная информация, позволяющая выбрать правильное лечение: кому-то необходима срочная операция, кому-то – антибиотики, гормональное лечение, сосудистые средства, мочегонные, бисфосфонаты, препараты кальция, ингибиторы простагландина, витамин Д, ношение корсета. Клинически многие болезни проявляются болью в спине, а лечение требуется всем разное. Выбрать правильное направление помогает именно МРТ.
Отек костного мозга позвоночника

Ребра, грудина, тазовые кости, череп, позвонки, эпифизы длинных трубчатых костей являются вместилищем красного костного мозга. Избыточное депонирование жидкости (отек) в тканях последнего в сегментах позвоночника на уровне L1-5 может быть следствием травматизации или ряда заболеваний. Клинические проявления представлены симптомами основной патологии. Отек костного мозга поясничного отдела позвоночника обнаруживают с помощью магнитно-резонансного сканирования. Лечение преимущественно консервативное.
Рассказывает специалист ЦМРТ
Дата публикации: 16 Июля 2021 года
Дата проверки: 30 Ноября 2021 года
Содержание статьи
Накопление жидкости происходит на фоне:
- травм — переломов, ушибов костей, повреждения связок
- артропатий — дегенеративных, дисметаболических и аутоиммунных заболеваний суставов, остеохондроза, подагры, ревматоидного артрита и пр
- гиперперфузии, сопровождающей серповидно-клеточную анемию
- инфекций — остеомиелита, диксита, септического артрита
- ятрогенных повреждений при химиотерапии, проведении операций
- гормонотерапии кортикостероидами
- онкопатологии — злокачественных новообразований, метастазах в кости и доброкачественных — гигантоклеточных опухолях, хондробластоме, остеоид-остеоме
- нейропатической артропатии
Если причину отека установить не представляется возможным, говорят об идиопатической форме. К факторам риска относят заболевания почек и сердца, связанные с задержкой жидкости в организме.
Симптомы отека костного мозга
Клиника обусловлена основной причиной и локализацией очага. Начальная стадия не имеет выраженной симптоматики, а отек костной ткани позвоночника можно диагностировать исключительно на МРТ. Без медицинской помощи нарушается кроветворение, что выражается снижением выработки форменных элементов. При длительном течении развивается анемия, появляются носовые кровотечения, “беспричинные” синяки на теле, слабость. Гипергидратация способствует увеличению объема губчатого вещества и разбуханию тела позвонка, что вызывает стеноз канала с компрессией спинного мозга и нервных волокон. Изменения могут сопровождать:
- ноющая или острая боль в спине
- парестезии (нарушения чувствительности), полная потеря чувствительности
- сбои в работе сердца, легких
- дисфункция тазовых органов - недержание/задержка мочи, кала, потеря эрекции и пр
Классификация
Первичный отек костного мозга развивается после травмы на фоне проникновения из поврежденных кровеносных и лимфатических сосудов жидкости, вторичный — является следствием специфического заболевания вертебрального столба.
- трабекулярный, развивается при разрушении позвонков
- субхондральный, обусловлен деструкцией хрящевой ткани
- реактивный, рассматривают как реакцию на хирургическое вмешательство
- перифокальный формируется из-за попадания белого вещества мозга в белки плазмы при опухолевом процессе, метастазировании и др.
- асептический (небактериальный) выявляют при спондилодисците, причина - дегенеративно-деструктивные изменения костей
- инфекционный связан с размножением болезнетворных микроорганизмов — бактерий, вирусов, грибов, реже — гельминтов и простейших.
Перифокальный отек
Если патологическое скопление жидкости происходит в области повреждения церебральных структур, врачи говорят о перифокальном отеке. Поскольку отек и набухание головного мозга могут быстро стать причиной смерти пациента, при таком заболевании следует незамедлительно обратиться за врачебной помощью. Дело в том, что череп не подразумевает возможность значительного увеличения мозгового вещества, поэтому при отеке орган начинает упираться в кости и повреждаться. Перифокальный отек сопровождается мучительной головной болью, нарушением сознания вплоть до комы, галлюцинациями и снижением остроты зрения.
Перифокальный отек мозга часто развивается на фоне черепно-мозговой травмы, ушиба церебральных структур, внутримозгового кровоизлияния и ишемического инсульта. Распространенный механизм скопления жидкости — повышенная проницаемость гематоэнцефалического барьера. Это вазогенный отек головного мозга.
Как диагностировать
Жалобы неспецифичны и могут встречаться при других заболеваниях опорно-двигательного аппарата. Наиболее подходящим методом визуализации рассматривают магнитно-резонансную томографию.
Диагностика на МРТ
Магнитно-резонансная томография — эффективный метод визуализации, позволяющий получить объемные послойные изображения органа и структур. Исследование не сопровождается лучевым воздействием. При сильной головной боли, нарушении сознании и других признаках отечности церебральных отделов невролог назначит данный метод обследование. Отек мозга, диагностика которого может быть затруднена, влияет на размер и структуру органа. Специалист использует результаты сканирования для поиска источника накопления жидкости и определения степени тяжести патологии.
Многих пациентов интересует, как выглядит отек мозга на снимках. Если у больного опухолевый процесс, врач обычно обращает внимание на гиперинтенсивный сигнал без ограничения диффузии. При других формах болезни специалист учитывает повышенный сигнал на ДВИ. Отек мозга на КТ и МРТ имеет разные признаки.
Отек костного мозга на МРТ позвоночника виден на доклинической стадии, когда симптомы отсутствуют. Сканирование показывает: протяженность очага пораженные позвонки стеноз канала вовлеченность в процесс спинного мозга и ветвей состояние близко расположенных тканей фоновые патологии.
Отек костного мозга в шейном отделе позвоночника нередко сопровождается гидроцефалией. О трабекулярном отеке на фото МРТ свидетельствует деформация, деструкция позвонка. В отдельных случаях может потребоваться биопсия пораженной структуры.
К какому врачу обратиться
Пациентов с подобной проблемой могут вести несколько специалистов — невролог, ортопед-травматолог, вертебролог, онколог. После купирования острых явлений показана консультация реабилитолога.
Читайте также:
- Пневмокониоз рабочих угольной промышленности
- Лечение злокачественной опухоли яичника у беременной - тактика
- Подготовительный период. Прелиминарный период. Патологический прелиминарный период. Предвестники родов.
- Симптомы сиалоаденоза (сиалоза) и его лечение
- Стеноз подскладочного пространства гортани и трахеи - лучевая диагностика
