Киста пигментного эпителия радужки: признаки, гистология, лечение, прогноз
Обновлено: 30.04.2024
Кисты стромы радужки: признаки, гистология, лечение, прогноз
Из-за своей локализации между волокон стромы кисты стромы радужки называются стромальными. Обычно они выглядят прозрачными и, как правило, выстланы поверхностным, а не пигментным эпителием, поэтому термин «интрастромальные поверхностные эпителиальные кисты» является более точным. Эти кисты бывают врожденными и приобретенными (1-27). Врожденные стромальные кисты радужки обычно выявляются в раннем детстве, 81 % из них диагностируется в возрасте моложе 10 лет (1-5,9). Некоторые кисты хорошо заметны уже при рождении, тогда как другие спонтанно развиваются в более старшем возрасте. Приобретенные стромальные кисты радужки бывают идиопатическими или возникают после проникающего ранения глаза или внутриглазного оперативного вмешательства.
а) Клиническая картина. Клинически стромальная киста радужки имеет тонкую стенку, она локализуется в строме радужки и вызывает ее расслоение. В просвете кисты обычно содержится прозрачная или слегка замутненная жидкость, иногда наблюдается уровень жидкость/детрит. За задней стенкой прозрачной кисты зачастую виден пигментный эпителий радужки. Врожденные кисты медленно увеличиваются в размерах, перекрывают зрачок и вызывают ухудшение зрения. Это новообразование у маленьких детей ведет себя более агрессивно, чем у подростков и взрослых (9). Приобретенная стромальная киста у взрослых выглядит также, но для нее характерно стабильное течение или медленный рост. Кисты любого типа могут периодически спадаться и снова увеличиваться вследствие возникновения мелких разрывов стенки кисты, но эти спонтанные разрывы зачастую приводят к развитию переднего увеита.
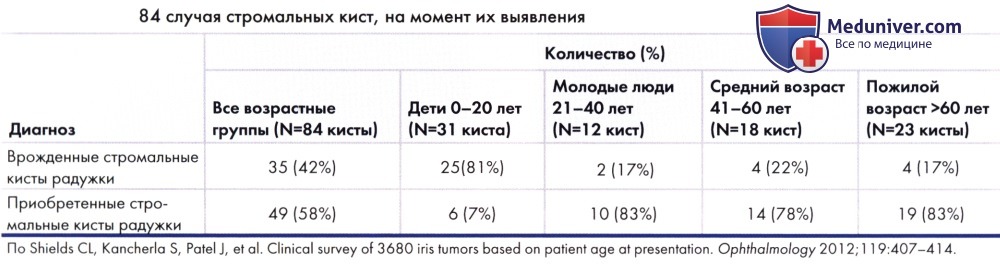
Распределение различных типов стромальных кист в одном из крупных исследований приведено в таблице ниже.
б) Патологическая анатомия. Гистологически стромальная киста радужки выстлана тонким неороговевающим многослойным эпителием, иногда она содержит бокаловидные клетки. Патогенез этого состояния в большинстве случаев остается неизвестным, но врожденные кисты, как представляется, развиваются вследствие дислокации эпителия конъюнктивы в радужку в процессе эмбриогенеза. Высказывалось предположение о попадании клеток с поверхности глаза в переднюю камеру в результате пренатального амни-оцентеза. При иммуногистохимическом исследовании наблюдается положительная реакция эпителия кисты на высокомолекулярные кератины и отрицательная на протеин S-100, что подтверждает предположения о происхождении кисты из поверхностной эктодермы или нейроэктодермы.
в) Лечение. Лечение кисты стромы радужки может быть затруднено (12-20). Когда новообразование перекрывает зрачок, мы обычно выполняем аспирацию кисты иглой 30G и вызываем ее спадение. После этого возможно проведение криотерапии или каутеризации основания кисты вблизи лимба через склеру. Если новообразование рецидивирует, выполняется повторная аспирация или прибегают к другим методам лечения. Для деструкции стенки кисты также используется лазер, но после применения этой методики часто наблюдаются рецидивы, кроме того, существует риск врастания эпителия. В случаях неэффективности перечисленных выше методов может потребоваться выполнение иридэктомии или иридоциклэктомии с удалением кисты.
Недавно была предложена методика введения в кисту чистого спирта или склерозирующих препаратов, например, митомицина С (16,20). Под (операционным) микроскопом в кисту вводится этанол, после чего выполняется тщательный лаваж, регрессия кисты наблюдается более чем в 90% случаев (20). Детям со стромальными кистами необходимо выполнять рефрактометрию, и при развитии амблиопии проводить соответствующее лечение, в том числе заклеивая парный глаз.
ВРОЖДЕННЫЕ СТРОМАЛЬНЫЕ КИСТЫ РАДУЖКИ
Проиллюстрированы типичные случаи, в том числе несколько давних случаев, по поводу которых выполнялась хирургическая резекция. В настоящее время в качестве первичного лечения выполняется аспирация, иногда с введением митомицина С или чистого этанола.
Врожденная стромальная киста нижненосового квадранта радужки у восьминедельной девочки. Врожденная стромальная киста нижневисочного квадранта радужки у семинедельного ребенка. Врожденная стромальная киста верхнего квадранта радужки у 10-недельного ребенка, наблюдавшаяся несколько лет назад. После аспирации киста рецидивировала и потребовала хирургического удаления. Внешний вид глаза, показанного на рисунке выше, после хирургического удаления кисты. Обратите внимание на необходимость выполнения секторальной иридэктомии. В настоящее время, вероятно, была бы выполнена аспирация с ирригацией кисты митомицином С или чистым этанолом. Двухкамерная врожденная стромальная киста верхней части радужки у восьминедельного ребенка. Фотография сделана несколько недель назад. Впоследствии потребовалась иридэктомия. Гистологический препарат новообразования, показанного на рисунке выше. Обратите внимание, что киста выстлана неороговевающим многослойным эпителием, окруженным тканью стромы радужки (гематоксилин-эозин, х15).
ЛЕЧЕНИЕ ВРОЖДЕННЫХ СТРОМАЛЬНЫХ КИСТ РАДУЖКИ: АСПИРАЦИЯ И ИРРИГАЦИЯ ЭТАНОЛОМ
В последнее время отдельные врожденные стромальные кисты радужки лечатся аспирацией и ирригацией этанолом. Первые результаты наблюдения свидетельствуют о безопасности и надежности этой методики. Такой случай проиллюстрирован ниже.
Врожденная стромальная киста радужки у восьмимесячной девочки, которой ранее уже выполнялась простая аспирация кисты. На флюоресцентной ангиограмме видны ветвящиеся по поверхности кисты сосуды. При диафаноскопии виден просвет: увеличивающаяся киста радужки вызвала выраженную атрофию пигментного эпителия радужки. При ультразвуковой биомикроскопии определяется крупная прозрачная киста, частично замещающая собой радужку и цилиарное тело. Техника выполнения аспирации и ирригации с помощью иглы 30 G. Внешний вид того же глаза после аспирации и ирригации этанолом. В течение 18 месяцев наблюдения новообразование не рецидивировало.
ПЕРВИЧНАЯ ПРИОБРЕТЕННАЯ СТРОМАЛЬНАЯ КИСТА РАДУЖКИ
Кисты этого типа, как представляется, возникают спонтанно, обычно у взрослых, в анамнезе которых отсутствует травма или оперативное вмешательство на глазах. В отличие от приобретенной пигментной эпителиальной кисты, новообразование иногда медленно увеличивается в размерах и вызывает воспаление, повышение внутриглазного давления и ухудшения зрения. В некоторых случаях отмечается тенденция к увеличению кисты в течение какого-то периода времени, после чего киста спонтанно спадается, а затем увеличивается снова. Клинически первичная приобретенная киста аналогична первичной врожденной стромальной кисте радужки.
Первичная приобретенная стромальная киста верхней части радужки у мужчины 45 лет. Первичная приобретенная стромальная киста в верхненосовом квадранте радужки у женщины 40 лет. Первичная приобретенная стромальная киста нижней части радужки у женщины 34 лет. Стромальная киста радужки у мужчины 32 лет. Первичная приобретенная стромальная киста нижней части радужки у юноши 17 лет. Ультразвуковая биомикроскопия новообразования, показанного на рисунке выше. Обратите внимание на типичную округлую кисту, замещающую строму радужки. Новообразование прогрессировало, поэтому были выполнены аспирация и ирригация этанолом.
СТРОМАЛЬНАЯ КИСТА РАДУЖКИ: ОПТИЧЕСКАЯ КОГЕРЕНТНАЯ ТОМОГРАФИЯ И УЛЬТРАЗВУКОВАЯ БИОМИКРОСКОПИЯ ПЕРЕДНЕГО ОТРЕЗКА
Изображение стромальных кист радужки возможно получить либо с помощью относительно неинвазивной оптической когерентной томографии переднего отрезка, либо при помощи ультразвуковой биомикроскопии, требующей применения специальной ванночки для иммерсионной жидкости. Ультразвуковая биомикроскопия более информативна при выявлении патологических изменений, локализующихся за радужкой, тогда как оптическая когерентная томография переднего отрезка позволяет получить изображения радужки, передней камеры и роговицы высокого разрешения.
Стромальная киста радужки у ребенка. При оптической когерентной томографии переднего отрезка определяется кистозное образование. Стромальная киста радужки у взрослого. При гониоскопии определяется киста, распространяющаяся на структуры угла передней камеры. При ультразвуковой биомикроскопии определяется сдавливающая радужку киста, поражение цилиарного тела отсутствует. При оптической когерентной томографии определяется сдавливающая радужку киста. Современные системы не позволяют визуализировать глубжележащие структуры.
ПЕРВИЧНАЯ ПРИОБРЕТЕННАЯ СТРОМАЛЬНАЯ КИСТА РАДУЖКИ: ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ И ЛЕЧЕНИЕ
Первичная приобретенная стромальная киста нижне-носового квадранта радужки у пациента 71 года. Обратите внимание на мутное содержимое кисты и малозаметный уровень «псевдогипопиона» в нижней части кисты. То же новообразование, что и на рисунке выше, год спустя, отмечается небольшое увеличение размеров кисты и усиление деформации зрачка. Первичная приобретенная стромальная киста нижненосового квадранта радужки у мужчины 61 года. Ткань стромы полностью отсутствует, через прозрачную кисту виден пигментный эпителий радужки, что определяет темную окраску кисты. Внешний вид новообразования полгода спустя, отмечается увеличение размеров кисты. Первичная приобретенная стромальная киста височной части радужки у мужчины 36 лет. Внешний вид новообразования, показанного на рисунке выше, два месяца спустя, отмечается хороший результат аспирации кисты и криовоздействия на ее основание вблизи лимба. Вмешательство было выполнено еще до того, как мы стали применять аспирацию с ирригацией этанолом.
ВТОРИЧНЫЕ ПОСТТРАВМАТИЧЕСКИЕ И ПОСЛЕОПЕРАЦИОННЫЕ СТРОМАЛЬНЫЕ КИСТЫ
Обычно эпителий врастает в переднюю камеру в форме плоского пласта эпителиальных клеток, но иногда врастающий эпителий формирует кисту. С развитием техники операций по поводу катаракты и хирургической обработки травматических повреждений кисты, образованные врастающим эпителием, встречаются все реже.
Киста на ножке, образованная вросшим эпителием, в зоне перенесенного ранее проникающего лимбального ранения у мужчины 52 лет. Киста, образованная вросшим эпителием, развившаяся у височного края операционной раны после вмешательства по поводу катаракты. Киста, образованная вросшим эпителием, возникшая у височного края операционной раны после вмешательства по поводу катаракты. Обратите внимание на «псевдогипопион» в нижней части кисты, образованный эпителиальным детритом. Многокамерная киста, образованная вросшим эпителием, в области операционной раны после вмешательства по поводу катаракты. Обратите внимание на уровни «псевдогипопиона» в обеих камерах кисты. Киста, образованная вросшим эпителием, развившаяся в области операционной раны после вмешательства по поводу катаракты, у мужчины 52 лет. Из-за рецидивировавшего воспаления киста была иссечена. Гистологический препарат новообразования, показанного на рисунке выше: определяется выстланная многослойным плоским эпителием стенка кисты. В просвете кисты виден эпителиальный детрит (гематоксилин-эозин, х20).
- Вернуться в оглавление раздела "Онкология"
Редактор: Искандер Милевски. Дата публикации: 1.6.2020
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Оптимизация лечения кист радужки
Киста радужки – это доброкачественное новообразование переднего отдела сосудистой оболочки, составляющее 20% среди всех образований радужной оболочки [1, 2].
Кисты радужки подразделяются на первичные и вторичные. Первичные кисты включают кисты пигментного эпителия и кисты стромы радужки. В свою очередь, кисты пигментного эпителия радужной оболочки подразделяются на центральные, среднезональные, периферические, свободно плавающие [1, 2]. Кисты пигментного эпителия имеют тенденцию к росту в свободное пространство задней камеры глаза, что бывает редко и практически не вызывает осложнений и, как следствие, не требует лечения.
Стромальные кисты, как правило, характеризуются более агрессивным течением из-за склонности к росту с заполнением объема передней камеры, что приводит к закрытию угла и развитию глаукомы, контакту стенки кисты с задней поверхностью роговицы и формированию эндотелиальной дистрофии, а также развитию контактной катаракты [3]. Кроме того, возможен спонтанный разрыв стенки кисты с высвобождением содержимого образования и формированием переднего увеита.
Причины вторичных кист стромы радужки разнообразны. Как правило, это следствие миопии, перенесенных травм, воспалительных процессов, операций [2, 4, 5].
Среди основных методов лечения кист радужки выделяют хирургическую резекцию кист [6, 7], криокоагуляцию [8], фотокоагуляцию [9, 10], YAG-лазерную коагуляцию [11, 12], эндолазеркоагуляцию [13, 14], ирригацию полости кисты 95% этанолом [3, 15], а также целый ряд различных подходов. Такой широкий спектр вмешательств обусловлен отсутствием определённых рекомендаций по лечению кист радужки в силу малой эффективности предлагаемых методик и склонности образований к рецидивированию. В связи с этим возникает необходимость в разработке эффективного метода лечения данной патологии.
Представить новый подход в лечении кист радужки.
Материал и методы
В данное исследование включено 20 пациентов (20 глаз) с кистами радужки. При этом первичные кисты отмечены у 9 пациентов, а у 11 пациентов причиной кисты явилась травма (вторичные кисты). Возраст пациентов составил от 1 года до 66 лет (средний – 32 года). При этом мужчин было 10 (50%), женщин – 10 (50%), из них детей – 8 (40%). Острота зрения с коррекцией в момент обращения составила от pr.certae до 1,0 (средняя – 0,3), у 11 пациентов был диагностирован астигматизм (от 0,25 до 6,5 Д). Всем пациентам проводили ультразвуковую биомикроскопию глаза, по данным которой протяженность кист варьировались от 3,9 до 8,8 мм (в среднем – 6,2 мм), высота – от 1,5 до 6,1 мм (в среднем 3,5 мм). Закрытие угла передней камеры было отмечено во всех случаях. До хирургического вмешательства определяли плотность эндотелиальных клеток (ПЭК), которая составляла от 1412 до 2793 кл/мм2 (в среднем – 2211 кл/мм2). Из осложнений выявили такие, как осложненную катаракту (n=8), глаукому (n=1), рубеоз радужки (n=1), а также эндотелиально-эпителиальную дистрофию роговицы (n=3) и неоваскуляризацию роговицы в зоне кисты (n=6).
Показаниями к хирургическому вмешательству явились снижение зрения в силу закрытия оптической зоны кистой, большие размеры образования с тенденцией к его увеличению, вторичная офтальмогипертензия, изменения роговицы. У 4 пациентов выполняли введение спирта без иссечения капсулы кисты. У остальных 16 пациентов проводили хирургическое вмешательство по нижеописанной методике.
Детей оперировали под наркозом, взрослым была применена ретробульбарная анестезия с внутривенной седацией. С помощью копьевидного ножа производили парацентез в соответствующем секторе, затем выполняли вход в полость кисты (через непрозрачную часть роговицы) в зоне контакта передней стенки кисты с эндотелием роговицы. С помощью копьевидного ножа производились 2 дополнительных парацентеза. В переднюю камеру вводили вискоэластик (Vis Coat) для защиты структур передней камеры глаза. Важным моментом в проведении операции являлось исключение попадания спирта в переднюю камеру, которое оценивали путем предварительного наполнения полости кисты сбалансированным ирригационным раствором (BSS) с контролем целостности ее стенок. Во всех случаях отмечали целостность стенок кисты. Затем полость кисты орошали 95% этиловым спиртом с одномоментной обильной ирригацией поверхности глазного яблока растровом BSS. Выдерживали экспозицию этанола в полости кисты в течение 30-45 секунд двукратно, после чего полость кисты промывали растровом BSS. Сращение передней стенки кисты с роговицей максимально разделяли шпателем. Через 2 дополнительных парацентеза вводили витреоретинальные ножницы и пинцет, с помощью которых иссекали свободные от сращений стенки кисты. Части стенки кисты, плотно спаянные с передней капсулой хрусталика и роговицей, не удаляли. Полученный материал кисты направляли на гистологическое исследование. Вискоэластик удаляли из передней камеры. Операцию завершали наложением узловых роговичных швов на парацентезы.
Полное разрушение кисты достигнуто у 16 пациентов. При этом в зоне кисты отмечали локальную атрофию радужки со сморщиванием ее стромы.
У 4 пациентов отмечали рецидив кисты радужки после введения спирта без иссечения капсулы кисты через 2, 3, 4 и 5 мес. после оперативного вмешательства, в том числе у 1 пациента после предшествующей пятикратной YAG-лазердисцизией рецидивирующей кисты в другом лечебном учреждении. Всем пациентам с рецидивами выполняли повторное введение 95% спирта в полость образования с последующим иссечением ее капсулы, что привело к полной регрессии во всех четырех случаях.
Улучшение остроты зрения отмечено у 12 чел., сохранение дооперационных зрительных функций – у 4 чел., ухудшение – у 4 чел. вследствие прогрессирования имеющейся на момент лечения катаракты. Регрессия новообразованных сосудов достигнута у 6 пациентов.
Средний срок наблюдения составил 26 мес. (от 1 до 74 мес.). Осложнений после проведенных манипуляций отмечено не было. ПЭК после лечения составила 2130 Кл/мм2 (от 1231 до 2574 Кл/мм2).
Несмотря на относительно высокую встречаемость кист радужки среди всех образований радужной оболочки [1, 2], в настоящее время не существует эффективного общепринятого метода лечения. Хирургическое иссечение кисты с иридэктомией является инвазивной манипуляцией с возможным развитием серьезных осложнений [6, 7]. Для абляции кисты еще в 1971 г. Cleasby [9] предложил фотокоагуляцию, которая, однако, не нашла широкого применения из-за частого рецидивирования и высокого риска эпителизации переднего сегмента. Методика YAG-лазерной коагуляции стенки кисты проводится при ограниченных непрогрессирующих кистах небольшого размера и не рассматривается как радикальная процедура для больших образований [11, 12], которые в значительном числе случаев рецидивируют. Основным недостатком как фотокоагуляции, так и YAG-лазерной коагуляции кист является сохранение остатков стенки кисты с неповрежденным эпителием, что не только является субстратом для рецидивирования образования, но и наряду с содержимым кисты, изливающимся в переднюю камеру, становится причиной асептического воспаления. С целью воздействия на эпителий кисты с полной его денатурацией предлагали эдодиатермию, эндофотокоагуляцию, а также введение склерозирующих агентов в полость кисты, таких как трихлоруксусной кислоты [16], митомицина С [17], 5-фторурацила [18].
Введение 95% спирта в полость кисты впервые было описано Behrouzi et al. [15], подтвердившего эффективность данной методики в 94% исследуемых глаз как с однокамерными, так и многокамерными кистами. Предложенная Shields C.L. et al. [3] методика явилась модификацией метода Behrouzi et al. [15], отличающаяся введением иглы через роговицу в месте крепления кисты, а также использованием вискоэластика для защиты эндотелия роговицы. Однако не во всех случаях имеет место соприкосновение кисты с задней поверхностью роговицы, что ограничивает данный метод в применении. Предлагаемая нами методика удаления кист радужки предполагает не только введение в полость кисты 95% спирта, но и последующее максимальное иссечение стенок кисты. Дополнительное частичное иссечение стенок образования позволяет еще больше снизить риск рецидивирования, а также предупредить развитие воспаления в передней камере глаза за счет максимальной эвакуации поврежденных спиртом тканей. По нашим данным, у 4 пациентов наблюдали рецидив кисты после введения спирта без последующего иссечения стенки. Однако при введении этанола с последующим удалением капсулы кисты рецидивов не отмечали ни в одном случае. Также не было отмечено осложнений ни со стороны эндотелия роговицы, ни со стороны радужки и хрусталика, что обусловлено использованием вискоэластиков.
Разрушение эпителиальной выстилки кисты спиртом с применением дополнительного иссечения свободных стенок кисты является эффективным способом лечения данной патологии. Предлагаемая техника не сопровождается осложнениями.
Киста пигментного эпителия радужки: признаки, гистология, лечение, прогноз
Эпителиома (аденома) пигментного эпителия радужки: признаки, гистология, лечение, прогноз
Иногда истинные опухоли развиваются из пигментного эпителия радужки, цилиарного тела или сетчатки (pigment epithelium of the iris - IPE, ciliary body - CPE, retina - RPE). Опухоли, развивающиеся из этих тканей, часто называют аденомами или аденокарциномами, в зависимости от того, имеет ли новообразование гистологические признаки доброкачественной или злокачественной опухоли. Но поскольку источником этих опухолей является нейроэпителий и они, как правило, не формируют железистых структур, мы предпочитаем использовать термин, соответственно, доброкачественная или злокачественная эпителиома пигментного эпителия, а не аденома или аденокарцинома.
Доброкачественные и злокачественные опухоли пигментного эпителия зачастую неотличимы друг от друга ни клинически, ни гистологически. Однако дифференцировка этих опухолей остается предметом споров, поскольку эпителиома пигментного эпителия метастазирует крайне редко или вообще никогда. Поэтому мы решили объединить эти опухоли в одну группу под названием эпителиома пигментного эпителия. Однако между опухолями, развившимися из пигментного эпителия радужки, цилиарного тела и сетчатки существуют некоторые клинические и гистологические различия, и по этой причине мы описываем клиническую картину этих опухолей по отдельности, в зависимости от их анатомического происхождения. В данном разделе рассматриваются эпителиомы пигментного эпителия радужки (1-24).
а) Клиническая картина. Возраст на момент постановки диагноза варьирует от 11 до 85 лет (среднее значение-60 лет), половой предрасположенности не выявлено (1). Почти всегда эти пациенты направлялись для дообследования с подозрением на меланому радужки или цилиарного тела. Эпителиома пигментного эпителия радужки представляет собой солитарное одностороннее новообразование, в 80% случаев она локализуется на периферии радужки, хотя также она может развиваться на зрачковом крае.
Клинически она выглядит как резко выступающее над поверхностью радужки образование с гладкой, иногда узловатой, поверхностью от темно-серого до черного цвета. Обычно опухоль вызывает истончение или полную деструкцию покрывающей ее стромы радужки, но, в отличие от меланомы, строма радужки не является источником этого новообразования.
Эпителиома пигментного эпителия по периферии радужки у женщины 63 лет. Гониоскопическая картина новообразования, показанного на рисунке выше. Обратите внимание на белые тяжи остаточной стромы радужки над опухолью. Узловатая пигментированная опухоль угла передней камеры, впервые выявленная у подростка. Пациент находился под наблюдением, отмечался медленный рост опухоли, вследствие диссеминации пигмента в трабекулярную сеть развилась вторичная глаукома. Микропрепарат опухоли, показанной на рисунке выше, после выполнения иридоциклэктомии: видны тяжи пролиферирующего пигментного эпителия. После удаления опухоли методом иридоциклэктомии внутриглазное давление вернулось к нормальным значениям, в течение 25 лет после операции острота зрения пациента сохранялась на уровне 20/20. При осмотре на щелевой лампе у тридцатилетнего афроамериканца позади радужки визуализируется пигментная опухоль. Новообразование также было удалено методом иридоциклэктомии. Микропрепарат того же новообразования, что и на рисунке выше: отмечаются тяжи пролиферирующих пигментных эпителиальных клеток. На этом срезе пигментный эпителий сетчатки (сверху) интактен, но на другом срезе видно, что именно он служит источником опухоли (гематоксилин-эозин, х150).
ЭПИТЕЛИОМА (АДЕНОМА) ПИГМЕНТНОГО ЭПИТЕЛИЯ РАДУЖКИ И ЦИЛИАРНОГО ТЕЛА: КЛИНИКО-ПАТОЛОГИЧЕСКАЯ КОРРЕЛЯЦИЯ ПРОГРЕССИРУЩЕГО НОВООБРАЗОВАНИЯ
Новообразование черного цвета в носовом квадранте радужки левого глаза женщины-европеоида 74 лет. Тремя годами ранее на этом же глазу была выполнена операция по поводу катаракты, на тот момент никаких новообразований радужки выявлено не было. Уставлен диагноз - аденома пигментного эпителия радужки, проводилось периодическое наблюдение. Внешний вид новообразования три года спустя: отмечается заметное увеличение его размеров. Тогда же в цилиарном теле был выявлен еще один компонент опухоли меньших размеров. Макропрепарат интенсивно пигментированного объемного образования, удаленного при частичной послойной иридоциклэктомии. Микропрепарат того же новообразования при малом увеличении: в поле зрения видны тяжи интенсивно пигментированных эпителиальных клеток и неизмененный фрагмент центральной части радужки слева (гематоксилин-эозин, х10). Тяжи и островки пигментных клеток при большом увеличении (гематоксилин-эозин, х75). Осветленный препарат той же опухоли: отмечаются четко очерченные пучки клеток с обильной зернистой цитоплазмой и одинаковыми ядрами, окруженные базальной мембраной (гематоксилин-эозин, х150; осветленный).
б) Дифференциальный диагноз. Основные пункты дифференциального диагноза эпителиомы пигментного эпителия радужки включает в себя невус радужки, меланому радужки или цилиарного тела и кисту пигментного эпителия радужки (2, 8). Эти состояния детально обсуждаются в других разделах настоящего руководства. Диагностировать эпителиому пигментного эпителия радужки помогают однородный черный цвет, локализация источника опухоли позади радужки, круто выступающие над поверхностью радужки края новообразования и отсутствие сторожевых кровеносных сосудов.
в) Диагностика. Хотя ранее считалось, что дифференцировать эпителиому пигментного эпителия радужки от меланомы, невуса или меланоцитомы радужки очень трудно или невозможно, точной диагностике помогают типичные признаки этой опухоли. В отличие от иридоцилиарной кисты эта опухоль, как правило, не пропускает свет при диафаноскопии. Ультразвуковая биомикроскопия помогает оценить распространенность новообразования и исключить кисту и кавернозную меланому цилиарного тела (9). Однако эпителиома пигментного эпителия сетчатки иногда содержит мелкие кисты, выявляемые при ультразвуковой биомикроскопии.
г) Патологическая анатомия. В описанных случаях эпителиомы пигментного эпителия сетчатки характеризовались достаточно типичной гистологической картиной. При микроскопии под малым увеличением определялась интенсивно пигментированная опухоль, развившаяся из прилегающего нормального пигментного эпителия радужки. Чаще всего опухоль сдавливает строму радужки, но не инфильтрирует ее. Цитологически это новообразование характеризуется наличием неправильной формы тяжей и тубул, образованных высокодифференцированными клетками пигментного эпителия и разделенных соединительнотканными септами.
Иногда в ткани опухоли обнаруживаются кистозные пространства, содержащие меланофаги. Изредка эпителиома пигментного эпителия сетчатки демонстрирует инвазивность и клеточный плеоморфизм, в таких случаях опухоль классифицируют как злокачественную.
д) Лечение. Для эпителиомы пигментного эпителия радужки характерно очень медленное развитие. Однако иногда эта опухоль все же вызывает те же осложнения со стороны переднего отрезка, что и меланома радужки или цилиарного тела (2,8). Если клинически выставлен предположительный диагноз, а новообразование существует бессимптомно, мы обычно рекомендуем лишь наблюдение. По нашему опыту, в конечном итоге удаление опухоли требуется в 10-15% случаев, когда регистрируется ее рост или диссеминация; обычно выполняется иридоциклогониэктомия.
Из описанных нами 20 случаев иридоциклогониэктомия была выполнена в двух случаях, 18 случаев находились под наблюдением. При сроках наблюдения от шести месяцев до девяти лет все наблюдавшиеся опухоли оставались стабильными (1).
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, ул. Садовая-Черногрязская, 14/19, Москва, 105062, Российская Федерация
ФГБУ "Московский НИИ глазных болезней им. Гельмгольца" Минздрава России
Лазерное лечение гигантской кисты радужки и передней камеры у ребенка (клиническое наблюдение)
Журнал: Вестник офтальмологии. 2018;134(5): 86‑91
Описан клинический случай посттравматической гигантской кисты радужки и передней камеры у ребенка 3 лет, успешно пролеченного лазерным методом (ИАГ (иттрий-алюминиевый гранат)-лазер и лазер с диодной накачкой и удвоением частоты). Достигнуто рубцевание кисты с сохранением остроты зрения 1,0. Срок наблюдения 10 лет. Вопрос показаний к лазерным методам устранения кист переднего отдела глаза у детей остается дискутабельным. Гигантские размеры кисты традиционно считаются противопоказанием к лазерному лечению, чаще ведут к гибели глаза как органа, особенно после ее радикального хирургического удаления. Описанный случай подтверждает целесообразность попытки неинвазивного лазерного лечения даже при гигантском размере кисты.
Кисты переднего отдела глаза — редкие, но тяжелые заболевания органа зрения; могут быть врожденными, обусловленными нарушением эмбриогенеза [1, 2], и вторичными, развившимися вследствие травмы, опухоли глаза или инвазии паразита [3—5].
Врожденные кисты часто сопровождаются другими пороками развития глаза и могут долго существовать бессимптомно, но, достигая больших размеров, симулируют опухоли, сопровождаются катарактой, подвывихом хрусталика или вторичной глаукомой [2].
Стромальные врожденные кисты радужки выявляются раньше, чем пигментные, чаще и быстрее прогрессируют, ведут к роговичному синдрому, офтальмогипертензии, помутнению роговицы и гибели глаза [6]. Пигментные кисты радужки реже прогрессируют и чаще не требуют удаления, если не закрывают область зрачка [7].
Наиболее часто встречаются посттравматические кисты как тяжелые осложнения проникающих ранений глаз или внутриглазных операций, обусловленные недостаточной адаптацией краев операционного разреза или раны, наложением сквозных корнеосклеральных швов, ущемлением капсулы хрусталика, радужки или стекловидного тела в ране [3, 4, 8, 9].
Посттравматические серозные (пролиферативные, инвазивные) кисты вызваны прорастанием эпителия конъюнктивы или лимба по ходу раневого канала в ткань радужки или пролиферацией заднего эпителия роговицы [10]. Более редкие жемчужные (эпидермоидные или имплантационные) кисты обусловлены разрастанием эпителиальных клеток эпидермиса, роговицы, конъюнктивы, волосяных мешочков ресниц, попавших в переднюю камеру или ткань радужки при травме или операции, отличаются медленным ростом, но большим размером и часто приводят к гибели глаза из-за вторичной глаукомы с буфтальмом или гипотонии с последующей субатрофией глаза [3, 4, 8].
Относительно лечения кист передней камеры единого мнения не существует. В разное время для лечения кист радужки и передней камеры применяли их пункции с введением в полость кисты препаратов (спирт и др.), вызывающих слипчивое воспаление [11—13], аспирации и частичные резекции кист с рентгенотерапией, а позднее — с крио-, диатермо- [5, 14] или эндолазеркоагуляцией [12], эндодиатермией [14] или сочетание крио- и лазеркоагуляции стенок кисты и зоны врастания эпителия [15, 16].
Однако частичная резекция кист, даже с коагуляцией их основания [16, 17], не является гарантией отсутствия продолженного роста. Поэтому хирурги стремятся удалить кисту более радикально — выполнить блок-эксцизию, которая предполагает удаление кисты радужки и цилиарного тела с одномоментной задней кератэктомией или послойной кератопластикой, кореопластикой [2, 4], витрэктомией, ленсэктомией, криодеструкцией зоны роста [18—20].
Хирургическое лечение бывает успешным только при кистах I—II степени [2], несмотря на использование витреофагов и витреотомов. При больших кистах радужки, цилиарного тела или исходящих из рубцов, сращенных с подлежащими тканями, сопровождающихся иридоциклитом, офтальмогипертензией, радикальное удаление кист чревато высоким риском повреждения хрусталика, иридодиализа, выпадения стекловидного тела, внутриглазного кровоизлияния, отслойки сосудистой и сетчатой оболочек, дистрофии роговицы, вторичной глаукомы и нередко заканчивается гибелью глаза [2, 20].
Существующие методы инструментального удаления кист передней камеры, даже самые современные высокотехнологичные, остаются весьма травматичными, имеют ограниченные показания [9]. Учитывая низкую эффективность операций и известные, хотя и редкие, случаи обратного развития спонтанных кист, многие авторы считают показанным хирургическое лечение только при тенденции к росту кисты [16].
Отечественными лазерными хирургами разработаны оригинальные эффективные методы лазерной цистодеструкции: комбинированный двухэтапный ИАГ (иттрий-алюминиевый гранат)-аргон-лазерный метод, метод «всплывающей кисты» и другие, нашедшие достаточно широкое применение у взрослых пациентов, особенно при посттравматической патологии [8, 9]. Однако проблему лазерного лечения кист нельзя пока считать полностью решенной.
Токсический увеит, вызванный попаданием содержимого кисты в переднюю камеру при вскрытии кисты [3, 9], неизбежные геморрагии при цистодеструкции у 1/3 больных, выраженный реактивный синдром [21] и вторичная глаукома могут вести к гибели глаза даже после успешных лазерных операций [22].
Сравнительно высокая частота рецидивов кист после лазерной цистодеструкции обусловлена невозможностью разрушения зоны роста кисты, прикрытой остатками стенок кисты [8]. Радикальное лазерное устранение кист с полной коагуляцией зоны роста при больших размерах кист с мутным содержимым невозможно технически [8, 9].
Однако несмотря на перечисленные ограничения, лазерная цистодеструкция имеет ряд несомненных преимуществ перед инструментальной: она менее травматична, неинвазивна, сопровождается менее выраженным реактивным синдромом, сокращает сроки лечения, позволяет избежать энуклеации [9].
Поэтому вопрос показаний к лазерной хирургии кист переднего отдела глаза остается дискутабельным.
В МНИИ глазных болезней им. Гельмгольца накоплен большой опыт (более 100 пациентов) успешного лазерного лечения посттравматических, послеоперационных и врожденных кист радужки, передней камеры как у взрослых пациентов [8, 9], так и у детей [23, 24].
Наш ранний опыт показал недостаточную эффективность у детей коагуляции кист радужки аргоновым лазером. Только у половины детей было получено полное сморщивание кисты без рецидива в течение 3 лет наблюдения [25]. С 1995 г. мы успешно применяем метод двухэтапной комбинированной (ИАГ/аргон-лазерной) цистодеструкции, разработанный проф. А.В. Степановым и д.м.н. А.Н. Ивановым (1989—1991), адаптированный нами для детей.
На основании прежнего опыта лазердеструкции 23 кист переднего отдела глаза у детей [23], взяв за основу их размер, мы пришли к выводу, что комбинированное лазерное лечение (ИАГ-лазер в комбинации с аргон-лазером, а позднее — с твердотельным лазером с диодной накачкой и удвоением частоты) показано при непрогрессирующих и прогрессирующих кистах, занимающих менее ½ площади радужки или передней камеры. Однако по мере накопления отдаленных результатов лечения 42 кист [24] мы пришли к заключению, что прогностически более значим не столько размер кист, сколько их этиология. Так, врожденные, даже большие, кисты гораздо реже прогрессируют, быстрее рубцуются после лазерной деструкции, чем небольшие, но посттравматические. Гигантские кисты, особенно посттравматические, в настоящее время считаются лазернеоперабельными.
Цель настоящей работы — описание клинического случая успешного лазерного лечения гигантской посттравматической кисты у ребенка.
Больной С. в возрасте 3 лет поступил в отдел патологии глаз у детей ФГБУ «МНИИ ГБ им. Гельмгольца» с диагнозом: посттравматическая киста радужки и передней камеры левого глаза (последствие проникающего корнеосклерального ранения, рубец роговицы, врастание эпителия в переднюю камеру?), иридокорнеальные сращения, цистохрусталиковые сращения с частичным помутнением передней капсулы хрусталика.
Из анамнеза: за год до обращения ребенок перенес проникающее ранение левого глаза ножницами, первичная хирургическая обработка была проведена на следующий день. Через 9 мес после травмы глаз покраснел, появились светобоязнь, слезотечение, ребенок постоянно трет глаз рукой. Правый глаз здоров (острота зрения 1,0).

При осмотре левого глаза отмечена смешанная инъекция глазного яблока, посттравматический корнеосклеральный рубец на 10—12 часах, сращенный с радужкой. Объемная посттравматическая киста занимает верхненаружный сектор передней камеры (с 9 до 13 часов), закрывает практически весь зрачок, сращена с его краем и передней капсулой хрусталика. Радужка под кистой отсутствует как результат первичной хирургической обработки или вследствие иридолизиса, вызванного кистой. Содержимое кисты прозрачно, сквозь кисту видно сращение края зрачка с передней капсулой хрусталика на 10—11 часах, яркий рефлекс с глазного дна. Через зрачок, закрытый кистой, офтальмоскопия невозможна (рис. 1, а). Рис. 1. Глаз ребенка С. 3 лет с посттравматической кистой радужки и передней камеры, сращенной с хрусталиком, до лечения. а — биомикроскопическая картина; б — результат ультразвуковой биомикроскопии. Внутриглазное давление (ВГД) ОD — 18 мм рт.ст., ОS — 24 мм рт.ст. по Маклакову. Острота зрения — счет пальцев у лица при вынужденном положении головы.
Ребенку проведено стандартное комплексное офтальмологическое обследование (визометрия, биомикроскопия, офтальмоскопия, тонометрия, фоторегистрация). Дополнительно были проведены высокотехнологичные исследования: ультразвуковое А- и В-сканирование, ультразвуковая биомикроскопия (см. рис. 1, б), электрофизиологические исследования — общая, ритмическая и макулярная электроретинография (ЭРГ), исследование зрительно-вызванных корковых потенциалов (ЗВКП) на вспышку, иммунологическое исследование — уровни антител к хрусталику и S-антигену сетчатки в слезной жидкости и сыворотке крови.
Электрофизиологические исследования выявили повышенные показатели общей ЭРГ («супер-ЭРГ») при нормальных показателях ритмической и макулярной ЭРГ и ЗВКП, что было расценено нами как раздражение нейроэпителия сетчатки.
Иммунологическое исследование сенсибилизации к антигенам хрусталика и S-антигену сетчатки не выявило.
Учитывая большие размеры кисты, ее радикальное инструментальное удаление было чревато риском серьезных операционных осложнений, поэтому была предложена попытка лазерного лечения.

Проведена этапная лазерная цистодеструкция (рис. 2) Рис. 2. Глаз того же ребенка в возрасте от 3 до 5 лет в процессе этапного лазерного лечения. а — после 1-го сеанса; б — после 2-го сеанса; в — после 3-го сеанса; г — после 4-го сеанса. с помощью комбинированной лазерной установки (деструктор + коагулятор): Visulas-532S Combi («Zeiss», Германия) и YAG YC-1800 в комбинации с Диод GYC-1000 («Nidek», Япония). Обязательно использовали контактные линзы (Манделькорна и/или Гольдмана) для точной фокусировки лазерного луча и фиксации глаза ребенка. Этапное лечение за несколько сеансов, по нашему опыту, позволяет уменьшить суммарную энергию и легче переносится детьми.
Для перфорации кисты и деструкции ее стенок использовали неодимовый ИАГ-лазер (иттрий-алюминиевый гранат, активированный неодимом) в режиме модуляции добротности (Q-switched) с длиной волны 1064 нм, длительностью импульса 2—4 нс, диаметром фокального пятна 8—50 мкм. Энергия импульса 1,5—2,5 мДж, число импульсов на сеанс до 130, суммарная энергия сеанса — не выше 300 мДж.
Для коагуляции рубцующихся остатков кисты использовали твердотельный лазер с диодной накачкой, с удвоением частоты, с длиной волны 532 нм, мощностью 0,25—1,0 Вт, диаметром фокального пятна 50—250 мкм, экспозицией 0,1 с.

На первом сеансе кисту вскрыли ИАГ-лазером — прозрачное содержимое ее вышло в переднюю камеру (см. рис. 2, а). Признаков реактивного циклита после сеанса не было. ВГД в пределах нормы (перед сеансом ребенок получил стандартную подготовку: внутрь диакарб однократно, местно азопт однократно, индоколлир 3 раза в день перед операцией и 3 дня после нее). На следующих 3 сеансах (в возрасте ребенка от 3 до 5 лет) с интервалом от 1 мес до 1 года поэтапно ИАГ-лазером производили разрушение стенок кисты (как только элементы кисты начинали проминировать за пределы рубцовых изменений ее ложа) с лазерной коагуляцией ее рубцующихся остатков, которые «приваривали» к радужке (см. рис. 2, б—г). Первые 3 сеанса проводили под наркозом. Последний сеанс под местной анестезией был выполнен 7 лет назад. В течение последних 7 лет наблюдения признаков роста кисты нет. В верхненаружном секторе на месте бывшей кисты наличие плоских рубцовых изменений радужки (рис. 3, а, Рис. 3. Состояние глаза того же ребенка в возрасте 13 лет (через 10 лет после этапного комбинированного лазерного лечения гигантской посттравматической кисты радужки и передней камеры). а — биомикроскопическая картина; б — внешний вид ребенка. б). Имеющееся иридокапсулярное сращение на 11 часах не изменяется в течение 10 лет наблюдения. Хрусталик за пределами сращения сохраняет полную прозрачность. Глаз спокоен. После 3-го сеанса (в 5-летнем возрасте) достигнута и сохраняется до настоящего времени острота зрения 1,0, чего после радикальной блок-эксцизии вряд ли бы удалось добиться.
Заключение
Анализ клинического случая успешного лазерного лечения гигантской посттравматической кисты радужки и передней камеры, выявленной у ребенка 3 лет, которого мы наблюдали после этапного лазерного лечения до 13-летнего возраста, а также наш 22-летний опыт лазерного лечения 42 кист переднего отдела глаза у детей [23, 24] позволили прийти к выводу, что попытка лазерного вскрытия и деструкции кист обоснована всегда — при любом, даже гигантском размере их у детей.
Конечно, в подобных случаях лазером не всегда удается откоагулировать зону роста кисты и предотвратить ее рецидив, особенно при подозрении на врастание эпителия внутрь глаза. Ведь достоверно установить врастание эпителия внутрь глаза можно только с помощью гистологического исследования удаленного глаза (после нередкой гибели его как органа). Однако даже в таких случаях лазерное лечение способно не допустить разрастания кисты в передней камере, поэтапно повторно вскрывая кисту по мере необходимости. Если в результате этапного лазерного лечения не удастся добиться полного рубцевания кисты, то даже частичное ее сморщивание с уменьшением размера предупреждает роговичный синдром и офтальмогипертензию, что немаловажно для сохранения глаза как органа. Кроме того, такую сморщившуюся после лазерного воздействия кисту небольшого размера удалить инструментально гораздо легче и менее травматично, чем гигантскую. Лазерная коагуляция стенок кисты предупреждает геморрагические осложнения возможной последующей радикальной инструментальной операции.
Относительным противопоказанием к лазерному устранению кист переднего отдела глаза следует считать только кисты с тотальным плоскостным васкуляризированным сращением ее передней стенки с роговицей, а также продолженный рост кисты после многократных безуспешных сеансов лазерного лечения. Оптимальные сроки лечения кист весьма индивидуальны, определяются клиническим состоянием глаз, их операбельностью, прогнозом, целями и техническими возможностями лазерного метода.
Во всех случаях, даже при гигантских кистах, лазерный метод дает шанс сохранения глаза, а в описанном случае — даже полного зрения без инструментального вскрытия глаза. Поэтому необходимо активно направлять на раннюю лазерную хирургию детей с кистами переднего отдела глаза любого размера, не допуская длительного наблюдения за ростом кист без попыток лазерного лечения, которое является высокоэффективной и малотравматичной альтернативой радикальной хирургии или неинвазивной попыткой сохранить глаз в инструментально неоперабельных случаях.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Арестова Наталия Николаевна — д-р мед. наук, вед. науч. сотр. отдела патологии глаз у детей, доцент кафедры глазных болезней ФПДО ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России
ФГБНУ «Научно-исследовательский институт глазных болезней»
ФГБНУ «Научно-исследовательский институт глазных болезней» Минобрнауки России
Аваскулярные отслойки ретинального пигментного эпителия при возрастной макулярной дегенерации
Журнал: Вестник офтальмологии. 2020;136(4): 284‑288
Отслойка ретинального пигментного эпителия сетчатки (ОРПЭС) — патологическое состояние, при котором пигментный эпителий сетчатки отделяется от подлежащей мембраны Бруха вследствие образования фиброваскулярной мембраны, друзеноидного материала, накопления жидкости и/или крови. Выделено 6 типов отслоек ретинального пигментного эпителия (РПЭ): псевдовителлиформные; отслойки, связанные со сливными друзами; серозные; сосудистые; геморрагические; отслойки, связанные с сосудистой аномалией сетчатки. Друзеноидная ОРПЭС всегда является аваскулярной, между РПЭ и мембраной Бруха содержится друзеноидный материал. Впервые описана A. Casswell в 1985 г. При офтальмоскопии на глазном дне определяется субретинальная, желто-белая ячеистая структура, иногда содержащая вкрапление пигмента, с неровной поверхностью, четкими границами и волнистым краем. Серозная ОРПЭС — большая по площади и проминенции, чем друзеноидная, характеризуется наличием гипорефлективной зоной под отслоенным РПЭ, по площади более 50% от всей площади отслойки. При офтальмоскопии определяется субретинальный прозрачно-желтый, иногда с коричневым оттенком очаг с четкими границами, куполообразно проминирующий. Истинная серозная ОРПЭС является аваскулярной (сочетание хориоидальной неоваскуляризации и серозной ОРПЭС мы рассмотрим в статье о васкуляризированных ОРПЭС).
Дата принятия в печать:
Отслойка ретинального пигментного эпителия (ОРПЭС) — патологическое состояние, при котором пигментный эпителий сетчатки отделяется от подлежащей мембраны Бруха вследствие образования фиброваскулярной мембраны, друзеноидного материала, накопления жидкости и/или крови [1]. Одним из первых классификацию ОРПЭС предложили M. Hartnett и соавторы в 1992 г. Авторы описали 6 типов отслоек ретинального пигментного эпителия (РПЭ): псевдовителлиформные, отслойки, связанные со сливными друзами, серозные, сосудистые и геморрагические, а также ОРПЭС, связанные с сосудистой аномалией сетчатки. Соотнесены типы отслоек РПЭ сетчатки с остротой зрения и анатомическими результатами. Самые низкие показатели наблюдались при ОРПЭС, связанных с неоваскуляризацией (сосудистых, геморрагических и сосудистых аномалиях). Глаза с псевдовителлиформными поражениями или сливными друзами имели лучший прогноз по зрению и анатомическим показателям. Субретинальная неоваскуляризация развилась в 16 (34%) глазах из серозных ОРПЭС в среднем за 25 мес. В случаях с псевдовителлиформной дистрофией и сливными друзами субретинальная неоваскуляризация встречалась редко. Предложенная система классификации может быть полезна для прогнозирования течения ОРПЭС [2]. В зависимости от патогенетических факторов развития ОРПЭС при возрастной макулярной дегенерации (ВМД) можно подразделить на следующие формы:
4. Геморрагическая [3].
Друзеноидная ОРПЭС — всегда аваскулярная, между РПЭ и мембраной Бруха содержится друзеноидный материал. Впервые описана A. Casswell в 1985 г. [4]. Формирование происходит за счет слияния большого количества преимущественно мягких друз. В мембране Бруха в процессе возрастных изменений происходят прогрессирующее утолщение двух коллагеновых слоев, модификация и дегенерация коллагена и эластина, повышение концентрации конечных продуктов гликирования, белков и липидов, и в финале — накопление конечных продуктов под РПЭ [5].
При офтальмоскопии на глазном дне определяется субретинальная, желто-белая ячеистая структура, иногда содержащая вкрапление пигмента, с неровной поверхностью, четкими границами и волнистым краем. При аутофлюоресценции (АФ) — гомогенная изоаутофлюоресценция, или гипераутофлюоресценция (средней интенсивности), возможна гипоаутофлюоресценция по краю и в местах скопления пигмента.
Флюоресцентная ангиография глазного дна (ФАГД) — на ранних фазах регистрируется гиперфлюоресценция средней интенсивности, с увеличением интенсивности по мере накопления флуоресцеина натрия под ОРПЭС к поздним фазам. Фокальные зоны, блокирующие флюоресцентный сигнал, соответствуют отложению пигмента. Ангиография глазного дна с индоцианином зеленым (ICGA) — гипофлюоресценция на протяжении всех фаз [6].
При оптической когерентной томографии (ОКТ) визуализируется ячеистая, куполообразная структура с волнистой поверхностью и подлежащей зоной гомогенного гиперрефлективного сигнала средней интенсивности. Участки отложения пигмента видны как интраретинальный гиперрефлективный материал высокой интенсивности. Над друзеноидной ОРПЭС можно обнаружить гиперрефлективную линию — ретинальный пигментный эпителий (рис. 1).

Рис. 1. Оптическая когерентная томограмма пациента с друзеноидной отслойкой ретинального пигментного эпителия сетчатки.
Течение друзеноидной ОРПЭС может быть разнообразным, она может существовать длительное время без изменений, может уменьшаться в размерах с развитием макулярной атрофии, терминальной стадией которой является географическая атрофия, или при росте хориоидальной неоваскуляризации (ХНВ) перейти в фиброваскулярный тип отслойки [7]. Персистенция друзеноидной ОРПЭС происходит в 38% случаев, развитие географической атрофии в 49% и только в 13% случаев под ней развивается ХНВ с переходом в фиброваскулярную ОРПЭС [5].
Начальный этап развития ОРПЭС характеризуется аккумуляцией друзеноидного материала между РПЭ и мембраной Бруха. Напряжение кислорода снижается на 30—50% у вершины в зависимости от роста друзеноидной ОРПЭС. Клетки РПЭ, лежащие на верхушке друзы, максимально удалены от хориокапилляров и могут мигрировать в поисках кислорода из капилляров сетчатки. Оставшиеся клетки РПЭ подвержены апоптозу, разрушению с переходом органелл клетки в состав друз [8]. Последующая фаза — регрессия, протекает с прогрессированием атрофии наружных слоев сетчатки по мере уменьшения количества клеток РПЭ на поверхности ОРПЭС. Процесс образования друзеноидного материала заканчивается, происходит «самоочищение» последнего, объем ОРПЭС уменьшается, и в конечном итоге наблюдается коллапс друзеноидной ОРПЭС, на месте которой регистрируется зона полной атрофии РПЭ и наружных слоев сетчатки (географическая атрофия). По мнению J. Sarks и соавторов, по мере увеличения как мягких сливных друз, так и друзеноидной ОРПЭС материал внутри них распадается и становится более тонким по своей природе, что приводит к более быстрому коллапсу друзы и развитию географической атрофии [9]. На ОКТ при этом можно наблюдать негомогенный характер друзеноидного материала с появлением гипорефлективных участков. Даже до явного развития географической атрофии ОРПЭС приводит к дисфункции фоторецепторов и последующей наружной атрофии сетчатки. Для друзеноидных ОРПЭС, выявленных на раннем этапе развития, характерна высокая острота зрения. Развитие наружной атрофии сетчатки в процессе существования ОРПЭС может объяснять потерю 15 и более букв в 26% случаев в отсутствие прогрессирования до поздней стадии ВМД (по классификации AREDS). При офтальмоскопии обнаружено, что при развитии гипопигментации риск снижения остроты зрения удваивается [7, 9] (рис. 2).

Рис. 2. Оптическая когерентная томограмма пациента с возрастной макулярной дегенерацией.
Жизненный цикл друзеноидной отслойки ретинального пигментного эпителия сетчатки от мягких друз до географической атрофии: а — 2013 г.; б — 2014 г.; в — 2015 г.; г — 2017 г.; д — 2018 г.
Гиперрефлективные локусы округлой формы на вершине аваскулярной ОРПЭС соответствуют «отторгающемуся» и «интраретинальному» фенотипам. Последние представляют собой интраретинальные включения РПЭ в наружном ядерном слое. При этом РПЭ также может быть обнаружен в непосредственной близости от капилляров и вплоть до слоя ганглиозных клеток сетчатки (ГКС). В процессе динамического наблюдения пациентов с друзеноидными ОРПЭС отмечено, что «отторгающий» фенотип является начальным этапом миграции клеток РПЭ в наружную сетчатку и в последующем переходит в «интраретинальный» фенотип. Существуют также сочетанные варианты. Миграция клеток РПЭ в наружные слои сетчатки приводит к истончению слоя РПЭ и развитию разрыва РПЭ, коллапса ОРПЭС и последующему формированию атрофии наружных слоев сетчатки и РПЭ [5]. Еще один фенотип друзеноидной ОРПЭС — «вителлиформный», служит плохим прогностическим признаком, поскольку приводит к выраженному снижению остроты зрения за счет быстрого развития географической атрофии. Считается, что образование вителлиформного материала у пациентов с ВМД происходит за счет разрушения РПЭ и наружных сегментов фоторецепторов вследствие дефекта фагоцитарной активности клеток РПЭ, что приводит к накоплению органелл РПЭ и дебриса наружных сегментов фоторецепторов [10—13].
Серозная ОРПЭС — большая по площади и проминенции, чем друзеноидная, характеризуется наличием гипорефлективной зоны под отслоенным РПЭ, составляет более 50% от всей площади отслойки. При офтальмоскопии определяется субретинальный прозрачно-желтый, иногда с коричневым оттенком очаг с четкими границами, куполообразно проминирующий. Истинно серозная ОРПЭС является аваскулярной (сочетание хориоидальной неоваскуляризации и серозной ОРПЭС мы рассмотрим в статье о васкуляризированных ОРПЭС). При формировании серозной ОРПЭС большое значение имеет жидкость, которая не может пройти из стекловидного тела в кровоток через мембрану Бруха и скапливается под пигментным эпителием сетчатки (ПЭС) на фоне изменения экстрацеллюлярного матрикса. Это приводит к повышенной осмолярности в зоне под ПЭС, и, как следствие, усиливается скопление жидкости по градиенту концентрации [1] (рис. 3).
Рис. 3. Оптическая когерентная томограмма пациента с серозной отслойкой ретинального пигментного эпителия сетчатки.
Аваскулярная серозная ОРПЭС при ВМД встречается редко, как правило, при ее обнаружении необходимо проводить дифференциальную диагностику с центральной серозной хориоретинопатией.
Выявлено, что очаговое повреждение клеток РПЭ при серозных, аваскулярных ОРПЭС является предиктором опускания купола отслойки, коллапса или развития разрыва РПЭ, что приводит к снижению остроты зрения. На ОКТ очаговое повреждение РПЭ на куполе ОРПЭС может выглядеть как зона ослабления сигнала с нарушением целостности монослоя РПЭ и штрихообразной гипертрансмиссией.
Таким образом, дифференциальная диагностика аваскулярных отслоек ретинального пигментного эпителия сетчатки имеет решающее значение для выбора дальнейшей тактики ведения пациентов.
Читайте также:
